第3节 第1课时 氧化还原反应的概念(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第一册)(共27张PPT)
文档属性
| 名称 | 第3节 第1课时 氧化还原反应的概念(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第一册)(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:04:19 | ||
图片预览






文档简介
(共27张PPT)
第一章 物质及其变化
第三节 氧化还原反应
课时1 氧化还原反应的概念
壹
贰
不同角度认识氧化还原反应
双线桥法表示电子转移
知识导航
本节重点
本节难点
课堂导入
生活中常见的铁生锈的现象:
常见的铁制品生锈现象涉及了什么化学变化?
2Fe+3O2=2Fe2O3
氧化反应
探究课堂
CuO、Fe2O3
C、CO
还原反应
氧化反应
得氧失氧
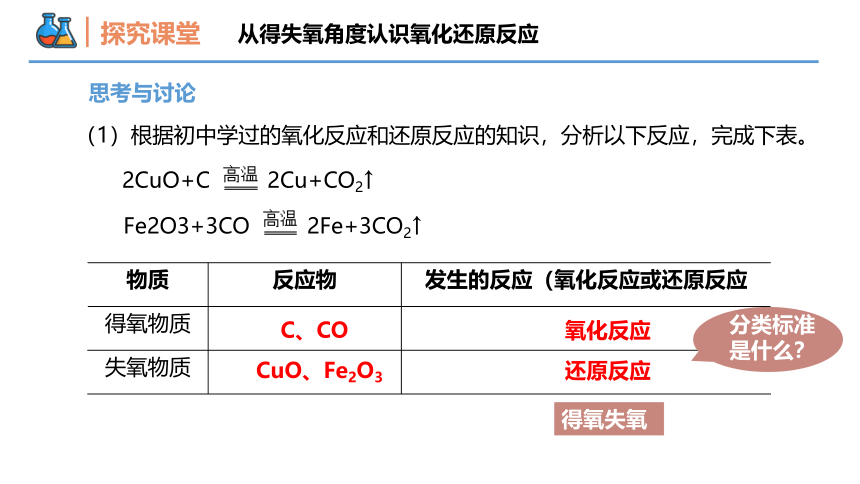
从得失氧角度认识氧化还原反应
思考与讨论
(1)根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2↑
物质 反应物 发生的反应(氧化反应或还原反应
得氧物质
失氧物质
分类标准是什么?
探究课堂
从得失氧角度认识氧化还原反应
在所列下面的两个反应中是否只发生了氧化反应或还原反应?
CuO+H2 Cu+ H2O
3CO+Fe2O3 2Fe+3CO2
发生了氧化反应
发生了还原反应
Fe2O3
Fe
得到O
CO
失去O
CO2
CuO
得到O
失去O
Cu
H2
H2O
发生了还原反应
发生了氧化反应
可见,有得必有失,有物质得到氧,必定有另一物质失去氧。
氧化反应和还原反应同时发生,相互依存,把这样的反应称为氧化还原反应。
探究课堂
从化合价角度认识氧化还原反应
2CuO + C
2Cu + CO2
+2 -2 0 0 +4 -2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
探究课堂
从化合价角度认识氧化还原反应
+2
0
+2
0
化合价升高
0
化合价升高
+1
-1
0
化合价降低
化合价降低
有无得失氧元素?
元素化合价发生变化的反应也是氧化还原反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
氧化反应
氧化反应
还原反应
还原反应
得失氧是狭隘的判断方式,元素化合价的变化是氧化还原反应的重要特征(特征判据)
探究课堂
化学反应
氧化还原反应
非氧化还原反应
反应前后是否有
元素化合价的变化
从化合价角度认识氧化还原反应
探究课堂
【例1】下列反应中,不属于氧化还原反应的是( )
A. 3CuS+8HNO3(稀)===3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 6KOH+3Cl2===5KCl+KClO3+3H2O
C. Ba(OH)2+Na2SO4===BaSO4↓+2NaOH
D. Fe2O3 +2Al===Al2O3 + 2Fe
C
从化合价角度认识氧化还原反应
探究课堂
【例2】下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1) NaCl→Cl2 (2) KMnO4→MnCl2
(3) Fe2O3→Fe (4) CO→CO2
被氧化
被还原
被还原
被氧化
从化合价角度认识氧化还原反应
探究课堂
【变式1】下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 = H2SO4+2HCl B . SO2+2H2S = 2H2O+3S↓
C . SO2+2NaOH = Na2SO3+H2O D . SO2+Na2CO3 = Na2SO3+CO2↑
【变式2】当化合物中的元素被转化成单质中的元素时,该元素( )
A.一定被氧化; B. 一定被还原;
C.可能被氧化,也可能被还原; D. 化合价降低为0。
B
C
从化合价角度认识氧化还原反应
探究课堂
分析下列反应,从四大基本反应类型的角度进行分类,并指出哪些反应属于氧化还原反应。
化学反应 基本类型 氧化还原反应
分解反应
复分解反应
化合反应
置换反应
分解反应
置换反应
复分解反应
复分解反应
化合反应
氧化还原反应
氧化还原反应
非氧化还原反应
氧化还原反应
非氧化还原反应
氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应与四大基本反应的关系
探究课堂
化合反应、分解反应______________氧化还原反应;
置换反应______________氧化还原反应;
复分解反应______________氧化还原反应;
不一定是
一定是
一定不是
化合反应:有单质参加的是氧化还原反应。
分解反应:有单质生成的是氧化还原反应。
氧化还原反应与四大基本反应的关系
探究课堂
【例3】下列关于化学反应的说法中正确的是 ( )
A . 化合反应一定是氧化还原反应
B . 有单质生成的分解反应一定是氧化还原反应
C . 置换反应有可能是氧化还原反应;
D . 复分解反应不一定是氧化还原反应
B
氧化还原反应与四大基本反应的关系
探究课堂
【变式】氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
A. 2Na2O2+2CO2=2Na2CO3+O2
B. 2NaHCO3=Na2CO3+H2O+CO2↑
C. 4Fe(OH)3+O2+2H2O=4Fe(OH)3
D. Cl2+2KBr=Br2+2KCl
A
四大基本反应类型包括所有的化学反应了吗?
氧化还原反应与四大基本反应的关系
探究课堂
3O2 2O3
不属于四种基本反应类型中的任何一种反应类型,但却属于氧化还原反应
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
不属于四种基本反应类型,但属于非氧化还原反应
氧化还原反应与四大基本反应的关系
探究课堂
从电子转移角度认识氧化还原反应
思考:为什么氧化还原反应前后会有化合价改变呢?
钠在氯气中的燃烧
探究课堂
从宏观物质看,钠在氯气中剧烈燃烧, 发出黄光,并有白色固体氯化钠生成。
下面我们从微观角度探究钠原子和氯原子的反应历程。
下列原子结构示意图中,哪些原子容易得到电子,哪些原子容易失去电子?
当原子最外层电子数为多少时达到稳定结构?
八隅体规则(或称八电子规则):
当原子的最外层电子数为8(只有一个电子层时,为2)最稳定。
思
考
从电子转移角度认识氧化还原反应
探究课堂
从电子转移角度认识氧化还原反应
+11
+17
+17
+11
Na+ Cl-
Na
Cl
0 0 +1 -1
失去2×e-、化合价升高,被氧化
得到2×e-、化合价降低,被还原
微观探析
引起化合价变化的根本原因?
结论:化合价升降的原因——电子得失
Cl-
Na+
探究课堂
从电子转移角度认识氧化还原反应
氯化氢的形成过程,是不是也有电子的得失呢?
微观探析
引起化合价变化的根本原因?
0 0 +1 -1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
结论:化合价升降的原因--共用电子对偏移
H
Cl
均不容易失去e-
共用电子对
偏向氯,偏离氢
+17
+1
H Cl
+1 -1
+1
+17
探究课堂
氧化还原反应的宏观特征
氧化还原反应的微观本质
元素化合价的升降
电子的转移
(电子的得失或共用电子对的偏移)
根本原因
化合价升降、电子转移、反应类型的关系:
失电子或电子对偏离
化合价升高
被氧化
得电子或电子对偏向
化合价降低
被还原
还原反应
升失氧,降得还
氧化反应
探究课堂
氧化还原反应电子转移的表示方法
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
价态变化原子个数 × 每个原子得失电子数
先标化合价,再看价变化;
起止同元素,桥上标变化。
口诀
探究课堂
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
得
3e-
Fe
2
×
有2个Fe被还原
1个Fe得到3e-
失3×2e-
CO2
电子
注意事项
① 箭头、箭尾必须对应化合价变化的同种元素的原子;
② 双线桥上必须注明“得到”或“失去”;
③ 转移电子数 = 氧化剂“得”电子数 = 还原剂“失”电子数 =
变价原子数×单个变价原子得(失)电子数
双线桥法
氧化还原反应电子转移的表示方法
探究课堂
【例4】用双线桥法表示下列方程式电子转移的方向和数目
2Na + 2H2O=2NaOH+ H2↑
0 +1 +1 0
失去2×1e-
+2 0 0 +1
得到2×1e-
得到1×2e-
失去2×1e-
标价态
连双线
注得失
CuO + H2 Cu + H2O
氧化还原反应电子转移的表示方法
课堂小结
随堂练习
【综合运用】 判断正误
1. 得电子难的元素容易失去电子( )
2. 一种元素被氧化,一定有另一种元素被还原( )
3. 元素由化合价转变为游离态时被氧化( )
4. 有单质参加或生成的反应一定是氧化还原反应( )
×
×
×
×
谢谢观看
THANKS
第一章 物质及其变化
第三节 氧化还原反应
课时1 氧化还原反应的概念
壹
贰
不同角度认识氧化还原反应
双线桥法表示电子转移
知识导航
本节重点
本节难点
课堂导入
生活中常见的铁生锈的现象:
常见的铁制品生锈现象涉及了什么化学变化?
2Fe+3O2=2Fe2O3
氧化反应
探究课堂
CuO、Fe2O3
C、CO
还原反应
氧化反应
得氧失氧
从得失氧角度认识氧化还原反应
思考与讨论
(1)根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2↑
物质 反应物 发生的反应(氧化反应或还原反应
得氧物质
失氧物质
分类标准是什么?
探究课堂
从得失氧角度认识氧化还原反应
在所列下面的两个反应中是否只发生了氧化反应或还原反应?
CuO+H2 Cu+ H2O
3CO+Fe2O3 2Fe+3CO2
发生了氧化反应
发生了还原反应
Fe2O3
Fe
得到O
CO
失去O
CO2
CuO
得到O
失去O
Cu
H2
H2O
发生了还原反应
发生了氧化反应
可见,有得必有失,有物质得到氧,必定有另一物质失去氧。
氧化反应和还原反应同时发生,相互依存,把这样的反应称为氧化还原反应。
探究课堂
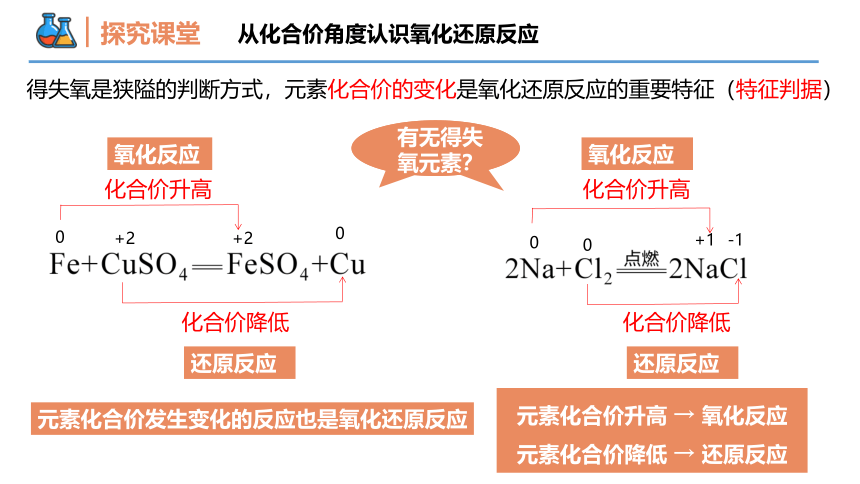
从化合价角度认识氧化还原反应
2CuO + C
2Cu + CO2
+2 -2 0 0 +4 -2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
探究课堂
从化合价角度认识氧化还原反应
+2
0
+2
0
化合价升高
0
化合价升高
+1
-1
0
化合价降低
化合价降低
有无得失氧元素?
元素化合价发生变化的反应也是氧化还原反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
氧化反应
氧化反应
还原反应
还原反应
得失氧是狭隘的判断方式,元素化合价的变化是氧化还原反应的重要特征(特征判据)
探究课堂
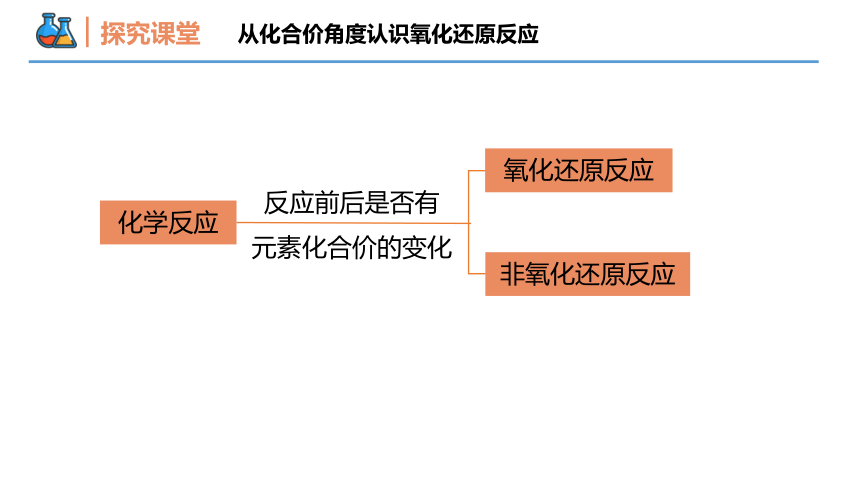
化学反应
氧化还原反应
非氧化还原反应
反应前后是否有
元素化合价的变化
从化合价角度认识氧化还原反应
探究课堂
【例1】下列反应中,不属于氧化还原反应的是( )
A. 3CuS+8HNO3(稀)===3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 6KOH+3Cl2===5KCl+KClO3+3H2O
C. Ba(OH)2+Na2SO4===BaSO4↓+2NaOH
D. Fe2O3 +2Al===Al2O3 + 2Fe
C
从化合价角度认识氧化还原反应
探究课堂
【例2】下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1) NaCl→Cl2 (2) KMnO4→MnCl2
(3) Fe2O3→Fe (4) CO→CO2
被氧化
被还原
被还原
被氧化
从化合价角度认识氧化还原反应
探究课堂
【变式1】下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 = H2SO4+2HCl B . SO2+2H2S = 2H2O+3S↓
C . SO2+2NaOH = Na2SO3+H2O D . SO2+Na2CO3 = Na2SO3+CO2↑
【变式2】当化合物中的元素被转化成单质中的元素时,该元素( )
A.一定被氧化; B. 一定被还原;
C.可能被氧化,也可能被还原; D. 化合价降低为0。
B
C
从化合价角度认识氧化还原反应
探究课堂
分析下列反应,从四大基本反应类型的角度进行分类,并指出哪些反应属于氧化还原反应。
化学反应 基本类型 氧化还原反应
分解反应
复分解反应
化合反应
置换反应
分解反应
置换反应
复分解反应
复分解反应
化合反应
氧化还原反应
氧化还原反应
非氧化还原反应
氧化还原反应
非氧化还原反应
氧化还原反应
非氧化还原反应
非氧化还原反应
非氧化还原反应
氧化还原反应与四大基本反应的关系
探究课堂
化合反应、分解反应______________氧化还原反应;
置换反应______________氧化还原反应;
复分解反应______________氧化还原反应;
不一定是
一定是
一定不是
化合反应:有单质参加的是氧化还原反应。
分解反应:有单质生成的是氧化还原反应。
氧化还原反应与四大基本反应的关系
探究课堂
【例3】下列关于化学反应的说法中正确的是 ( )
A . 化合反应一定是氧化还原反应
B . 有单质生成的分解反应一定是氧化还原反应
C . 置换反应有可能是氧化还原反应;
D . 复分解反应不一定是氧化还原反应
B
氧化还原反应与四大基本反应的关系
探究课堂
【变式】氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
A. 2Na2O2+2CO2=2Na2CO3+O2
B. 2NaHCO3=Na2CO3+H2O+CO2↑
C. 4Fe(OH)3+O2+2H2O=4Fe(OH)3
D. Cl2+2KBr=Br2+2KCl
A
四大基本反应类型包括所有的化学反应了吗?
氧化还原反应与四大基本反应的关系
探究课堂
3O2 2O3
不属于四种基本反应类型中的任何一种反应类型,但却属于氧化还原反应
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
不属于四种基本反应类型,但属于非氧化还原反应
氧化还原反应与四大基本反应的关系
探究课堂
从电子转移角度认识氧化还原反应
思考:为什么氧化还原反应前后会有化合价改变呢?
钠在氯气中的燃烧
探究课堂
从宏观物质看,钠在氯气中剧烈燃烧, 发出黄光,并有白色固体氯化钠生成。
下面我们从微观角度探究钠原子和氯原子的反应历程。
下列原子结构示意图中,哪些原子容易得到电子,哪些原子容易失去电子?
当原子最外层电子数为多少时达到稳定结构?
八隅体规则(或称八电子规则):
当原子的最外层电子数为8(只有一个电子层时,为2)最稳定。
思
考
从电子转移角度认识氧化还原反应
探究课堂
从电子转移角度认识氧化还原反应
+11
+17
+17
+11
Na+ Cl-
Na
Cl
0 0 +1 -1
失去2×e-、化合价升高,被氧化
得到2×e-、化合价降低,被还原
微观探析
引起化合价变化的根本原因?
结论:化合价升降的原因——电子得失
Cl-
Na+
探究课堂
从电子转移角度认识氧化还原反应
氯化氢的形成过程,是不是也有电子的得失呢?
微观探析
引起化合价变化的根本原因?
0 0 +1 -1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
结论:化合价升降的原因--共用电子对偏移
H
Cl
均不容易失去e-
共用电子对
偏向氯,偏离氢
+17
+1
H Cl
+1 -1
+1
+17
探究课堂
氧化还原反应的宏观特征
氧化还原反应的微观本质
元素化合价的升降
电子的转移
(电子的得失或共用电子对的偏移)
根本原因
化合价升降、电子转移、反应类型的关系:
失电子或电子对偏离
化合价升高
被氧化
得电子或电子对偏向
化合价降低
被还原
还原反应
升失氧,降得还
氧化反应
探究课堂
氧化还原反应电子转移的表示方法
双线桥法
标价态
正确标出反应前后各元素化合价明确变价元素的化合价升降关系
连双线
一条线始于反应物中的降价元素,止于产物中同种元素
另一条线始于反应物中的升价元素,止于产物中同种元素
注得失
正确标出反应前后“得到”电子或“失去”电子总数
基本步骤
价态变化原子个数 × 每个原子得失电子数
先标化合价,再看价变化;
起止同元素,桥上标变化。
口诀
探究课堂
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
得
3e-
Fe
2
×
有2个Fe被还原
1个Fe得到3e-
失3×2e-
CO2
电子
注意事项
① 箭头、箭尾必须对应化合价变化的同种元素的原子;
② 双线桥上必须注明“得到”或“失去”;
③ 转移电子数 = 氧化剂“得”电子数 = 还原剂“失”电子数 =
变价原子数×单个变价原子得(失)电子数
双线桥法
氧化还原反应电子转移的表示方法
探究课堂
【例4】用双线桥法表示下列方程式电子转移的方向和数目
2Na + 2H2O=2NaOH+ H2↑
0 +1 +1 0
失去2×1e-
+2 0 0 +1
得到2×1e-
得到1×2e-
失去2×1e-
标价态
连双线
注得失
CuO + H2 Cu + H2O
氧化还原反应电子转移的表示方法
课堂小结
随堂练习
【综合运用】 判断正误
1. 得电子难的元素容易失去电子( )
2. 一种元素被氧化,一定有另一种元素被还原( )
3. 元素由化合价转变为游离态时被氧化( )
4. 有单质参加或生成的反应一定是氧化还原反应( )
×
×
×
×
谢谢观看
THANKS
