6.2.2 化学反应的限度(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共27张PPT)
文档属性
| 名称 | 6.2.2 化学反应的限度(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:08:56 | ||
图片预览







文档简介
(共27张PPT)
第二节 化学反应的速率与限度
课时2 化学反应的限度
第六章 化学反应与能量
贰
知识导航
本节重难点
化学反应限度
壹
化学反应条件的控制
贰
课堂导入
阅读:P48 科学史话,从这一材料中,你得到什么启示?
增加炼铁高炉的高度,不能改变高炉尾气中CO的比例,原因是:
C+CO2 2CO是一个可逆反应,不能完全进行,存在一定的反应限度。在高炉中Fe2O3与CO的反应也不能全部转化为Fe和CO2。
炼铁高炉尾气之谜
探究课堂
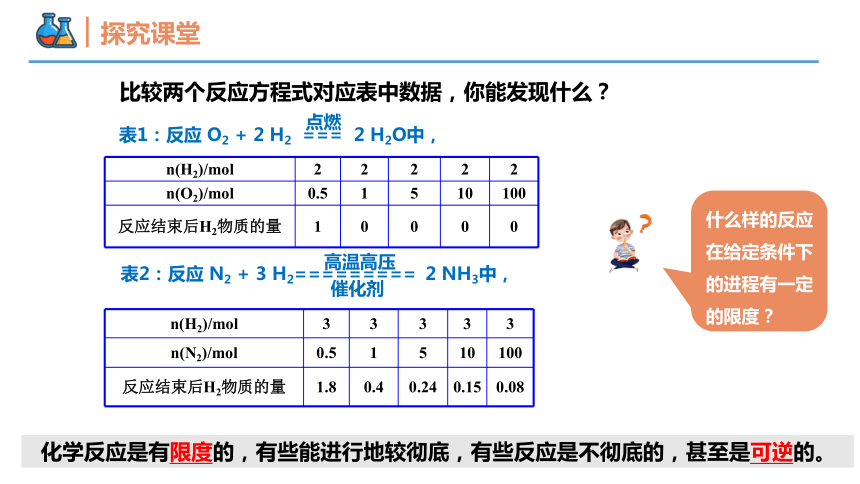
比较两个反应方程式对应表中数据,你能发现什么?
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
表1:反应 O2 + 2 H2 === 2 H2O中,
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
什么样的反应在给定条件下的进程有一定的限度?
探究课堂
什么是可逆反应?
在同一条件下,
既能向正反应方向进行,同时又能向逆反应方向进行的反应。
探究课堂
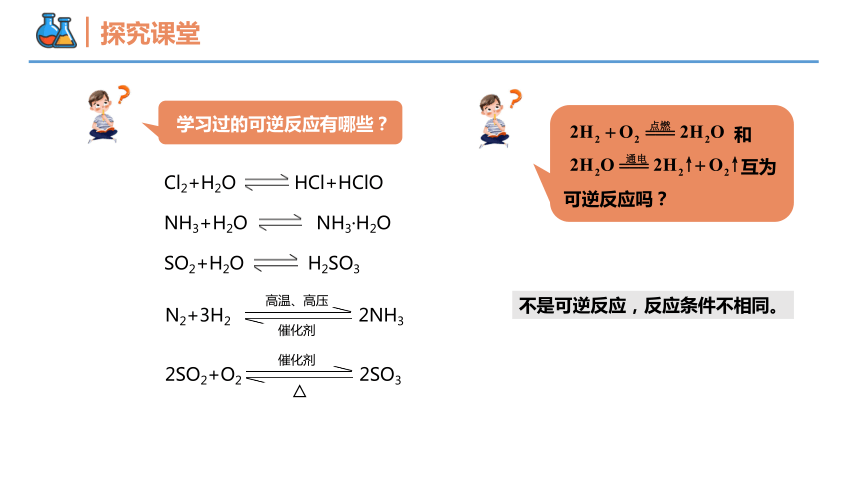
学习过的可逆反应有哪些?
Cl2+H2O HCl+HClO
NH3+H2O NH3·H2O
SO2+H2O H2SO3
N2+3H2 2NH3
高温、高压
催化剂
2SO2+O2 2SO3
催化剂
△
和
互为可逆反应吗?
不是可逆反应,反应条件不相同。
探究课堂
可逆反应的特点
1、双向性
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行。
【思考】对于可逆反应 向反应容器中充入 N2 和 H2 ,可生成 NH3 ;
若向反应容器中充入 NH3 ,______ 得到 N2 (“能”或“不能”) 。
能
探究课堂
可逆反应的特点
可逆反应不能完全进行,反应物不能完全被消耗,反应物转化率小于100%。
2、不完全性
【思考】对于可逆 反应 ,向反应容器中充入1 mol N2 和 3 mol H2 ,
充分反应后,
①反应容器中 ____ N2 剩余(“有”或“无”);
②最终可得到 ____________ mol NH3 。
小于 2
有
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应刚开始时,浓度、速率有什么特点?
开始时c(SO2) 、c(O2)大, c(SO3) = 0
只有正反应进行,v(逆)=0
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应一段时间后,浓度、速率有什么特点?
c(SO2) 、c(O2) 逐渐变小,c(SO3) 逐渐增大,三种物质的浓度达到一个特定值
正逆反应都进行, v(正)逐渐减小, v(逆)逐渐增大,最终 v(正) =v(逆)≠ 0
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应开始时 反应进行时 反应50min后 宏观 物料角度 c(反应物) ____ 0 c(反应物) ______ c(反应物)______ c(生成物) ____ 0 c(生成物) ______ c(生成物)______ 微观 速率角度 v正 ____ 0 v正 ______ v正 ______
v逆 ____ 0 v逆 ______ v逆 ______ >
=
>
=
减小
增大
减小
增大
不变
不变
不变
不变
探究课堂
如何用图像描述 v正 和 v逆 变化规律 ?
时间
速率
O
正反应
逆反应
O
时间
浓度
生成物
反应物
平衡时:C反、C生不再变化, 达到了平衡状态,v正=v逆≠0
反应开始时:C反最大, v正最大;
反应进行过程中:C反↓, v正↓;
C生=0 , v逆=0
C生↑ v逆↑
探究课堂
【例1】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),
673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是( )
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
B
高温、高压
催化剂
探究课堂
化学平衡状态
(1)定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
(2)对化学平衡状态的理解:
前提(适用范围):
内在本质:
外在标志:
可逆反应
v(正)= v(逆) ≠0
反应混合物中各组分的浓度保持不变
探究课堂
化学平衡状态
(3) 化学平衡状态的特征
逆
定
动
等
变
化学平衡状态研究的对象是可逆反应
达到化学平衡状态后,各组分浓度不再改变,不随时间变化而变化
达到化学平衡状态时,正反应速率和逆反应速率相等
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡
探究课堂
化学平衡状态的判断
你觉得这些特征中,哪些可以说明一个可逆反应达到了一定条件下的反应限度(化学平衡状态)?
“等”
“定”
--标志
探究课堂
如何理解 v正 = v逆?
核心:1、有正有逆的描述;2、转化为同一物质速率相等
【例2】一定条件下,对于可逆反应N2+3H2 2NH3,表示正、逆反应速率可以用N2或H2或NH3来表示:下列能表示反应达到化学平衡状态的是
(1)单位时间内,有1mol N2消耗,同时有1mol N2生成
(2)单位时间内,有3mol H2消耗,同时有2mol NH3生成
(3)单位时间内,有1mol N2消耗,同时有3mol H2消耗
(4)1mol N三N 键断裂的同时有2mol N-H 键断裂
(5)2v正(N2)=v逆(NH3)
(1) (5)
有正有逆
符合比例
探究课堂
如何理解 “定”?
核心:一个量随反应一直变,突然不变
变量不变 即平衡
【例3】一定条件下,对于可逆反应N2+3H2 2NH3,表示正、逆反应速率可以用N2或H2或NH3来表示,下列能表示反应达到化学平衡状态的是
(1)容器内氮气的物质的量不再改变
(2)容器内颜色不再改变
(3)固定容器恒容条件下,容器内压强不再改变
(4)固定容器恒容条件下,容器内气体密度不再改变
(5)恒容或恒压条件,容器内平均相对分子质量不再改变
(1) (3) (5)
探究课堂
【例4】下列说法中可以证明2HI(g) H2(g)+I2(g)(紫色)
已达到平衡状态的是___________。
① 单位时间内生成 n mol H2 的同时生成 n mol HI
② 一个H-H键断裂的同时有两个H-I键断裂
③ 反应速率 v(H2) = v(I2) 时
④ c(HI):c(H2):c(I2) = 2:1:1时
⑤ 温度和体积一定,容器内压强不再变化时
⑥ 温度和体积一定,混合气体的颜色不再变化时
⑦ 条件一定,混合气体的平均相对分子质量不再变化时
⑧ 温度和压强一定,混合气体的密度不再变化时
② ⑥
探究课堂
化学平衡状态是可逆反应在一定条件下所能达到或完成的最大程度,即该反应的限度。
② 同一可逆反应,不同条件下,化学反应的限度不同,即:
改变条件可以在一定程度上改变一个化学反应的限度。
① 化学反应的限度决定了反应物在一定条件下的最大转化率。
化学平衡状态的限度
探究课堂
化学反应条件的控制
1. 控制化学反应条件的目的
促进有利反应:
提高反应物的转化率即原料的利用率,加快反应速率等
抑制有害反应:
减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等
2. 控制化学反应条件的方法
改变化学反应速率:
改变温度、溶液的浓度、气体压强(或浓度)、固体表面积及使用催化剂等
改变可逆反应进行的程度:
改变温度、溶液浓度、气体压强(或浓度)等
探究课堂
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
煤燃烧时,将煤块粉碎成煤粉:
增大与空气中O2的接触面积,煤粉燃烧更充分,反应速率更快
通入适当过量的空气:
增大O2浓度煤粉充分燃烧,生成CO2,放出更多的热量;
同时避免不充分燃烧,生成CO,造成环境污染
炉膛材料尽量选择保温性能好的,烟道废气中的热量用来加热水、发电等,以提高热量利用率。
探究课堂
从速率和平衡的角度分析,
为什么工业上通常采用400-500℃,10-30Mpa条件合成氨气?
温度较低时氨的产率较高,但温度低时反应速率小,达到平衡需要的时间很长生产成本高
压强越大,氨的产率越高,但对动力和生产设备的要求越高
400~500℃
10 MPa~ 30 MPa
探究课堂
【例5】下列措施可以提高燃料燃烧效率的是 (填序号)。
①提高燃料的着火点
②降低燃料的着火点
③将固体燃料粉碎
④将液体燃料雾化处理
⑤将煤进行气化处理
⑥通入适当过量的空气
③ ④ ⑤ ⑥
探究课堂
【例6】下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
课堂小结
化学反应的限度
化学反应限度
化学反应条件的控制
可逆反应
化学平衡状态的建立
化学平衡状态及标志
方法
目的
化学反应的限度
抑制有害的化学反应
促进有利的化学反应
改变可逆反应进行的程度
改变化学反应速率
谢谢观看
THANKS
第二节 化学反应的速率与限度
课时2 化学反应的限度
第六章 化学反应与能量
贰
知识导航
本节重难点
化学反应限度
壹
化学反应条件的控制
贰
课堂导入
阅读:P48 科学史话,从这一材料中,你得到什么启示?
增加炼铁高炉的高度,不能改变高炉尾气中CO的比例,原因是:
C+CO2 2CO是一个可逆反应,不能完全进行,存在一定的反应限度。在高炉中Fe2O3与CO的反应也不能全部转化为Fe和CO2。
炼铁高炉尾气之谜
探究课堂
比较两个反应方程式对应表中数据,你能发现什么?
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
表1:反应 O2 + 2 H2 === 2 H2O中,
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
什么样的反应在给定条件下的进程有一定的限度?
探究课堂
什么是可逆反应?
在同一条件下,
既能向正反应方向进行,同时又能向逆反应方向进行的反应。
探究课堂
学习过的可逆反应有哪些?
Cl2+H2O HCl+HClO
NH3+H2O NH3·H2O
SO2+H2O H2SO3
N2+3H2 2NH3
高温、高压
催化剂
2SO2+O2 2SO3
催化剂
△
和
互为可逆反应吗?
不是可逆反应,反应条件不相同。
探究课堂
可逆反应的特点
1、双向性
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行。
【思考】对于可逆反应 向反应容器中充入 N2 和 H2 ,可生成 NH3 ;
若向反应容器中充入 NH3 ,______ 得到 N2 (“能”或“不能”) 。
能
探究课堂
可逆反应的特点
可逆反应不能完全进行,反应物不能完全被消耗,反应物转化率小于100%。
2、不完全性
【思考】对于可逆 反应 ,向反应容器中充入1 mol N2 和 3 mol H2 ,
充分反应后,
①反应容器中 ____ N2 剩余(“有”或“无”);
②最终可得到 ____________ mol NH3 。
小于 2
有
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应刚开始时,浓度、速率有什么特点?
开始时c(SO2) 、c(O2)大, c(SO3) = 0
只有正反应进行,v(逆)=0
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应一段时间后,浓度、速率有什么特点?
c(SO2) 、c(O2) 逐渐变小,c(SO3) 逐渐增大,三种物质的浓度达到一个特定值
正逆反应都进行, v(正)逐渐减小, v(逆)逐渐增大,最终 v(正) =v(逆)≠ 0
探究课堂
化学平衡状态的建立
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
在某固定密闭容器中发生反应:2SO2+O2 2SO3,各物质浓度随反应时间变化如下:
催化剂
△
反应开始时 反应进行时 反应50min后 宏观 物料角度 c(反应物) ____ 0 c(反应物) ______ c(反应物)______ c(生成物) ____ 0 c(生成物) ______ c(生成物)______ 微观 速率角度 v正 ____ 0 v正 ______ v正 ______
v逆 ____ 0 v逆 ______ v逆 ______ >
=
>
=
减小
增大
减小
增大
不变
不变
不变
不变
探究课堂
如何用图像描述 v正 和 v逆 变化规律 ?
时间
速率
O
正反应
逆反应
O
时间
浓度
生成物
反应物
平衡时:C反、C生不再变化, 达到了平衡状态,v正=v逆≠0
反应开始时:C反最大, v正最大;
反应进行过程中:C反↓, v正↓;
C生=0 , v逆=0
C生↑ v逆↑
探究课堂
【例1】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),
673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是( )
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
B
高温、高压
催化剂
探究课堂
化学平衡状态
(1)定义:
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
(2)对化学平衡状态的理解:
前提(适用范围):
内在本质:
外在标志:
可逆反应
v(正)= v(逆) ≠0
反应混合物中各组分的浓度保持不变
探究课堂
化学平衡状态
(3) 化学平衡状态的特征
逆
定
动
等
变
化学平衡状态研究的对象是可逆反应
达到化学平衡状态后,各组分浓度不再改变,不随时间变化而变化
达到化学平衡状态时,正反应速率和逆反应速率相等
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡
探究课堂
化学平衡状态的判断
你觉得这些特征中,哪些可以说明一个可逆反应达到了一定条件下的反应限度(化学平衡状态)?
“等”
“定”
--标志
探究课堂
如何理解 v正 = v逆?
核心:1、有正有逆的描述;2、转化为同一物质速率相等
【例2】一定条件下,对于可逆反应N2+3H2 2NH3,表示正、逆反应速率可以用N2或H2或NH3来表示:下列能表示反应达到化学平衡状态的是
(1)单位时间内,有1mol N2消耗,同时有1mol N2生成
(2)单位时间内,有3mol H2消耗,同时有2mol NH3生成
(3)单位时间内,有1mol N2消耗,同时有3mol H2消耗
(4)1mol N三N 键断裂的同时有2mol N-H 键断裂
(5)2v正(N2)=v逆(NH3)
(1) (5)
有正有逆
符合比例
探究课堂
如何理解 “定”?
核心:一个量随反应一直变,突然不变
变量不变 即平衡
【例3】一定条件下,对于可逆反应N2+3H2 2NH3,表示正、逆反应速率可以用N2或H2或NH3来表示,下列能表示反应达到化学平衡状态的是
(1)容器内氮气的物质的量不再改变
(2)容器内颜色不再改变
(3)固定容器恒容条件下,容器内压强不再改变
(4)固定容器恒容条件下,容器内气体密度不再改变
(5)恒容或恒压条件,容器内平均相对分子质量不再改变
(1) (3) (5)
探究课堂
【例4】下列说法中可以证明2HI(g) H2(g)+I2(g)(紫色)
已达到平衡状态的是___________。
① 单位时间内生成 n mol H2 的同时生成 n mol HI
② 一个H-H键断裂的同时有两个H-I键断裂
③ 反应速率 v(H2) = v(I2) 时
④ c(HI):c(H2):c(I2) = 2:1:1时
⑤ 温度和体积一定,容器内压强不再变化时
⑥ 温度和体积一定,混合气体的颜色不再变化时
⑦ 条件一定,混合气体的平均相对分子质量不再变化时
⑧ 温度和压强一定,混合气体的密度不再变化时
② ⑥
探究课堂
化学平衡状态是可逆反应在一定条件下所能达到或完成的最大程度,即该反应的限度。
② 同一可逆反应,不同条件下,化学反应的限度不同,即:
改变条件可以在一定程度上改变一个化学反应的限度。
① 化学反应的限度决定了反应物在一定条件下的最大转化率。
化学平衡状态的限度
探究课堂
化学反应条件的控制
1. 控制化学反应条件的目的
促进有利反应:
提高反应物的转化率即原料的利用率,加快反应速率等
抑制有害反应:
减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等
2. 控制化学反应条件的方法
改变化学反应速率:
改变温度、溶液的浓度、气体压强(或浓度)、固体表面积及使用催化剂等
改变可逆反应进行的程度:
改变温度、溶液浓度、气体压强(或浓度)等
探究课堂
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
煤燃烧时,将煤块粉碎成煤粉:
增大与空气中O2的接触面积,煤粉燃烧更充分,反应速率更快
通入适当过量的空气:
增大O2浓度煤粉充分燃烧,生成CO2,放出更多的热量;
同时避免不充分燃烧,生成CO,造成环境污染
炉膛材料尽量选择保温性能好的,烟道废气中的热量用来加热水、发电等,以提高热量利用率。
探究课堂
从速率和平衡的角度分析,
为什么工业上通常采用400-500℃,10-30Mpa条件合成氨气?
温度较低时氨的产率较高,但温度低时反应速率小,达到平衡需要的时间很长生产成本高
压强越大,氨的产率越高,但对动力和生产设备的要求越高
400~500℃
10 MPa~ 30 MPa
探究课堂
【例5】下列措施可以提高燃料燃烧效率的是 (填序号)。
①提高燃料的着火点
②降低燃料的着火点
③将固体燃料粉碎
④将液体燃料雾化处理
⑤将煤进行气化处理
⑥通入适当过量的空气
③ ④ ⑤ ⑥
探究课堂
【例6】下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
课堂小结
化学反应的限度
化学反应限度
化学反应条件的控制
可逆反应
化学平衡状态的建立
化学平衡状态及标志
方法
目的
化学反应的限度
抑制有害的化学反应
促进有利的化学反应
改变可逆反应进行的程度
改变化学反应速率
谢谢观看
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
