6.1.1 化学反应与热能(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共31张PPT)
文档属性
| 名称 | 6.1.1 化学反应与热能(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:09:43 | ||
图片预览








文档简介
(共31张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
课时1 化学反应与热能
贰
叁
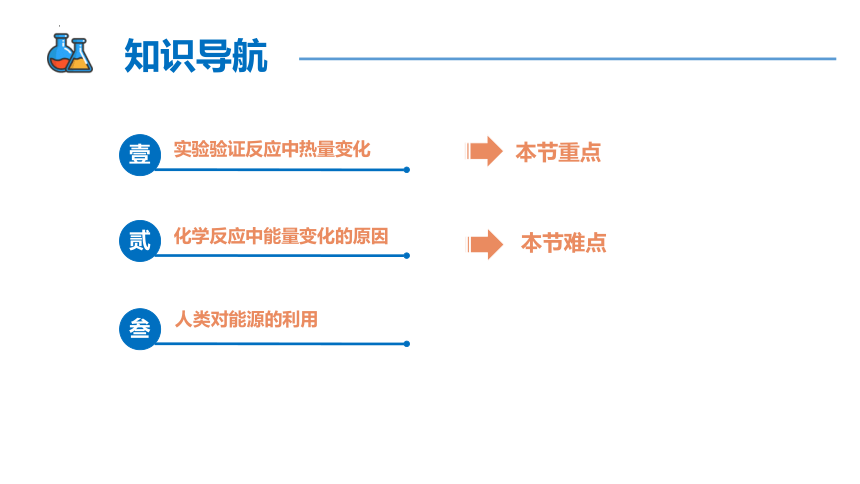
知识导航
本节重点
本节难点
实验验证反应中热量变化
壹
化学反应中能量变化的原因
贰
人类对能源的利用
叁
课堂导入
利用放出的能量升温
以上反应都是化学反应,化学反应中能量怎样变化?
探究课堂
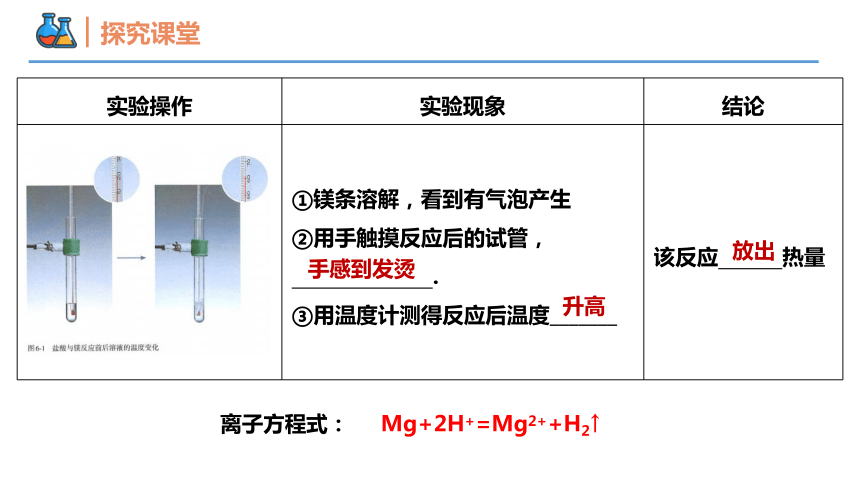
如何通过实验说明反应中有热量变化?
【实验6-1】
在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
探究课堂
探究课堂
实验操作 实验现象 结论
①镁条溶解,看到有气泡产生 ②用手触摸反应后的试管, . ③用温度计测得反应后温度_______ 该反应 热量
手感到发烫
升高
放出
Mg+2H+=Mg2++H2↑
离子方程式:
探究课堂
如何通过实验说明反应中有热量变化?
【实验6-2】
将20gBa(OH)2 8H2O晶体研细后与10gNH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯。观察现象。
探究课堂
探究课堂
实验操作 实验现象 结论
①闻到 气味 ②用手触摸杯壁下部,__________ ③混合物呈 状 该反应 热量。
冰凉
吸收
刺激性
糊
化学方程式:
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
探究课堂
1. 概念
(1) 把 热量的化学反应称为放热反应。
(2) 把 热量的化学反应称为吸热反应。
释放
吸收
特别提醒:
吸热反应和放热反应均是化学反应。
NaOH固体溶于水、浓H2SO4溶于水,属于放热过程,不属于放热反应;
NH4NO3固体溶于水,升华、蒸发属于吸热过程,不属于吸热反应。
探究课堂
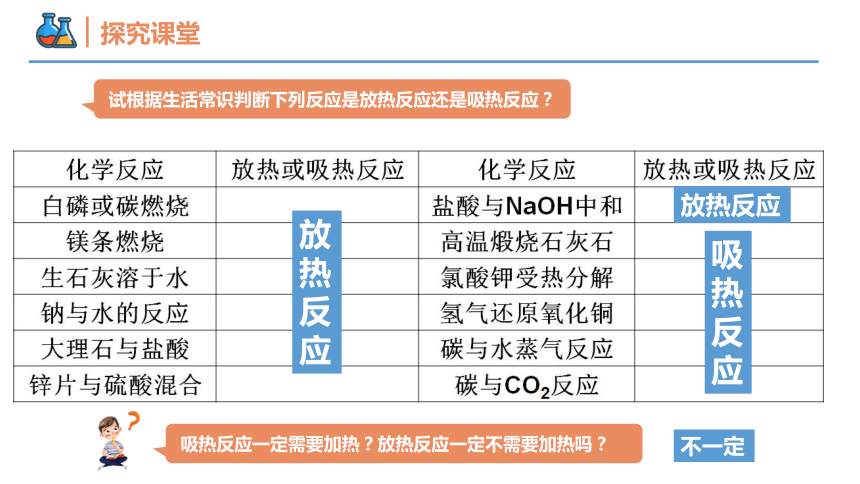
试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
不一定
吸热反应一定需要加热?放热反应一定不需要加热吗?
探究课堂
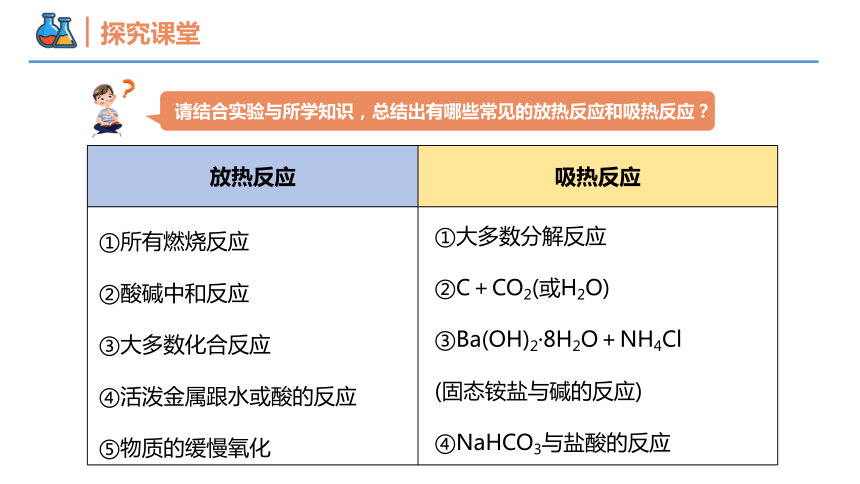
请结合实验与所学知识,总结出有哪些常见的放热反应和吸热反应?
放热反应 吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
①大多数分解反应
②C+CO2(或H2O)
③Ba(OH)2·8H2O+NH4Cl
(固态铵盐与碱的反应)
④NaHCO3与盐酸的反应
探究课堂
【例1】判断下列反应是放热反应还是吸热反应?
1. 镁条的燃烧。
2. 高温下木炭与二氧化碳反应生成一氧化碳。
3. 氧化钙与水的反应。
4. 高温煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)。
5. 炸药爆炸
6. Ba(OH)2·8H2O和NH4Cl的反应
7. 甲烷在氧气中的燃烧
8. 盐酸与氢氧化钠溶液反应
放热反应
放热反应
放热反应
放热反应
放热反应
吸热反应
吸热反应
吸热反应
探究课堂
【例2】
D
下列变化中属于吸热反应的是( )
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
A.①④ B.②③
C.①④⑤ D.②④
探究课堂
化学反应过程中为什么会有能量的变化?
微观角度——分子和原子的角度
2H2 + O2 2H2O
化学变化的实质
在化学变化中,分子破裂成原子,原子又重新组合成新的分子
探究课堂
化学反应过程中为什么会有能量的变化?
微观角度——化学键
H2 + Cl2 2HCl
化学变化的实质
化学反应是一个旧的化学键发生断裂,新的化学键发生形成的过程
探究课堂
反应物
旧化学键断裂
新化学键形成
生成物
吸收能量E1
放出能量E2
若E1>E2,吸热反应
若E1探究课堂
断开 1 mol H—H 键需要吸收 436 kJ 的能量
例如: H2 + Cl2 = 2HCl 该反应是放热反应还是吸热反应?
断开 1 mol Cl—Cl 键需要吸收 243 kJ 的能量
形成 1 mol H—Cl 键需要放出 431 kJ 的能量
E吸收 = 436 + 243 = 679 kJ
E放出 = 431 × 2 = 862 kJ
E吸< E放
放热反应
结论:化学键的断裂和形成是化学反应中能量变化的主要原因。
探究课堂
用图形表征化学反应中能量变化
反应进程
能量
H—H
O—O
H H
O O
H—O—H
放热反应
断键吸收
成键释放
反应进程
能量
吸热反应
断键吸收
成键释放
H—O—H
H H
O O
H—H
O—O
探究课堂
化学反应过程中为什么会有能量的变化?
宏观角度
反应物的总能量高
生成物的总能量高
放热反应
吸热反应
旧物质反应生成新物质
反应物和生成物总能量不同
物质本身是具备能量的
生成物的总能量低
反应物的总能量低
探究课堂
吸热反应:
反应物总能量 < 生成物总能量
放热反应:
反应物总能量 > 生成物总能量
用图形表征化学反应中能量变化
探究课堂
1.稳定物生成不稳定物是 反应。
2.需要持续加热才能进行的一般是 反应。
3.如果某反应为放热,则逆反应为吸热。
吸热
吸热
能量越低越稳定
探究课堂
【例3】已知断裂1 mol共价键所需要吸收的能量分别为:
H—H键:436 kJ;I—I键:153kJ;H—I键:299 kJ。
下列对反应H2(g)+I2(g) 2HI(g)的判断中,错误的是( )
A.该反应是放出能量的反应
B.该反应是吸收能量的反应
C.该反应是氧化还原反应
D.I2与H2具有的总能量大于生成的HI具有的总能量
B
探究课堂
【例4】硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
化学反应与能量变化如图所示,回答下列问题:
(1)①是_____反应,②是_____反应,③是_____反应(填“吸热”或“放热”)。
(2)反应②破坏反应物中的化学键所吸收的能量______(填“大于”或“小于”)形成生成物中化学键所放出的能量。
吸热
放热
吸热
小于
探究课堂
人类对能源的利用
柴火
煤、石油、天然气等化石燃料
新能源
柴草时期
化石能源时期
多能源结构时期
现阶段人类获取热能的主要途径
探究课堂
人类对能源的利用
化石燃料利用过程面临的问题
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
探究课堂
人类对能源的利用
太阳能、风能、地热能、海洋能、氢能等
提高燃料的燃烧效率
提高能源利用率
太阳能 风能 地热能
解决办法
节能
寻找新能源
探究课堂
【例5】下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用将光能转化为生物质能
B.风能、太阳能是清洁能源
C.氢能目前难以被广泛利用的主要原因是其燃烧所放出的能量低于相同质量的化石燃料
D.开发生物质能有利于环境保护和经济可持续发展
C
探究课堂
A
【例6】液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
课堂小结
化学反应与热能
实验验证反应中热量变化
盐酸与镁的反应
氢氧化钡与氯化铵的反应
吸热反应与放热反应
化学反应中能量变化的原因
微观角度——分子和原子的角度
微观角度——化学键
宏观角度——物质的能量
人类对能源的利用
现阶段人类获取热能的主要途径
化石燃料利用过程面临的问题
解决办法
谢谢观看
THANKS
第六章 化学反应与能量
第一节 化学反应与能量变化
课时1 化学反应与热能
贰
叁
知识导航
本节重点
本节难点
实验验证反应中热量变化
壹
化学反应中能量变化的原因
贰
人类对能源的利用
叁
课堂导入
利用放出的能量升温
以上反应都是化学反应,化学反应中能量怎样变化?
探究课堂
如何通过实验说明反应中有热量变化?
【实验6-1】
在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
探究课堂
探究课堂
实验操作 实验现象 结论
①镁条溶解,看到有气泡产生 ②用手触摸反应后的试管, . ③用温度计测得反应后温度_______ 该反应 热量
手感到发烫
升高
放出
Mg+2H+=Mg2++H2↑
离子方程式:
探究课堂
如何通过实验说明反应中有热量变化?
【实验6-2】
将20gBa(OH)2 8H2O晶体研细后与10gNH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯。观察现象。
探究课堂
探究课堂
实验操作 实验现象 结论
①闻到 气味 ②用手触摸杯壁下部,__________ ③混合物呈 状 该反应 热量。
冰凉
吸收
刺激性
糊
化学方程式:
Ba(OH)2.8H2O+2NH4Cl=BaCI2+10H2O+2NH3↑
探究课堂
1. 概念
(1) 把 热量的化学反应称为放热反应。
(2) 把 热量的化学反应称为吸热反应。
释放
吸收
特别提醒:
吸热反应和放热反应均是化学反应。
NaOH固体溶于水、浓H2SO4溶于水,属于放热过程,不属于放热反应;
NH4NO3固体溶于水,升华、蒸发属于吸热过程,不属于吸热反应。
探究课堂
试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
不一定
吸热反应一定需要加热?放热反应一定不需要加热吗?
探究课堂
请结合实验与所学知识,总结出有哪些常见的放热反应和吸热反应?
放热反应 吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
①大多数分解反应
②C+CO2(或H2O)
③Ba(OH)2·8H2O+NH4Cl
(固态铵盐与碱的反应)
④NaHCO3与盐酸的反应
探究课堂
【例1】判断下列反应是放热反应还是吸热反应?
1. 镁条的燃烧。
2. 高温下木炭与二氧化碳反应生成一氧化碳。
3. 氧化钙与水的反应。
4. 高温煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)。
5. 炸药爆炸
6. Ba(OH)2·8H2O和NH4Cl的反应
7. 甲烷在氧气中的燃烧
8. 盐酸与氢氧化钠溶液反应
放热反应
放热反应
放热反应
放热反应
放热反应
吸热反应
吸热反应
吸热反应
探究课堂
【例2】
D
下列变化中属于吸热反应的是( )
①铝片与稀盐酸的反应
②将胆矾加热变为白色粉末
③干冰汽化
④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应
A.①④ B.②③
C.①④⑤ D.②④
探究课堂
化学反应过程中为什么会有能量的变化?
微观角度——分子和原子的角度
2H2 + O2 2H2O
化学变化的实质
在化学变化中,分子破裂成原子,原子又重新组合成新的分子
探究课堂
化学反应过程中为什么会有能量的变化?
微观角度——化学键
H2 + Cl2 2HCl
化学变化的实质
化学反应是一个旧的化学键发生断裂,新的化学键发生形成的过程
探究课堂
反应物
旧化学键断裂
新化学键形成
生成物
吸收能量E1
放出能量E2
若E1>E2,吸热反应
若E1
断开 1 mol H—H 键需要吸收 436 kJ 的能量
例如: H2 + Cl2 = 2HCl 该反应是放热反应还是吸热反应?
断开 1 mol Cl—Cl 键需要吸收 243 kJ 的能量
形成 1 mol H—Cl 键需要放出 431 kJ 的能量
E吸收 = 436 + 243 = 679 kJ
E放出 = 431 × 2 = 862 kJ
E吸< E放
放热反应
结论:化学键的断裂和形成是化学反应中能量变化的主要原因。
探究课堂
用图形表征化学反应中能量变化
反应进程
能量
H—H
O—O
H H
O O
H—O—H
放热反应
断键吸收
成键释放
反应进程
能量
吸热反应
断键吸收
成键释放
H—O—H
H H
O O
H—H
O—O
探究课堂
化学反应过程中为什么会有能量的变化?
宏观角度
反应物的总能量高
生成物的总能量高
放热反应
吸热反应
旧物质反应生成新物质
反应物和生成物总能量不同
物质本身是具备能量的
生成物的总能量低
反应物的总能量低
探究课堂
吸热反应:
反应物总能量 < 生成物总能量
放热反应:
反应物总能量 > 生成物总能量
用图形表征化学反应中能量变化
探究课堂
1.稳定物生成不稳定物是 反应。
2.需要持续加热才能进行的一般是 反应。
3.如果某反应为放热,则逆反应为吸热。
吸热
吸热
能量越低越稳定
探究课堂
【例3】已知断裂1 mol共价键所需要吸收的能量分别为:
H—H键:436 kJ;I—I键:153kJ;H—I键:299 kJ。
下列对反应H2(g)+I2(g) 2HI(g)的判断中,错误的是( )
A.该反应是放出能量的反应
B.该反应是吸收能量的反应
C.该反应是氧化还原反应
D.I2与H2具有的总能量大于生成的HI具有的总能量
B
探究课堂
【例4】硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
化学反应与能量变化如图所示,回答下列问题:
(1)①是_____反应,②是_____反应,③是_____反应(填“吸热”或“放热”)。
(2)反应②破坏反应物中的化学键所吸收的能量______(填“大于”或“小于”)形成生成物中化学键所放出的能量。
吸热
放热
吸热
小于
探究课堂
人类对能源的利用
柴火
煤、石油、天然气等化石燃料
新能源
柴草时期
化石能源时期
多能源结构时期
现阶段人类获取热能的主要途径
探究课堂
人类对能源的利用
化石燃料利用过程面临的问题
储量有限,短期内不可再生
影响环境
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
探究课堂
人类对能源的利用
太阳能、风能、地热能、海洋能、氢能等
提高燃料的燃烧效率
提高能源利用率
太阳能 风能 地热能
解决办法
节能
寻找新能源
探究课堂
【例5】下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用将光能转化为生物质能
B.风能、太阳能是清洁能源
C.氢能目前难以被广泛利用的主要原因是其燃烧所放出的能量低于相同质量的化石燃料
D.开发生物质能有利于环境保护和经济可持续发展
C
探究课堂
A
【例6】液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
课堂小结
化学反应与热能
实验验证反应中热量变化
盐酸与镁的反应
氢氧化钡与氯化铵的反应
吸热反应与放热反应
化学反应中能量变化的原因
微观角度——分子和原子的角度
微观角度——化学键
宏观角度——物质的能量
人类对能源的利用
现阶段人类获取热能的主要途径
化石燃料利用过程面临的问题
解决办法
谢谢观看
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
