5.1.2 硫酸(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共23张PPT)
文档属性
| 名称 | 5.1.2 硫酸(同步课件)-2023-2024学年高一化学同步精品课堂(人教版2019必修第二册)(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 44.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:20:57 | ||
图片预览



文档简介
(共23张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
课时2 硫酸
贰
叁
知识导航
本节重难点
硫酸的工业制备
壹
酸的通性
贰
浓硫酸的特性
叁
课堂导入
实验室里常用Fe、Zn等与稀硫酸、稀盐酸反应制取H2。
而在工业上浓硫酸都是用铁罐或铝罐来储存和运输。
这是为什么?浓硫酸有何特性?
探究课堂
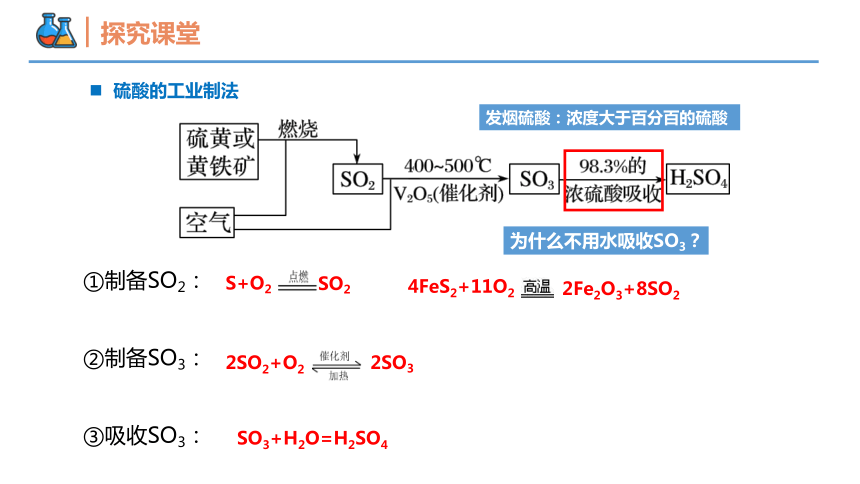
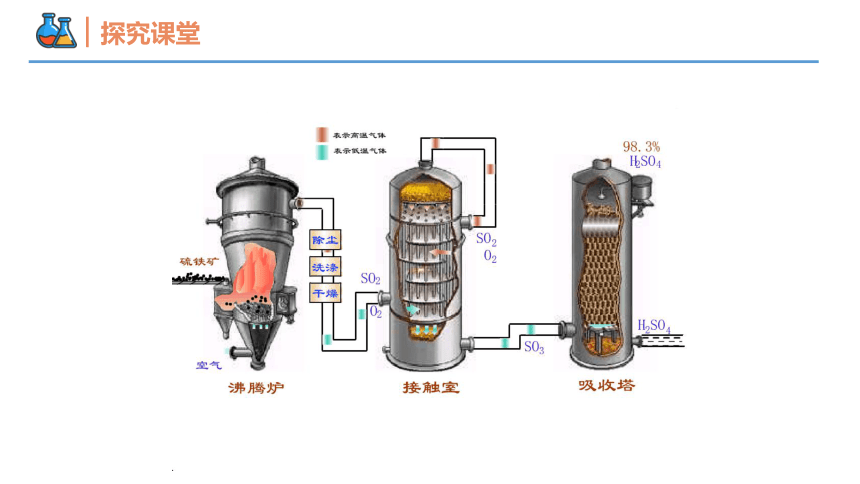
硫酸的工业制法
S+O2
SO2
2SO2+O2
2SO3
4FeS2+11O2
2Fe2O3+8SO2
SO3+H2O=H2SO4
①制备SO2:
②制备SO3:
③吸收SO3:
为什么不用水吸收SO3?
发烟硫酸:浓度大于百分百的硫酸
探究课堂
探究课堂
稀硫酸具有什么性质?
酸的通性
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与某些盐反应
H++OH- = H2O(与强碱)
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
稀硫酸
与指示剂显色
Fe+2H+ = Fe2++H2↑
浓硫酸(98.3%)的性质呢?
探究课堂
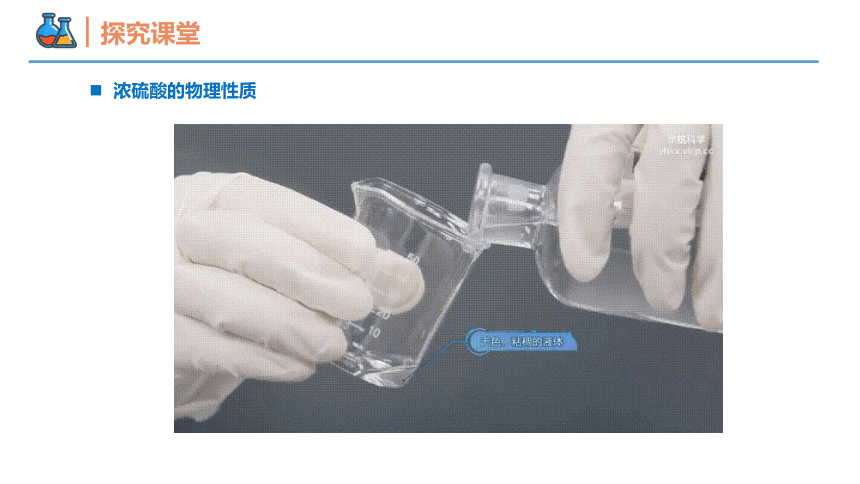
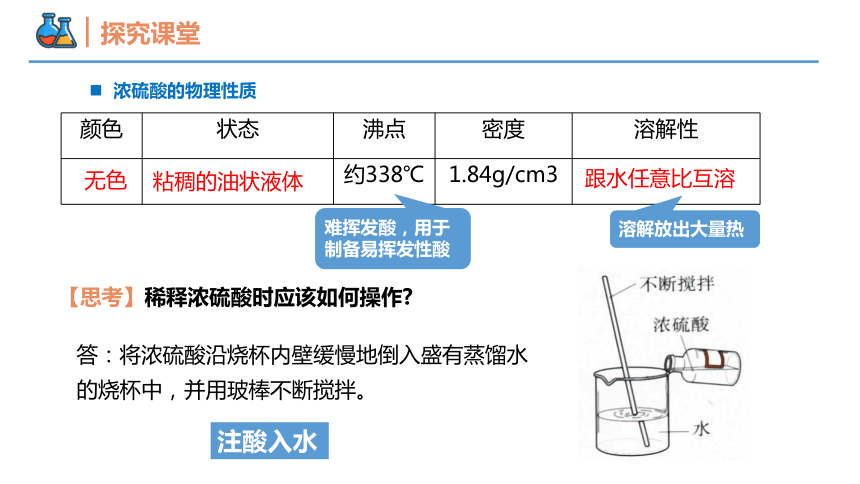
浓硫酸的物理性质
探究课堂
浓硫酸的物理性质
颜色 状态 沸点 密度 溶解性
约338℃ 1.84g/cm3
无色
粘稠的油状液体
跟水任意比互溶
答:将浓硫酸沿烧杯内壁缓慢地倒入盛有蒸馏水的烧杯中,并用玻棒不断搅拌。
难挥发酸,用于制备易挥发性酸
溶解放出大量热
【思考】稀释浓硫酸时应该如何操作
注酸入水
探究课堂
浓硫酸的化学性质
吸水性
浓硫酸能吸收存在于周围环境中的水分
探究课堂
浓硫酸的化学性质
吸水性
浓硫酸能吸收存在于周围环境中的水分
浓硫酸吸水性的有何应用?
可用来干燥:
中性气体:H2、O2、CO、CH4、NO等
酸性气体: HCl、 Cl2、 SO2、 CO2等
不能干燥:
碱性气体:NH3
还原性气体:H2S、HBr、HI
气态SO3
会被浓硫酸吸收
探究课堂
浓硫酸的化学性质
【实验】将适量蔗糖(C12H22O11)放入烧杯中,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。
实验:白糖变成“黑面包”
脱水性
浓硫酸能将有机物中的氧、氢元素按水的组成比(2:1)脱去
探究课堂
浓硫酸的化学性质
脱水性
浓硫酸能将有机物中的氧、氢元素按水的组成比(2:1)脱去
【实验】将适量蔗糖(C12H22O11)放入烧杯中,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。
【现象】 蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
【结论】 浓硫酸具有脱水性、强氧化性。
探究课堂
浓硫酸的化学性质
强氧化性
探究课堂
浓硫酸的化学性质
强氧化性
【实验装置】
【现象】
【结论】
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面_________________________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
红色
蓝色
b试管中的品红溶液逐渐变为________
无色
探究课堂
在浓硫酸与铜反应中,思考回答以下问题
① 可抽动的铜丝有什么作用?
答:吸收多余的SO2,以防污染环境,SO2+2NaOH=Na2SO3+H2O。
答:控制反应的发生或停止
③ 在浓硫酸与铜(加热)的反应中,浓H2SO4表现了哪些性质?
答:浓硫酸既表现了强氧化性,又表现了酸性。
浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸可使铁或铝的表面生成一层致密的氧化膜,阻止了内部金属与浓硫酸进一步反应,这种现象叫做——钝化。
② 试管c中“浸NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。
探究课堂
浓硫酸的化学性质
强氧化性的归纳总结
浓硫酸具有强氧化性,能氧化金属、非金属、还原性化合物等,其还原产物一般是___________
金属 反应通式 金属+H2SO4(浓) 高价金属硫酸盐 + SO2↑+ H2O
实例 与Cu反应:___________________________________
非金属 反应通式 非金属+H2SO4(浓) 高价氧化物或含氧酸 + SO2↑+ H2O
实例 与C反应:_____________________________________
还原性化合物 与H2S反应:___________________________________
SO2
常温钝化
探究课堂
硫酸的用途
化肥
农药
干燥剂
铅酸蓄电池
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
硫酸的消费量被视为一个国家无机工业发展水平的标志。
探究课堂
【例1】下列实验中硫酸的作用与其他三项不同的是
A.蔗糖中加入浓硫酸产生黑“面包”
B.亚硫酸钠与硫酸制取SO2C.配制高锰酸钾溶液时加入稀硫酸
D.氧化铜与硫酸制硫酸铜
A
探究课堂
【例2】下列对浓硫酸的叙述中,正确的是A.常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属B.浓硫酸具有吸水性,可以使蔗糖脱水炭化C.滴加浓硫酸使胆矾由蓝色晶体变为白色粉末,属于物理变化D.浓硫酸和碳单质加热反应,表现出强氧化性
D
探究课堂
【例3】在如图所示的实验装置中,从实验开始到过一段时间后,对现象叙述不正确的是
A.①中苹果块会干瘪B.②中胆矾晶体表面有“白斑”C.③中小试管内有晶体析出D.④中pH试纸变红
D
探究课堂
【例4】在硫酸的工业生产过程中,SO3的吸收过程是在吸收塔中进行的,吸收塔里还装入了大量瓷环。下列有关说法错误的是
A.从①处通入SO3整个吸收操作采取逆流的形式B.从②处喷下98.3%的浓硫酸,瓷环的作用是增大接触面积C.从③处导出的气体只含有少量的SO2,可直接排入空气中D.从④处流出的是可用水或稀硫酸稀释的浓硫酸
C
课堂小结
(可和C、Cu、H2S反应)
谢谢观看
THANKS
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
课时2 硫酸
贰
叁
知识导航
本节重难点
硫酸的工业制备
壹
酸的通性
贰
浓硫酸的特性
叁
课堂导入
实验室里常用Fe、Zn等与稀硫酸、稀盐酸反应制取H2。
而在工业上浓硫酸都是用铁罐或铝罐来储存和运输。
这是为什么?浓硫酸有何特性?
探究课堂
硫酸的工业制法
S+O2
SO2
2SO2+O2
2SO3
4FeS2+11O2
2Fe2O3+8SO2
SO3+H2O=H2SO4
①制备SO2:
②制备SO3:
③吸收SO3:
为什么不用水吸收SO3?
发烟硫酸:浓度大于百分百的硫酸
探究课堂
探究课堂
稀硫酸具有什么性质?
酸的通性
紫色石蕊变红
与活泼金属反应
与碱反应
与碱性氧化物反应
与某些盐反应
H++OH- = H2O(与强碱)
Fe2O3+6H+ = 2Fe3++3H2O
2H++CO32- =H2O+CO2↑
稀硫酸
与指示剂显色
Fe+2H+ = Fe2++H2↑
浓硫酸(98.3%)的性质呢?
探究课堂
浓硫酸的物理性质
探究课堂
浓硫酸的物理性质
颜色 状态 沸点 密度 溶解性
约338℃ 1.84g/cm3
无色
粘稠的油状液体
跟水任意比互溶
答:将浓硫酸沿烧杯内壁缓慢地倒入盛有蒸馏水的烧杯中,并用玻棒不断搅拌。
难挥发酸,用于制备易挥发性酸
溶解放出大量热
【思考】稀释浓硫酸时应该如何操作
注酸入水
探究课堂
浓硫酸的化学性质
吸水性
浓硫酸能吸收存在于周围环境中的水分
探究课堂
浓硫酸的化学性质
吸水性
浓硫酸能吸收存在于周围环境中的水分
浓硫酸吸水性的有何应用?
可用来干燥:
中性气体:H2、O2、CO、CH4、NO等
酸性气体: HCl、 Cl2、 SO2、 CO2等
不能干燥:
碱性气体:NH3
还原性气体:H2S、HBr、HI
气态SO3
会被浓硫酸吸收
探究课堂
浓硫酸的化学性质
【实验】将适量蔗糖(C12H22O11)放入烧杯中,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。
实验:白糖变成“黑面包”
脱水性
浓硫酸能将有机物中的氧、氢元素按水的组成比(2:1)脱去
探究课堂
浓硫酸的化学性质
脱水性
浓硫酸能将有机物中的氧、氢元素按水的组成比(2:1)脱去
【实验】将适量蔗糖(C12H22O11)放入烧杯中,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。
【现象】 蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
【结论】 浓硫酸具有脱水性、强氧化性。
探究课堂
浓硫酸的化学性质
强氧化性
探究课堂
浓硫酸的化学性质
强氧化性
【实验装置】
【现象】
【结论】
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面_________________________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
红色
蓝色
b试管中的品红溶液逐渐变为________
无色
探究课堂
在浓硫酸与铜反应中,思考回答以下问题
① 可抽动的铜丝有什么作用?
答:吸收多余的SO2,以防污染环境,SO2+2NaOH=Na2SO3+H2O。
答:控制反应的发生或停止
③ 在浓硫酸与铜(加热)的反应中,浓H2SO4表现了哪些性质?
答:浓硫酸既表现了强氧化性,又表现了酸性。
浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸可使铁或铝的表面生成一层致密的氧化膜,阻止了内部金属与浓硫酸进一步反应,这种现象叫做——钝化。
② 试管c中“浸NaOH溶液的棉团”的作用是什么?写出反应的化学方程式。
探究课堂
浓硫酸的化学性质
强氧化性的归纳总结
浓硫酸具有强氧化性,能氧化金属、非金属、还原性化合物等,其还原产物一般是___________
金属 反应通式 金属+H2SO4(浓) 高价金属硫酸盐 + SO2↑+ H2O
实例 与Cu反应:___________________________________
非金属 反应通式 非金属+H2SO4(浓) 高价氧化物或含氧酸 + SO2↑+ H2O
实例 与C反应:_____________________________________
还原性化合物 与H2S反应:___________________________________
SO2
常温钝化
探究课堂
硫酸的用途
化肥
农药
干燥剂
铅酸蓄电池
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
硫酸的消费量被视为一个国家无机工业发展水平的标志。
探究课堂
【例1】下列实验中硫酸的作用与其他三项不同的是
A.蔗糖中加入浓硫酸产生黑“面包”
B.亚硫酸钠与硫酸制取SO2C.配制高锰酸钾溶液时加入稀硫酸
D.氧化铜与硫酸制硫酸铜
A
探究课堂
【例2】下列对浓硫酸的叙述中,正确的是A.常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属B.浓硫酸具有吸水性,可以使蔗糖脱水炭化C.滴加浓硫酸使胆矾由蓝色晶体变为白色粉末,属于物理变化D.浓硫酸和碳单质加热反应,表现出强氧化性
D
探究课堂
【例3】在如图所示的实验装置中,从实验开始到过一段时间后,对现象叙述不正确的是
A.①中苹果块会干瘪B.②中胆矾晶体表面有“白斑”C.③中小试管内有晶体析出D.④中pH试纸变红
D
探究课堂
【例4】在硫酸的工业生产过程中,SO3的吸收过程是在吸收塔中进行的,吸收塔里还装入了大量瓷环。下列有关说法错误的是
A.从①处通入SO3整个吸收操作采取逆流的形式B.从②处喷下98.3%的浓硫酸,瓷环的作用是增大接触面积C.从③处导出的气体只含有少量的SO2,可直接排入空气中D.从④处流出的是可用水或稀硫酸稀释的浓硫酸
C
课堂小结
(可和C、Cu、H2S反应)
谢谢观看
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
