3.2.3金属钠及钠的化合物(离子反应)(同步课件)(共37张PPT)--2023-2024学年高一化学同步精品课堂(苏教版2019必修第一册)
文档属性
| 名称 | 3.2.3金属钠及钠的化合物(离子反应)(同步课件)(共37张PPT)--2023-2024学年高一化学同步精品课堂(苏教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:43:20 | ||
图片预览






文档简介
(共37张PPT)
第二节 金属钠及钠的化合物
课时3 离子反应
第三章 从海水中获得的化学物质
授课人:
学习目标
1.理解强电解质和弱电解质的概念,能用电离方程式表示电解质的电离。
2.了解离子反应和离子方程式的含义,掌握离子方程式的书写步骤和方法,能判断离子方程式的正误。
导入
为什么电解水要加少量稀硫酸?
思考1
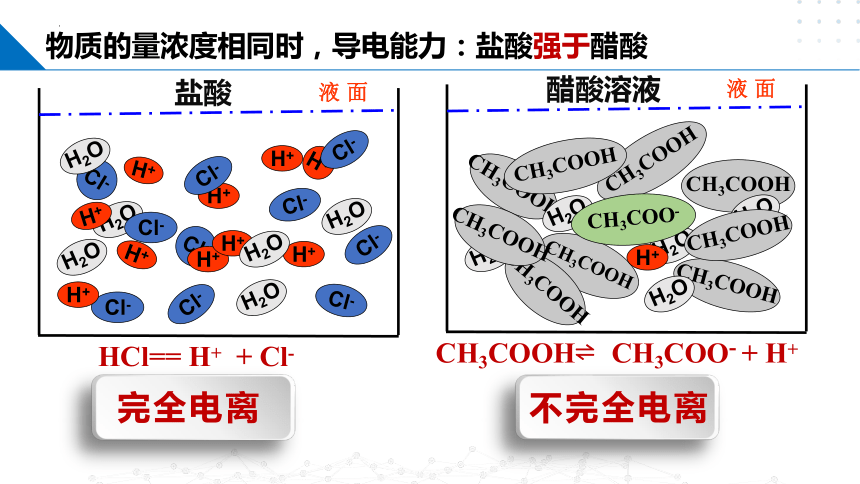
物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
思考2
H+
液 面
Cl-
H+
Cl-
H+
Cl-
Cl-
H2O
H+
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
盐酸
H2O
H2O
H2O
H2O
H2O
液 面
CH3COOH
CH3COOH
CH3COOH
H2O
CH3COOH
CH3COOH
CH3COOH
醋酸溶液
H2O
H2O
H2O
H2O
H2O
CH3COO-
CH3COOH
CH3COOH
CH3COOH
H+
物质的量浓度相同时,导电能力:盐酸强于醋酸
HCl== H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
不完全电离
Na+
液 面
OH-
Na+
OH-
Na+
OH-
OH-
H2O
Na+
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
OH-
Na+
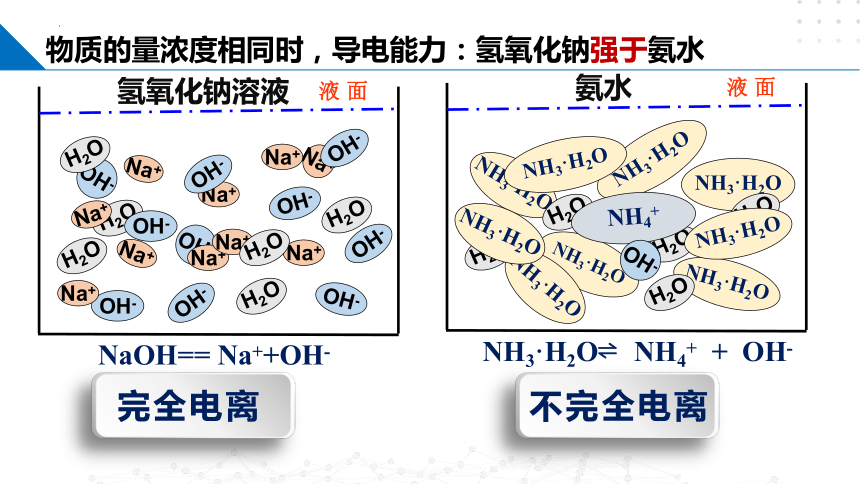
氢氧化钠溶液
H2O
H2O
H2O
H2O
H2O
液 面
NH3·H2O
NH3·H2O
NH3·H2O
H2O
NH3·H2O
NH3·H2O
NH3·H2O
氨水
H2O
H2O
H2O
H2O
H2O
NH4+
NH3·H2O
NH3·H2O
NH3·H2O
物质的量浓度相同时,导电能力:氢氧化钠强于氨水
NaOH== Na++OH-
NH3·H2O NH4+ + OH-
完全电离
不完全电离
OH-
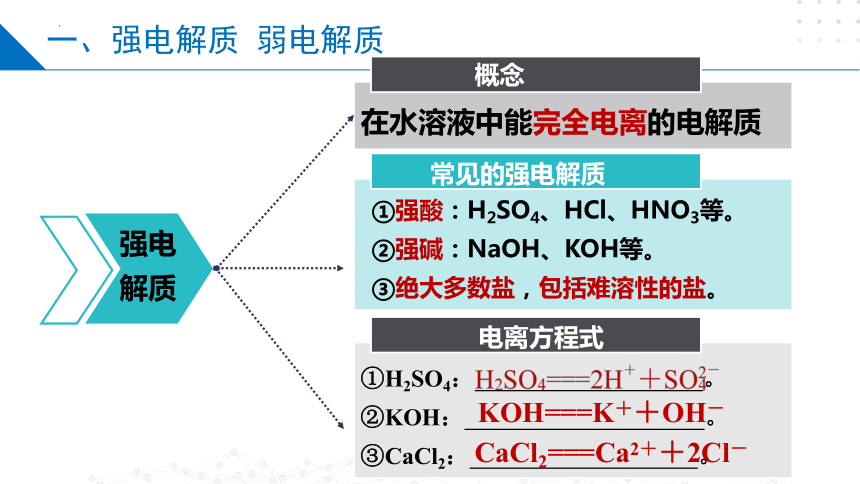
在水溶液中能完全电离的电解质
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐,包括难溶性的盐。
①H2SO4: 。
②KOH: 。
③CaCl2: 。
电离方程式
常见的强电解质
概念
强电解质
KOH===K++OH-
CaCl2===Ca2++2Cl-
一、强电解质 弱电解质
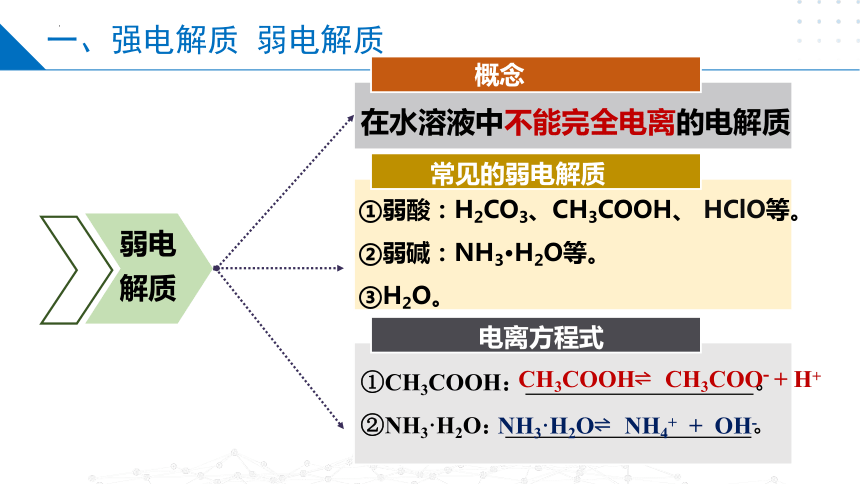
在水溶液中不能完全电离的电解质
①弱酸:H2CO3、CH3COOH、 HClO等。
②弱碱:NH3·H2O等。
③H2O。
①CH3COOH: 。
②NH3·H2O: 。
电离方程式
常见的弱电解质
概念
弱电解质
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
一、强电解质 弱电解质
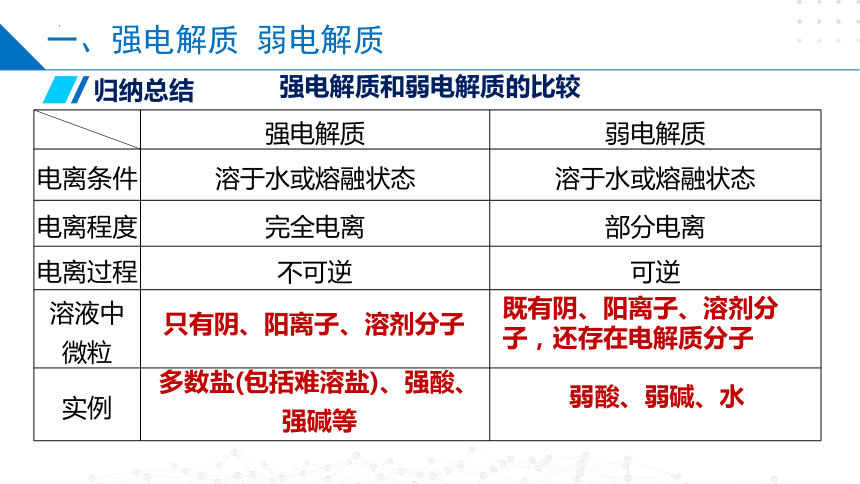
强电解质 弱电解质
电离条件 溶于水或熔融状态 溶于水或熔融状态
电离程度 完全电离 部分电离
电离过程 不可逆 可逆
溶液中 微粒
实例
强电解质和弱电解质的比较
归纳总结
多数盐(包括难溶盐)、强酸、强碱等
弱酸、弱碱、水
只有阴、阳离子、溶剂分子
既有阴、阳离子、溶剂分子,还存在电解质分子
一、强电解质 弱电解质
判断正误
一、强电解质 弱电解质
1、BaSO4溶液的导电性很弱,是因为BaSO4为弱电解质。
2、强电解质在液态时,有的导电,有的可能不导电。
3、强电解质溶液一定比弱电解质溶液导电性强。
错。BaSO4溶于水的部分完全电离,在熔融状态也是完全电离的。
对。如BaSO4在液态(熔融状态)时能导电,但硫酸在液态时不导电。
错。导电能力强弱与溶质离子浓度及多带电荷有关。
典例解析
例1.现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰;⑦铜;⑧醋酸;⑨HCl气体;⑩氨气。
请回答下列问题(用序号填写):
(1)能导电的是 。 (2)属于电解质的是 。
(3)属于非电解质的是 。 (4)属于强电解质的是 。
(5)属于弱电解质的是 。
①④⑦
④⑤⑧⑨
②③⑥⑩
④⑤⑨
⑧
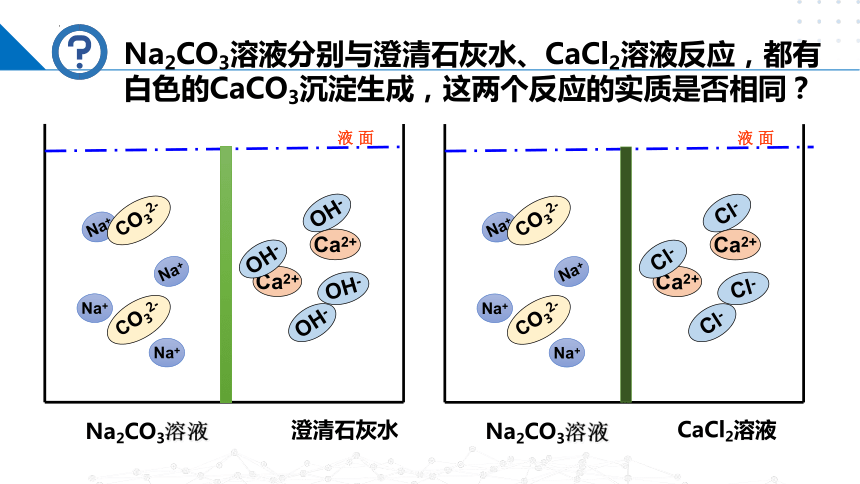
Na2CO3溶液分别与澄清石灰水、CaCl2溶液反应,都有白色的CaCO3沉淀生成,这两个反应的实质是否相同?
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
CO32-
CO32-
Ca2+
Cl-
Cl-
Ca2+
Cl-
Cl-
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
Cl-
Cl-
Cl-
Cl-
CaCO3
CaCO3
CO32-
CO32-
Ca2+
Ca2+
CaCO3
CaCO3
混合后数目减少的离子
混合后数目不变的离子
反应实质
Na+、OH-
Ca2+、CO32-
Ca2+、CO32-结合成CaCO3沉淀
Na+、Cl-
Ca2+、CO32-
本质
有离子参加的化学反应称为离子反应
从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是电解质在溶液中相互交换离子的反应。
离子反应使溶液中某些离子的浓度减小。
二、离子反应
离子反应发生的条件
生成难溶物质(如:沉淀)
生成挥发性物质(如:气体)
生成难电离物质(如:弱电解质)
二、离子反应
Na2CO3溶液与澄清石灰水
Na2CO3溶液与CaCl2溶液
Na2CO3 + CaCl2 =2 NaCl + CaCO3↓
Na2CO3+Ca(OH)2=2NaOH +CaCO3↓
CO3 2- + Ca2+ =CaCO3↓
CO3 2- + Ca2+=CaCO3↓
离子方程式
二、离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
1. 写:写出反应的化学方程式。
Na2CO3 + 2HCl ═2 NaCl + CO2↑+H2O
2.拆: 把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
2Na++CO32- + 2H++2Cl- ═2 Na+ +2Cl- + CO2↑+H2O
二、离子反应
二、离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
3.删: 删去化学方程式两边不参加反应的离子。
4. 查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
CO32- + 2H+ ═ CO2↑+ H2O
二、离子反应
离子反应中“拆”的标准:
溶于水且完全电离的物质
需要用化学式表示的物质
难溶物质:
BaSO4 、 BaCO3、CaCO3、AgCl等
Al(OH)3 、Mg(OH)2 、 Fe(OH)3等
气体:
O2、CO2、H2等
单质:
Fe、Cu等
难电离物质:
弱酸(CH3COOH 、 HClO 、 HF等)
弱碱(NH3.H2O)、 水
氧化物:
MgO、CuO等
二、离子反应
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 _________________________ __________________
盐酸与氢氧化钾 _______________________ __________________
硫酸与氢氧化钠 ___________________________________ __________________
总结 离子方程式不仅可以表示 ,还可以表示_______________
HCl+NaOH===NaCl+H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4
+2H2O
某一个特定的化学反应
同一类化学反应
典例解析
例2、书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
典例解析
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
二、离子反应
1.看是否符合客观事实
书写离子方程式时,离子反应必须符合客观事实,不可主观臆造离子反应或产物。例如,铁与稀硫酸的反应:2Fe+6H+===2Fe3++3H2↑(×),因为Fe与稀硫酸反应生成Fe2+,不会生成Fe3+。
“六看法”巧解离子方程式的正误判断题
二、离子反应
2.看化学式拆分是否合理
易溶于水且完全电离的电解质用离子符号表示,如强酸(HCl、H2SO4、HNO3等)、强碱[NaOH、KOH、Ba(OH)2等]及可溶性盐。弱酸、弱碱、难溶性物质、单质、氧化物、气体等用化学式表示。例如,碳酸钙与醋酸的反应:CaCO3+2H+===Ca2++CO2↑+H2O(×),因为醋酸是弱酸,要用化学式CH3COOH表示。
3.看是否遵循原子守恒和电荷守恒
离子方程式要符合原子守恒和电荷守恒规律。例如,Al和稀盐酸的反应:Al+2H+===Al3++H2↑(×),因为不符合电荷守恒规律。
二、离子反应
4.看是否符合离子配比关系
书写离子方程式时,要注意反应物电离产生阴、阳离子的配比关系,不可随意更改比例关系。例如,稀硫酸和Ba(OH)2溶液的反应:H+++Ba2++OH-===BaSO4↓+H2O(×),因为H2SO4电离产生的H+和及Ba(OH)2电离产生的OH-和Ba2+的个数之比均为2∶1。
5.看是否漏写部分离子反应
书写离子方程式时,两种电解质若发生复分解反应,要考虑两组互换的阴、阳离子是否均发生反应。例如,MgSO4和Ba(OH)2溶液的反应:
Ba2++===BaSO4↓(×),因为漏写Mg2+和OH-生成Mg(OH)2沉淀的反应。
二、离子反应
6.看是否忽视“量变”对反应及产物的影响
书写离子方程式时,“少量”“过量”“适量”等不同情况,产物可能不同。例如,澄清石灰水中通入过量CO2的反应:Ca2++2OH-+CO2=== CaCO3↓+H2O(×),因为澄清石灰水与过量的CO2反应生成Ca(HCO3)2。
典例解析
例3、下表中对离子方程式的评价不合理的是( )
C
三、离子反应的应用
1.常见离子的检验
运用离子反应可以对常见离子进行检验,
例如Cl-检验利用的就是Cl-+Ag+===AgCl↓,生成的AgCl是不溶于稀硝酸的白色沉淀,以此来检验氯离子,类似的还有Br-、I-、的检验等。
2、物质的提纯
如对于含有硫酸钠的粗盐,加水溶解后先加入氯化钡溶液,再加入稍过量的碳酸钠溶液,过滤;向滤液中加入稍过量的盐酸,蒸发结晶获得精盐。
......
1
2
三、离子反应的应用
3.离子推断
一般是依据题目表述的实验试剂、实验现象,再结合离子的性质,初步推出可能的离子,然后根据离子反应条件、离子是否共存等理论进行分析,从而得出正确结论。
4、物质鉴别
利用物质间发生不同的离子反应,由加入相关试剂时反应产生的不同现象予以鉴别。
3
4
三、离子反应的应用
5.离子共存判断
5
在溶液中,若离子之间不发生反应,则离子可以大量共存;若离子之间能发生反应,则不能大量共存。
(1).看题目的具体要求
看题目中要求选择“能大量共存”“不能大量共存”“一定大量共存”还是“可能大量共存”的离子组。
三、离子反应的应用
5.离子共存判断
5
(2).看溶液的颜色
若要求是“无色透明溶液”,则不可能存在(紫红色)、Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)等有色离子。
(3).看溶液的酸碱性
a、若“在强酸性溶液中”,则每组离子中再增加H+,与H+反应的离子不能大量共存。
b、若“在强碱性溶液中”,则每组离子中再增加OH-,与OH-反应的离子不能大量共存。
三、离子反应的应用
5.离子共存判断
5
典例解析
A
课堂小结
强电解质 弱电解质
离子反应的应用
不良反应
概念
常见物质
电离方程式
离子共存判断
离子反应
发生条件
离子方程式书写
离子方程式正误判断
随堂练习
D
随堂练习
BD
谢谢观看
THANKS
第二节 金属钠及钠的化合物
课时3 离子反应
第三章 从海水中获得的化学物质
授课人:
学习目标
1.理解强电解质和弱电解质的概念,能用电离方程式表示电解质的电离。
2.了解离子反应和离子方程式的含义,掌握离子方程式的书写步骤和方法,能判断离子方程式的正误。
导入
为什么电解水要加少量稀硫酸?
思考1
物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
思考2
H+
液 面
Cl-
H+
Cl-
H+
Cl-
Cl-
H2O
H+
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
盐酸
H2O
H2O
H2O
H2O
H2O
液 面
CH3COOH
CH3COOH
CH3COOH
H2O
CH3COOH
CH3COOH
CH3COOH
醋酸溶液
H2O
H2O
H2O
H2O
H2O
CH3COO-
CH3COOH
CH3COOH
CH3COOH
H+
物质的量浓度相同时,导电能力:盐酸强于醋酸
HCl== H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
不完全电离
Na+
液 面
OH-
Na+
OH-
Na+
OH-
OH-
H2O
Na+
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
OH-
Na+
氢氧化钠溶液
H2O
H2O
H2O
H2O
H2O
液 面
NH3·H2O
NH3·H2O
NH3·H2O
H2O
NH3·H2O
NH3·H2O
NH3·H2O
氨水
H2O
H2O
H2O
H2O
H2O
NH4+
NH3·H2O
NH3·H2O
NH3·H2O
物质的量浓度相同时,导电能力:氢氧化钠强于氨水
NaOH== Na++OH-
NH3·H2O NH4+ + OH-
完全电离
不完全电离
OH-
在水溶液中能完全电离的电解质
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐,包括难溶性的盐。
①H2SO4: 。
②KOH: 。
③CaCl2: 。
电离方程式
常见的强电解质
概念
强电解质
KOH===K++OH-
CaCl2===Ca2++2Cl-
一、强电解质 弱电解质
在水溶液中不能完全电离的电解质
①弱酸:H2CO3、CH3COOH、 HClO等。
②弱碱:NH3·H2O等。
③H2O。
①CH3COOH: 。
②NH3·H2O: 。
电离方程式
常见的弱电解质
概念
弱电解质
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
一、强电解质 弱电解质
强电解质 弱电解质
电离条件 溶于水或熔融状态 溶于水或熔融状态
电离程度 完全电离 部分电离
电离过程 不可逆 可逆
溶液中 微粒
实例
强电解质和弱电解质的比较
归纳总结
多数盐(包括难溶盐)、强酸、强碱等
弱酸、弱碱、水
只有阴、阳离子、溶剂分子
既有阴、阳离子、溶剂分子,还存在电解质分子
一、强电解质 弱电解质
判断正误
一、强电解质 弱电解质
1、BaSO4溶液的导电性很弱,是因为BaSO4为弱电解质。
2、强电解质在液态时,有的导电,有的可能不导电。
3、强电解质溶液一定比弱电解质溶液导电性强。
错。BaSO4溶于水的部分完全电离,在熔融状态也是完全电离的。
对。如BaSO4在液态(熔融状态)时能导电,但硫酸在液态时不导电。
错。导电能力强弱与溶质离子浓度及多带电荷有关。
典例解析
例1.现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰;⑦铜;⑧醋酸;⑨HCl气体;⑩氨气。
请回答下列问题(用序号填写):
(1)能导电的是 。 (2)属于电解质的是 。
(3)属于非电解质的是 。 (4)属于强电解质的是 。
(5)属于弱电解质的是 。
①④⑦
④⑤⑧⑨
②③⑥⑩
④⑤⑨
⑧
Na2CO3溶液分别与澄清石灰水、CaCl2溶液反应,都有白色的CaCO3沉淀生成,这两个反应的实质是否相同?
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
CO32-
CO32-
Ca2+
Cl-
Cl-
Ca2+
Cl-
Cl-
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
Cl-
Cl-
Cl-
Cl-
CaCO3
CaCO3
CO32-
CO32-
Ca2+
Ca2+
CaCO3
CaCO3
混合后数目减少的离子
混合后数目不变的离子
反应实质
Na+、OH-
Ca2+、CO32-
Ca2+、CO32-结合成CaCO3沉淀
Na+、Cl-
Ca2+、CO32-
本质
有离子参加的化学反应称为离子反应
从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是电解质在溶液中相互交换离子的反应。
离子反应使溶液中某些离子的浓度减小。
二、离子反应
离子反应发生的条件
生成难溶物质(如:沉淀)
生成挥发性物质(如:气体)
生成难电离物质(如:弱电解质)
二、离子反应
Na2CO3溶液与澄清石灰水
Na2CO3溶液与CaCl2溶液
Na2CO3 + CaCl2 =2 NaCl + CaCO3↓
Na2CO3+Ca(OH)2=2NaOH +CaCO3↓
CO3 2- + Ca2+ =CaCO3↓
CO3 2- + Ca2+=CaCO3↓
离子方程式
二、离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
1. 写:写出反应的化学方程式。
Na2CO3 + 2HCl ═2 NaCl + CO2↑+H2O
2.拆: 把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
2Na++CO32- + 2H++2Cl- ═2 Na+ +2Cl- + CO2↑+H2O
二、离子反应
二、离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
3.删: 删去化学方程式两边不参加反应的离子。
4. 查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
CO32- + 2H+ ═ CO2↑+ H2O
二、离子反应
离子反应中“拆”的标准:
溶于水且完全电离的物质
需要用化学式表示的物质
难溶物质:
BaSO4 、 BaCO3、CaCO3、AgCl等
Al(OH)3 、Mg(OH)2 、 Fe(OH)3等
气体:
O2、CO2、H2等
单质:
Fe、Cu等
难电离物质:
弱酸(CH3COOH 、 HClO 、 HF等)
弱碱(NH3.H2O)、 水
氧化物:
MgO、CuO等
二、离子反应
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 _________________________ __________________
盐酸与氢氧化钾 _______________________ __________________
硫酸与氢氧化钠 ___________________________________ __________________
总结 离子方程式不仅可以表示 ,还可以表示_______________
HCl+NaOH===NaCl+H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4
+2H2O
某一个特定的化学反应
同一类化学反应
典例解析
例2、书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
典例解析
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
二、离子反应
1.看是否符合客观事实
书写离子方程式时,离子反应必须符合客观事实,不可主观臆造离子反应或产物。例如,铁与稀硫酸的反应:2Fe+6H+===2Fe3++3H2↑(×),因为Fe与稀硫酸反应生成Fe2+,不会生成Fe3+。
“六看法”巧解离子方程式的正误判断题
二、离子反应
2.看化学式拆分是否合理
易溶于水且完全电离的电解质用离子符号表示,如强酸(HCl、H2SO4、HNO3等)、强碱[NaOH、KOH、Ba(OH)2等]及可溶性盐。弱酸、弱碱、难溶性物质、单质、氧化物、气体等用化学式表示。例如,碳酸钙与醋酸的反应:CaCO3+2H+===Ca2++CO2↑+H2O(×),因为醋酸是弱酸,要用化学式CH3COOH表示。
3.看是否遵循原子守恒和电荷守恒
离子方程式要符合原子守恒和电荷守恒规律。例如,Al和稀盐酸的反应:Al+2H+===Al3++H2↑(×),因为不符合电荷守恒规律。
二、离子反应
4.看是否符合离子配比关系
书写离子方程式时,要注意反应物电离产生阴、阳离子的配比关系,不可随意更改比例关系。例如,稀硫酸和Ba(OH)2溶液的反应:H+++Ba2++OH-===BaSO4↓+H2O(×),因为H2SO4电离产生的H+和及Ba(OH)2电离产生的OH-和Ba2+的个数之比均为2∶1。
5.看是否漏写部分离子反应
书写离子方程式时,两种电解质若发生复分解反应,要考虑两组互换的阴、阳离子是否均发生反应。例如,MgSO4和Ba(OH)2溶液的反应:
Ba2++===BaSO4↓(×),因为漏写Mg2+和OH-生成Mg(OH)2沉淀的反应。
二、离子反应
6.看是否忽视“量变”对反应及产物的影响
书写离子方程式时,“少量”“过量”“适量”等不同情况,产物可能不同。例如,澄清石灰水中通入过量CO2的反应:Ca2++2OH-+CO2=== CaCO3↓+H2O(×),因为澄清石灰水与过量的CO2反应生成Ca(HCO3)2。
典例解析
例3、下表中对离子方程式的评价不合理的是( )
C
三、离子反应的应用
1.常见离子的检验
运用离子反应可以对常见离子进行检验,
例如Cl-检验利用的就是Cl-+Ag+===AgCl↓,生成的AgCl是不溶于稀硝酸的白色沉淀,以此来检验氯离子,类似的还有Br-、I-、的检验等。
2、物质的提纯
如对于含有硫酸钠的粗盐,加水溶解后先加入氯化钡溶液,再加入稍过量的碳酸钠溶液,过滤;向滤液中加入稍过量的盐酸,蒸发结晶获得精盐。
......
1
2
三、离子反应的应用
3.离子推断
一般是依据题目表述的实验试剂、实验现象,再结合离子的性质,初步推出可能的离子,然后根据离子反应条件、离子是否共存等理论进行分析,从而得出正确结论。
4、物质鉴别
利用物质间发生不同的离子反应,由加入相关试剂时反应产生的不同现象予以鉴别。
3
4
三、离子反应的应用
5.离子共存判断
5
在溶液中,若离子之间不发生反应,则离子可以大量共存;若离子之间能发生反应,则不能大量共存。
(1).看题目的具体要求
看题目中要求选择“能大量共存”“不能大量共存”“一定大量共存”还是“可能大量共存”的离子组。
三、离子反应的应用
5.离子共存判断
5
(2).看溶液的颜色
若要求是“无色透明溶液”,则不可能存在(紫红色)、Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)等有色离子。
(3).看溶液的酸碱性
a、若“在强酸性溶液中”,则每组离子中再增加H+,与H+反应的离子不能大量共存。
b、若“在强碱性溶液中”,则每组离子中再增加OH-,与OH-反应的离子不能大量共存。
三、离子反应的应用
5.离子共存判断
5
典例解析
A
课堂小结
强电解质 弱电解质
离子反应的应用
不良反应
概念
常见物质
电离方程式
离子共存判断
离子反应
发生条件
离子方程式书写
离子方程式正误判断
随堂练习
D
随堂练习
BD
谢谢观看
THANKS
