3.1.2氯气的性质及应用(同步课件)-2023-2024学年高一化学同步精品课堂(苏教版2019必修第一册)(共31张PPT)
文档属性
| 名称 | 3.1.2氯气的性质及应用(同步课件)-2023-2024学年高一化学同步精品课堂(苏教版2019必修第一册)(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 55.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 12:46:35 | ||
图片预览










文档简介
(共31张PPT)
第一节 氯气及氯的化合物 课时2 氯气的性质及应用
第三章 从海水中获得的化学物质
授课人:
学习目标
1.从氯的原子结构特点和氯气跟金属、非金属的反应认识氯气是一种化学性质非常活泼的非金属。
2.知道氯气与水反应的产物,熟知氯水的成分和性质。
3.掌握氯气与碱的反应,认识含氯化合物在生产中的应用和对生态环境的影响,促进“社会责任”核心素养的发展。
史上首场毒气战有多可怕?
黄绿色气体
有刺激性气味
密度比空气大
怎么闻氯气?
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
一、氯气物理性质
易液化
液氯是纯净物
储存在钢瓶中
一、氯气物理性质
能溶于水
(1体积水可溶解2体积氯气)其水溶液称“氯水”
一、氯气物理性质
二、氯气化学性质
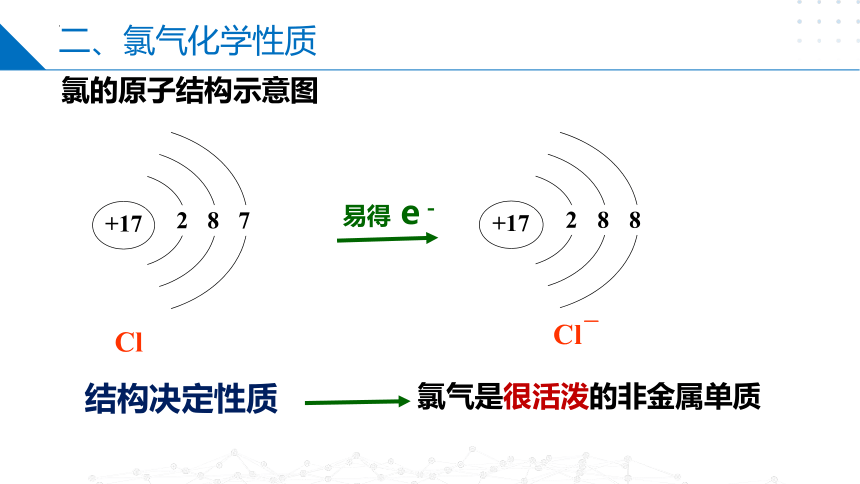
Cl
Cl-
易得 e-
+17
2
8
7
+17
2
8
8
结构决定性质
氯气是很活泼的非金属单质
氯的原子结构示意图
二、氯气化学性质
1、氯气与金属单质反应
钠铁铜
二、氯气化学性质
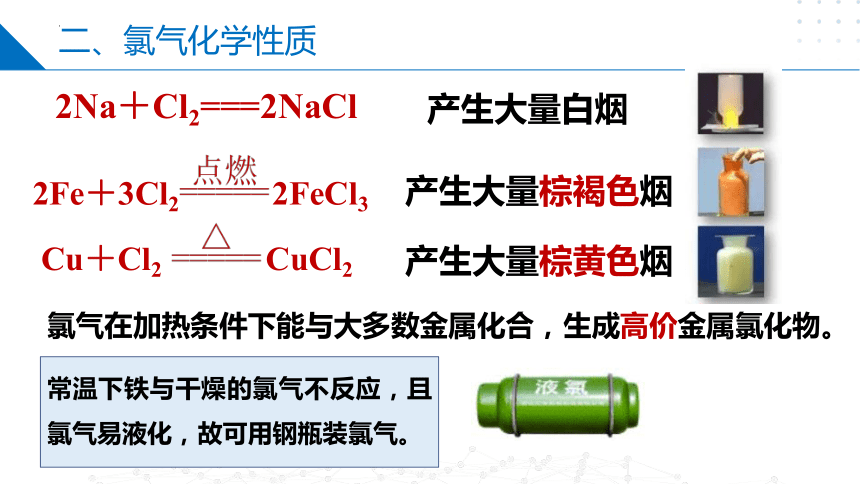
2Fe+3Cl2 2FeCl3
Cu+Cl2 CuCl2
产生大量棕褐色烟
产生大量棕黄色烟
氯气在加热条件下能与大多数金属化合,生成高价金属氯化物。
2Na+Cl2===2NaCl
产生大量白烟
常温下铁与干燥的氯气不反应,且氯气易液化,故可用钢瓶装氯气。
二、氯气化学性质
2、氯气与非金属单质反应
二、氯气化学性质
氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
将H2与Cl2混合点燃或强光照射会发生爆炸。
二、氯气化学性质
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
燃烧不一定要有氧气参加
燃烧的本质是氧化还原反应
任何发光发热的剧烈的化学反应叫做燃烧
二、氯气化学性质
用自来水养鱼前,为什么要先进行曝气处理?
除氯
自来水厂用氯气杀菌,消毒。
Cl2 + H2O HCl + HClO
1体积的水能溶解2体积的Cl2,Cl2能溶于水,溶于水中的部分Cl2与水反应。
3、氯气与水反应
可逆反应
次氯酸
+1
-1
0
二、氯气化学性质
二、氯气化学性质
Cl2 + H2O HCl + HClO
实验操作 实验现象 实验结论
_______________ _____________________
____________ ________________
有色布条不褪色
有色布条褪色
干燥氯气不具有漂白性
氯水具有漂白性
湿润的氯气有漂白作用,起漂白作用的是HClO
二、氯气化学性质
次氯酸的性质:
1.弱酸性 酸性:H2CO3 >HClO
2HClO 2HCl+O2↑
光
3.强氧化性
漂白作用;可用于自来水的杀菌、消毒,可用做漂白剂。
2.不稳定易分解
思考
新制氯水的成分有哪些?
二、氯气化学性质
Cl2+H2O HCl+HClO
HCl===H++Cl-(完全电离)
HClO H++ClO-(微弱电离)
2HClO2HCl+O2↑
H2O H++OH-
极少量
二、氯气化学性质
探究实验:氯水的成分
微粒 实验操作 现象
浅黄绿色,有刺激性气味
观察新制氯水颜色并闻气味
Cl2
H+
Cl-
HClO
取新制氯水,滴加碳酸氢钠溶液
取新制氯水,滴加稀硝酸和硝酸银溶液
用玻璃棒蘸取新制氯水,滴在PH试纸中部,观察
有气泡冒出
生成白色沉淀
先变红后褪色
二、氯气化学性质
二、氯气化学性质
名称 新制氯水 久置氯水
物质类别 混合物 混合物
成分 __________________ ___________ _____________________
颜色 色 色
酸性 pH新 pH久 漂白性 ____ ____ Cl2、HClO、H2O、
H+、Cl-、ClO-、OH-
H2O、
H+、Cl-、OH-
浅黄绿
无
>
有
无
氯水只能现配现用,并盛放在棕色试剂瓶中。
三分四离
二、氯气化学性质
4、氯气与碱反应
Cl2+2NaOH===NaClO+NaCl+H2O
次氯酸钠
——利用NaOH溶液吸收Cl2尾气
生产漂白液/消毒液的原理
二、氯气化学性质
工业上常用氯气和石灰乳制成漂白粉
2Ca(OH)2 + 2Cl2 ═ Ca(ClO)2 + CaCl2+ 2H2O
主要成分
有效成分:Ca(ClO)2
二、氯气化学性质
Ca(ClO)2+CO2 + 2H2O ═ CaCO3 ↓ + 2HClO
Ca(ClO)2+CO2 + 2H2O ═ CaCO3 ↓ + 2HClO
2HClO 2HCl+O2↑
光照
漂白粉的漂白原理:
漂白粉在空气中久置失效:
漂白粉应密封、避光保存,并置于阴凉干燥处。
思考
洁厕灵主要成分是盐酸,能和84能混用吗?
二、氯气化学性质
品红溶液
淀粉KI溶液
洁厕灵和84混合液
生成了氯气
NaClO+2HCl=NaCl+Cl2↑+H2O
二、氯气化学性质
二、氯气化学性质
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
典例解析
例2.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中正确的是( )
A.金属铁和铜在氯气里剧烈燃烧,均得到高价态的金属氯化物
B.纯净的H2在Cl2中安静地燃烧,发出蓝色火焰,集气瓶口出现白雾
C.氯气与澄清石灰水反应制备漂白粉,漂白粉可用来杀菌消毒
D.干燥的氯气能使鲜花褪色是因为氯气具有漂白性
A
课堂小结
氯气物理性质
氯气化学性质
不良反应
颜色 气味
水溶性
密度
与金属反应
与非金属反应
与水反应
与碱反应
随堂练习
1.下列关于氯及其化合物的叙述中,正确的组合是( )
①氯气是一种黄绿色、有刺激性气味的气体
②氯气在常温下能与铁反应,故不能用钢瓶储存液氯
③氯气与铜在加热条件下反应,生成CuCl
④纯净的氢气在氯气中安静地燃烧,发出苍白色火焰
⑤新制的氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
⑥氯气通入冷的石灰乳中,可制得以Ca(ClO)2为有效成分的漂白粉
A.①②⑤ B.①④⑥ C.②③⑤ D.③④⑥
B
随堂练习
2. 洪灾过后,饮用水的消毒、杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是 (填化学式)。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,发生化学反应的方程式为 。
(4)瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白粉在空气中易失效的原因: 。
Ca(ClO)2+CO2+H2O===CaCO3↓+
2HClO
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
2HClO 2HCl+O2↑
谢谢观看
THANKS
第一节 氯气及氯的化合物 课时2 氯气的性质及应用
第三章 从海水中获得的化学物质
授课人:
学习目标
1.从氯的原子结构特点和氯气跟金属、非金属的反应认识氯气是一种化学性质非常活泼的非金属。
2.知道氯气与水反应的产物,熟知氯水的成分和性质。
3.掌握氯气与碱的反应,认识含氯化合物在生产中的应用和对生态环境的影响,促进“社会责任”核心素养的发展。
史上首场毒气战有多可怕?
黄绿色气体
有刺激性气味
密度比空气大
怎么闻氯气?
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
一、氯气物理性质
易液化
液氯是纯净物
储存在钢瓶中
一、氯气物理性质
能溶于水
(1体积水可溶解2体积氯气)其水溶液称“氯水”
一、氯气物理性质
二、氯气化学性质
Cl
Cl-
易得 e-
+17
2
8
7
+17
2
8
8
结构决定性质
氯气是很活泼的非金属单质
氯的原子结构示意图
二、氯气化学性质
1、氯气与金属单质反应
钠铁铜
二、氯气化学性质
2Fe+3Cl2 2FeCl3
Cu+Cl2 CuCl2
产生大量棕褐色烟
产生大量棕黄色烟
氯气在加热条件下能与大多数金属化合,生成高价金属氯化物。
2Na+Cl2===2NaCl
产生大量白烟
常温下铁与干燥的氯气不反应,且氯气易液化,故可用钢瓶装氯气。
二、氯气化学性质
2、氯气与非金属单质反应
二、氯气化学性质
氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
将H2与Cl2混合点燃或强光照射会发生爆炸。
二、氯气化学性质
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
燃烧不一定要有氧气参加
燃烧的本质是氧化还原反应
任何发光发热的剧烈的化学反应叫做燃烧
二、氯气化学性质
用自来水养鱼前,为什么要先进行曝气处理?
除氯
自来水厂用氯气杀菌,消毒。
Cl2 + H2O HCl + HClO
1体积的水能溶解2体积的Cl2,Cl2能溶于水,溶于水中的部分Cl2与水反应。
3、氯气与水反应
可逆反应
次氯酸
+1
-1
0
二、氯气化学性质
二、氯气化学性质
Cl2 + H2O HCl + HClO
实验操作 实验现象 实验结论
_______________ _____________________
____________ ________________
有色布条不褪色
有色布条褪色
干燥氯气不具有漂白性
氯水具有漂白性
湿润的氯气有漂白作用,起漂白作用的是HClO
二、氯气化学性质
次氯酸的性质:
1.弱酸性 酸性:H2CO3 >HClO
2HClO 2HCl+O2↑
光
3.强氧化性
漂白作用;可用于自来水的杀菌、消毒,可用做漂白剂。
2.不稳定易分解
思考
新制氯水的成分有哪些?
二、氯气化学性质
Cl2+H2O HCl+HClO
HCl===H++Cl-(完全电离)
HClO H++ClO-(微弱电离)
2HClO2HCl+O2↑
H2O H++OH-
极少量
二、氯气化学性质
探究实验:氯水的成分
微粒 实验操作 现象
浅黄绿色,有刺激性气味
观察新制氯水颜色并闻气味
Cl2
H+
Cl-
HClO
取新制氯水,滴加碳酸氢钠溶液
取新制氯水,滴加稀硝酸和硝酸银溶液
用玻璃棒蘸取新制氯水,滴在PH试纸中部,观察
有气泡冒出
生成白色沉淀
先变红后褪色
二、氯气化学性质
二、氯气化学性质
名称 新制氯水 久置氯水
物质类别 混合物 混合物
成分 __________________ ___________ _____________________
颜色 色 色
酸性 pH新 pH久 漂白性 ____ ____ Cl2、HClO、H2O、
H+、Cl-、ClO-、OH-
H2O、
H+、Cl-、OH-
浅黄绿
无
>
有
无
氯水只能现配现用,并盛放在棕色试剂瓶中。
三分四离
二、氯气化学性质
4、氯气与碱反应
Cl2+2NaOH===NaClO+NaCl+H2O
次氯酸钠
——利用NaOH溶液吸收Cl2尾气
生产漂白液/消毒液的原理
二、氯气化学性质
工业上常用氯气和石灰乳制成漂白粉
2Ca(OH)2 + 2Cl2 ═ Ca(ClO)2 + CaCl2+ 2H2O
主要成分
有效成分:Ca(ClO)2
二、氯气化学性质
Ca(ClO)2+CO2 + 2H2O ═ CaCO3 ↓ + 2HClO
Ca(ClO)2+CO2 + 2H2O ═ CaCO3 ↓ + 2HClO
2HClO 2HCl+O2↑
光照
漂白粉的漂白原理:
漂白粉在空气中久置失效:
漂白粉应密封、避光保存,并置于阴凉干燥处。
思考
洁厕灵主要成分是盐酸,能和84能混用吗?
二、氯气化学性质
品红溶液
淀粉KI溶液
洁厕灵和84混合液
生成了氯气
NaClO+2HCl=NaCl+Cl2↑+H2O
二、氯气化学性质
二、氯气化学性质
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
典例解析
例2.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中正确的是( )
A.金属铁和铜在氯气里剧烈燃烧,均得到高价态的金属氯化物
B.纯净的H2在Cl2中安静地燃烧,发出蓝色火焰,集气瓶口出现白雾
C.氯气与澄清石灰水反应制备漂白粉,漂白粉可用来杀菌消毒
D.干燥的氯气能使鲜花褪色是因为氯气具有漂白性
A
课堂小结
氯气物理性质
氯气化学性质
不良反应
颜色 气味
水溶性
密度
与金属反应
与非金属反应
与水反应
与碱反应
随堂练习
1.下列关于氯及其化合物的叙述中,正确的组合是( )
①氯气是一种黄绿色、有刺激性气味的气体
②氯气在常温下能与铁反应,故不能用钢瓶储存液氯
③氯气与铜在加热条件下反应,生成CuCl
④纯净的氢气在氯气中安静地燃烧,发出苍白色火焰
⑤新制的氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
⑥氯气通入冷的石灰乳中,可制得以Ca(ClO)2为有效成分的漂白粉
A.①②⑤ B.①④⑥ C.②③⑤ D.③④⑥
B
随堂练习
2. 洪灾过后,饮用水的消毒、杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是 (填化学式)。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,发生化学反应的方程式为 。
(4)瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白粉在空气中易失效的原因: 。
Ca(ClO)2+CO2+H2O===CaCO3↓+
2HClO
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
2HClO 2HCl+O2↑
谢谢观看
THANKS
