3.3.2共价键键能与化学反应的反应热 共价晶体(同步课件)(共29张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册)
文档属性
| 名称 | 3.3.2共价键键能与化学反应的反应热 共价晶体(同步课件)(共29张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:12:25 | ||
图片预览



文档简介
(共29张PPT)
第三节 共价键 共价晶体
课时2 共价键键能与化学反应的
反应热 共价晶体
第三章 微粒间作用力与物质性质
授课人:
学习目标
1.通过从化学键的断裂和形成的角度认识化学反应中的能量变化,理解晶体中微粒间相互作用对共价晶体性质的影响,能从宏观和微观相结合的视角分析与解决实际问题。
2.能辨识常见的共价晶体,了解常见的共价晶体的结构,并预测其性质。
原子之间形成的共价键的强度可以用键能来描述。
一、共价键键能与化学反应的反应热
一、共价键键能与化学反应的反应热
键能:
人们把在101 kPa、298 K(25℃)条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,或气态基态原子A原子和B原子形成1 mol气态AB分子释放的最低能量。
通常是298 K、101 KPa条件下的标准值。
单位:kJ·mol-1
键能越大,共价键越牢固, 由此形成的分子越稳定。
注意:键能是指共价键,其他化学键的能量不能叫做键能。
一、共价键键能与化学反应的反应热
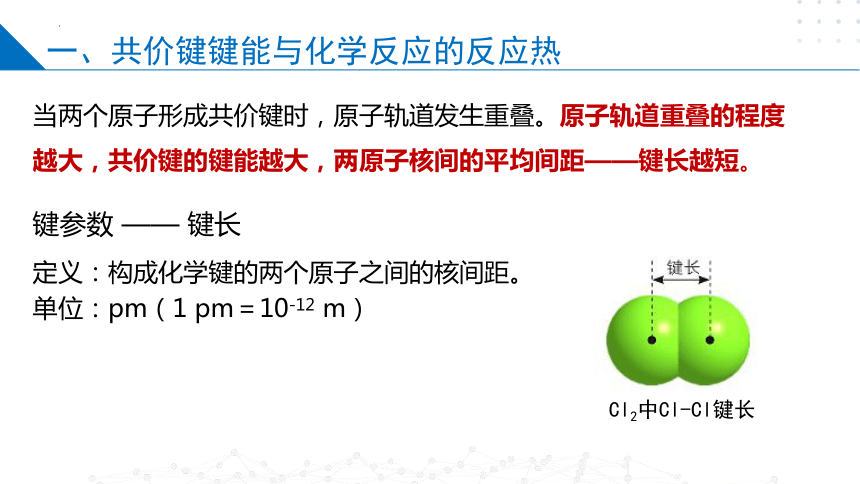
当两个原子形成共价键时,原子轨道发生重叠。原子轨道重叠的程度越大,共价键的键能越大,两原子核间的平均间距——键长越短。
定义:构成化学键的两个原子之间的核间距。
单位:pm(1 pm=10-12 m)
Cl2中Cl-Cl键长
键参数 —— 键长
一、共价键键能与化学反应的反应热
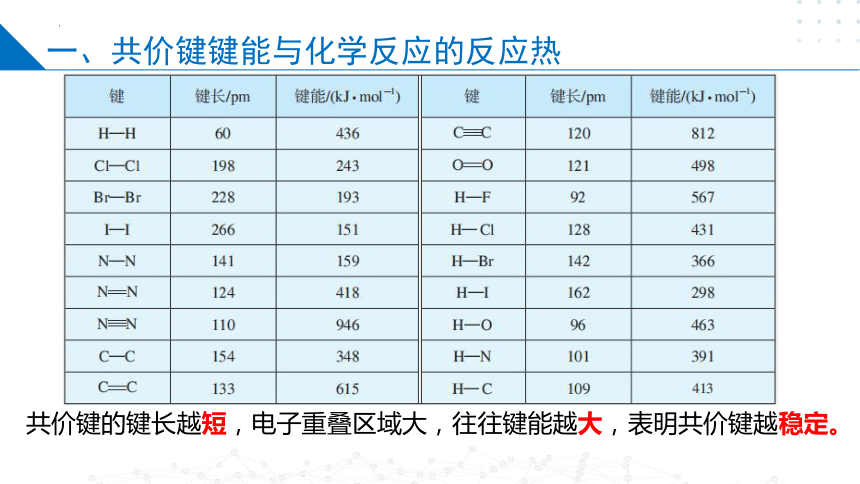
共价键的键长越短,电子重叠区域大,往往键能越大,表明共价键越稳定。
一、共价键键能与化学反应的反应热
键 键长pm 键 键长pm
F-F 141 H-F 92
Cl-Cl 198 H-Cl 127
Br-Br 228 H-Br 142
I-I 267 H-I 161
思考
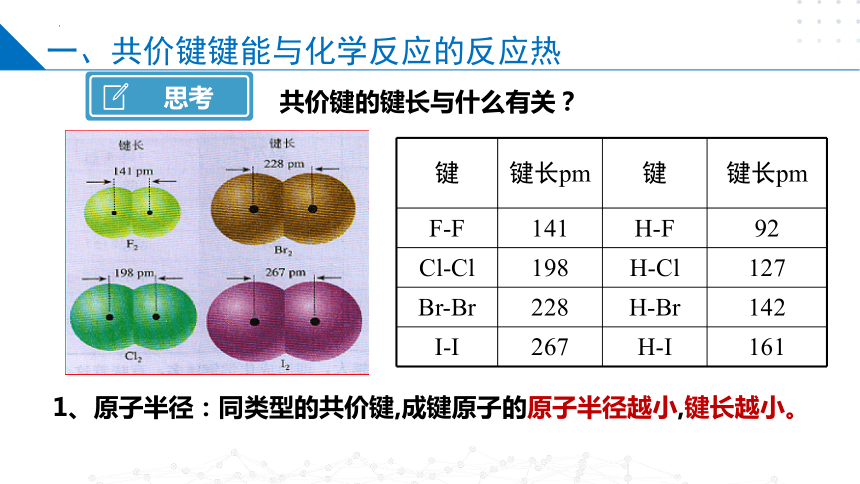
共价键的键长与什么有关?
1、原子半径:同类型的共价键,成键原子的原子半径越小,键长越小。
一、共价键键能与化学反应的反应热
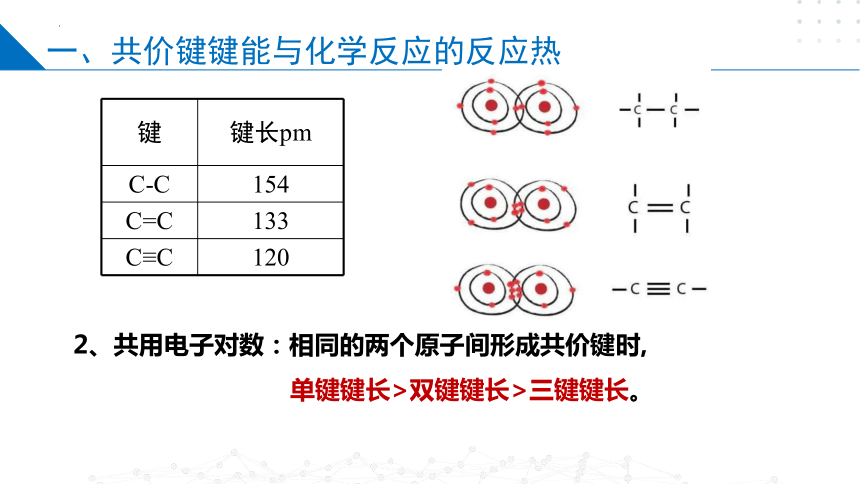
键 键长pm
C-C 154
C=C 133
C≡C 120
2、共用电子对数:相同的两个原子间形成共价键时,
单键键长>双键键长>三键键长。
一、共价键键能与化学反应的反应热
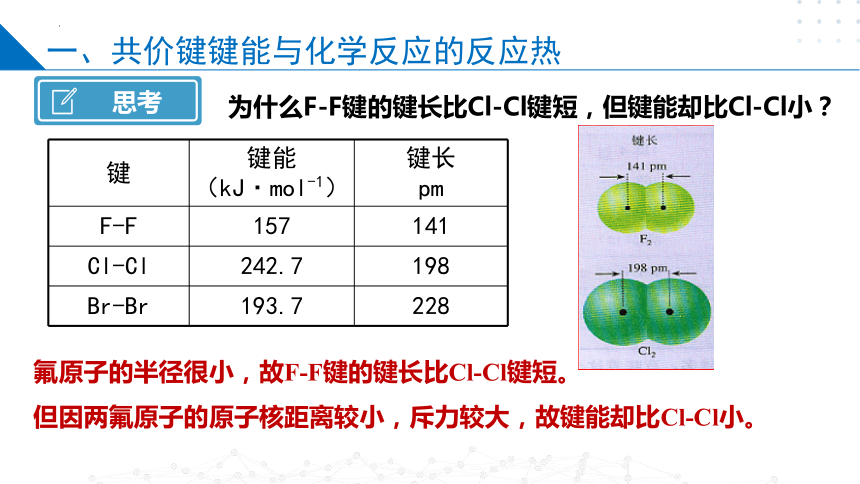
键 键能 (kJ·mol-1) 键长
pm
F-F 157 141
Cl-Cl 242.7 198
Br-Br 193.7 228
思考
为什么F-F键的键长比Cl-Cl键短,但键能却比Cl-Cl小?
氟原子的半径很小,故F-F键的键长比Cl-Cl键短。
但因两氟原子的原子核距离较小,斥力较大,故键能却比Cl-Cl小。
一、共价键键能与化学反应的反应热
思考
根据元素周期律可知,HF、HCl、HBr、HI的稳定性依次增强,请利用键参数加以解释。
键长H—F键能H—F>H—Cl>H—Br>H—I,
故HF、HCl、HBr、HI的稳定性依次增强。
卤化氢 HCl HBr HI
在1 000 ℃分解的百分数/% 0.0014 0.5 33
氢卤键的键能(kJ·mol-1) 431.8 366 298.7
氢卤键的键长pm 127 142 161
结构相似的分子中,共价键的键能越大,分子越稳定。
一、共价键键能与化学反应的反应热
N2(g)和O2(g)生成NO(g)过程中的能量变化
化学反应中发生旧化学键的断裂和新化学键的形成。
一、共价键键能与化学反应的反应热
反应物和生成物中化学键的强弱直接决定着化学反应过程中的能量变化。
吸收
放出
吸热
放热
旧化学键断裂所吸收的总能量
新化学键形成所放出的总能量
一、共价键键能与化学反应的反应热
ΔH<0时,为放热反应
ΔH>0时,为吸热反应
在化学反应中,旧化学键断裂吸收能量,新化学键的形成释放能量。
反应焓变与键能的关系为:
ΔH=反应物键能总和-生成物键能总和
典例解析
例1 已知N—N、N===N和NN键能之比为1.00:2.17:4.90,而C—C、C===C和C≡C键能之比为1.00:1.77:2.34。下列说法正确的是( )A.σ键一定比π键稳定B.N2较易发生加成反应C.乙烯、乙炔较易发生加成反应D.乙烯、乙炔中的π键比σ键稳定
C
二、共价晶体
概念:
相邻原子间以共价键结合而形成空间网状结构的晶体。
金刚石、用金刚石制成的钻头
组成的粒子:原子
粒子间的作用力:共价键
常见的共价晶体
(1)硼(B)、硅(Si)、锗(Ge)和灰锡(Sn)
(2)金刚砂(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2)
(3)极少数金属氧化物,如刚玉(Al2O3)
二、共价晶体
单晶硅
SiO2
由于共价键的键能大,所以共价晶体一般具有很高的熔、沸点和很大的硬度。
二、共价晶体
在金刚石晶体里以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。
最小的碳环由6个碳组成,且不在同一平面内。
晶体中C—C—C夹角为109°28′;
二、共价晶体
顶点
体内
面心
金刚石的晶胞
顶点:8× =1
面心:6× =3
体内:4
1+3+4=8
8
1
2
1
思考
一个金刚石晶胞中,含有几个碳原子?
二、共价晶体
思考
金刚石中,1 mol C 形成的共价键数目是多少?
共价键
2 mol
每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:1 :(4 x )= 1:2
二、共价晶体
晶体硅:将金刚石晶胞中的碳原子换成硅原子,就是晶体硅的晶胞。每个晶体硅晶胞中有8个硅原子。
碳化硅:将晶体硅晶胞的顶点、面心上的硅原子换成碳原子,体内4个硅原子不变,就是碳化硅的晶胞。
晶体硅的结构示意图
碳化硅的晶胞
每个碳化硅晶胞中有4个碳原子、4个硅原子。
二、共价晶体
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
二氧化硅晶体
二、共价晶体
分析二氧化硅晶体结构模型,判断晶体中最小的环上有多少个原子
1 mol SiO2中含有4 mol Si—O键
1 mol SiO2中含有多少摩尔Si—O键
SiO2晶体中最小环上有12个原子
因此二氧化硅晶体中并不存在单个的SiO2分子,它是由硅原子和氧原子按1∶2的比例组成的空间立体网状结构的晶体。
二、共价晶体
对于结构相似的共价晶体而言,
共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。
二、共价晶体
共价晶体的物理性质
①熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
②硬度很大:共价键作用强。
③一般不导电,但晶体硅是半导体
④难溶于一般溶剂
熔点高(通常>1000 ℃),如金刚石的熔点大于3 550 ℃。
共价晶体中原子半径越小,键长越短,键能越大,晶体熔、沸点就越高。
典例解析
例2 我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是( )
A.11BN和10BN的性质无差异B.该晶体具有良好的导电性C.该晶胞中含有14个B原子,4个N原子D.N原子周围等距且最近的N原子数为12
D
课堂小结
共价键键能与化学反应的反应热
共价晶体
不良反应
键能
键长
化学键与反应热的关系
共价晶体的概念和结构特点
常见的共价晶体
共价晶体物理性质
随堂练习
1、氮氧化铝(AlON)属于共价晶体,是一种超强透明材料。下列描述错误的是( )A.AlON和石英的化学键类型相同B.电解熔融AlON可得到AlC.AlON中N元素化合价为-1D.AlON和石英晶体类型相同
B
随堂练习
2.在40 GPa的高压容器中,用Nd:YbLiF4激光器将液态二氧化碳加热到1 800 K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是( )A.该晶体属于分子晶体B.硬度与金刚石相近C.熔点较低D.硬度较小
B
谢谢观看
THANKS
第三节 共价键 共价晶体
课时2 共价键键能与化学反应的
反应热 共价晶体
第三章 微粒间作用力与物质性质
授课人:
学习目标
1.通过从化学键的断裂和形成的角度认识化学反应中的能量变化,理解晶体中微粒间相互作用对共价晶体性质的影响,能从宏观和微观相结合的视角分析与解决实际问题。
2.能辨识常见的共价晶体,了解常见的共价晶体的结构,并预测其性质。
原子之间形成的共价键的强度可以用键能来描述。
一、共价键键能与化学反应的反应热
一、共价键键能与化学反应的反应热
键能:
人们把在101 kPa、298 K(25℃)条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,或气态基态原子A原子和B原子形成1 mol气态AB分子释放的最低能量。
通常是298 K、101 KPa条件下的标准值。
单位:kJ·mol-1
键能越大,共价键越牢固, 由此形成的分子越稳定。
注意:键能是指共价键,其他化学键的能量不能叫做键能。
一、共价键键能与化学反应的反应热
当两个原子形成共价键时,原子轨道发生重叠。原子轨道重叠的程度越大,共价键的键能越大,两原子核间的平均间距——键长越短。
定义:构成化学键的两个原子之间的核间距。
单位:pm(1 pm=10-12 m)
Cl2中Cl-Cl键长
键参数 —— 键长
一、共价键键能与化学反应的反应热
共价键的键长越短,电子重叠区域大,往往键能越大,表明共价键越稳定。
一、共价键键能与化学反应的反应热
键 键长pm 键 键长pm
F-F 141 H-F 92
Cl-Cl 198 H-Cl 127
Br-Br 228 H-Br 142
I-I 267 H-I 161
思考
共价键的键长与什么有关?
1、原子半径:同类型的共价键,成键原子的原子半径越小,键长越小。
一、共价键键能与化学反应的反应热
键 键长pm
C-C 154
C=C 133
C≡C 120
2、共用电子对数:相同的两个原子间形成共价键时,
单键键长>双键键长>三键键长。
一、共价键键能与化学反应的反应热
键 键能 (kJ·mol-1) 键长
pm
F-F 157 141
Cl-Cl 242.7 198
Br-Br 193.7 228
思考
为什么F-F键的键长比Cl-Cl键短,但键能却比Cl-Cl小?
氟原子的半径很小,故F-F键的键长比Cl-Cl键短。
但因两氟原子的原子核距离较小,斥力较大,故键能却比Cl-Cl小。
一、共价键键能与化学反应的反应热
思考
根据元素周期律可知,HF、HCl、HBr、HI的稳定性依次增强,请利用键参数加以解释。
键长H—F
故HF、HCl、HBr、HI的稳定性依次增强。
卤化氢 HCl HBr HI
在1 000 ℃分解的百分数/% 0.0014 0.5 33
氢卤键的键能(kJ·mol-1) 431.8 366 298.7
氢卤键的键长pm 127 142 161
结构相似的分子中,共价键的键能越大,分子越稳定。
一、共价键键能与化学反应的反应热
N2(g)和O2(g)生成NO(g)过程中的能量变化
化学反应中发生旧化学键的断裂和新化学键的形成。
一、共价键键能与化学反应的反应热
反应物和生成物中化学键的强弱直接决定着化学反应过程中的能量变化。
吸收
放出
吸热
放热
旧化学键断裂所吸收的总能量
新化学键形成所放出的总能量
一、共价键键能与化学反应的反应热
ΔH<0时,为放热反应
ΔH>0时,为吸热反应
在化学反应中,旧化学键断裂吸收能量,新化学键的形成释放能量。
反应焓变与键能的关系为:
ΔH=反应物键能总和-生成物键能总和
典例解析
例1 已知N—N、N===N和NN键能之比为1.00:2.17:4.90,而C—C、C===C和C≡C键能之比为1.00:1.77:2.34。下列说法正确的是( )A.σ键一定比π键稳定B.N2较易发生加成反应C.乙烯、乙炔较易发生加成反应D.乙烯、乙炔中的π键比σ键稳定
C
二、共价晶体
概念:
相邻原子间以共价键结合而形成空间网状结构的晶体。
金刚石、用金刚石制成的钻头
组成的粒子:原子
粒子间的作用力:共价键
常见的共价晶体
(1)硼(B)、硅(Si)、锗(Ge)和灰锡(Sn)
(2)金刚砂(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2)
(3)极少数金属氧化物,如刚玉(Al2O3)
二、共价晶体
单晶硅
SiO2
由于共价键的键能大,所以共价晶体一般具有很高的熔、沸点和很大的硬度。
二、共价晶体
在金刚石晶体里以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。
最小的碳环由6个碳组成,且不在同一平面内。
晶体中C—C—C夹角为109°28′;
二、共价晶体
顶点
体内
面心
金刚石的晶胞
顶点:8× =1
面心:6× =3
体内:4
1+3+4=8
8
1
2
1
思考
一个金刚石晶胞中,含有几个碳原子?
二、共价晶体
思考
金刚石中,1 mol C 形成的共价键数目是多少?
共价键
2 mol
每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:1 :(4 x )= 1:2
二、共价晶体
晶体硅:将金刚石晶胞中的碳原子换成硅原子,就是晶体硅的晶胞。每个晶体硅晶胞中有8个硅原子。
碳化硅:将晶体硅晶胞的顶点、面心上的硅原子换成碳原子,体内4个硅原子不变,就是碳化硅的晶胞。
晶体硅的结构示意图
碳化硅的晶胞
每个碳化硅晶胞中有4个碳原子、4个硅原子。
二、共价晶体
石英的左、右型晶体
二氧化硅晶体中硅氧四面体螺旋结构
石英表
二氧化硅晶体
二、共价晶体
分析二氧化硅晶体结构模型,判断晶体中最小的环上有多少个原子
1 mol SiO2中含有4 mol Si—O键
1 mol SiO2中含有多少摩尔Si—O键
SiO2晶体中最小环上有12个原子
因此二氧化硅晶体中并不存在单个的SiO2分子,它是由硅原子和氧原子按1∶2的比例组成的空间立体网状结构的晶体。
二、共价晶体
对于结构相似的共价晶体而言,
共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。
二、共价晶体
共价晶体的物理性质
①熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
②硬度很大:共价键作用强。
③一般不导电,但晶体硅是半导体
④难溶于一般溶剂
熔点高(通常>1000 ℃),如金刚石的熔点大于3 550 ℃。
共价晶体中原子半径越小,键长越短,键能越大,晶体熔、沸点就越高。
典例解析
例2 我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法正确的是( )
A.11BN和10BN的性质无差异B.该晶体具有良好的导电性C.该晶胞中含有14个B原子,4个N原子D.N原子周围等距且最近的N原子数为12
D
课堂小结
共价键键能与化学反应的反应热
共价晶体
不良反应
键能
键长
化学键与反应热的关系
共价晶体的概念和结构特点
常见的共价晶体
共价晶体物理性质
随堂练习
1、氮氧化铝(AlON)属于共价晶体,是一种超强透明材料。下列描述错误的是( )A.AlON和石英的化学键类型相同B.电解熔融AlON可得到AlC.AlON中N元素化合价为-1D.AlON和石英晶体类型相同
B
随堂练习
2.在40 GPa的高压容器中,用Nd:YbLiF4激光器将液态二氧化碳加热到1 800 K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是( )A.该晶体属于分子晶体B.硬度与金刚石相近C.熔点较低D.硬度较小
B
谢谢观看
THANKS
