4.1.2价层电子对互斥模型和等电子原理(同步课件)(共33张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册)
文档属性
| 名称 | 4.1.2价层电子对互斥模型和等电子原理(同步课件)(共33张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:19:15 | ||
图片预览








文档简介
(共33张PPT)
第一节 分子的空间结构
课时2 价层电子对互斥模型和等电子原理
第四章 分子空间结构与物质性质
授课人:
学习目标
1.了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
2.了解价层电子对互斥理论,通过对价层电子对互斥模型的探究,建立判断分子空间结构的思维模型。
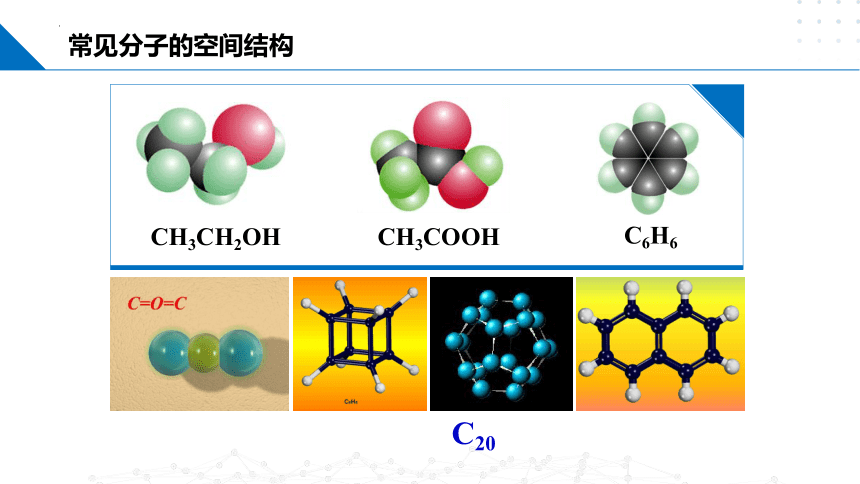
常见分子的空间结构
CH3CH2OH
CH3COOH
C6H6
C20
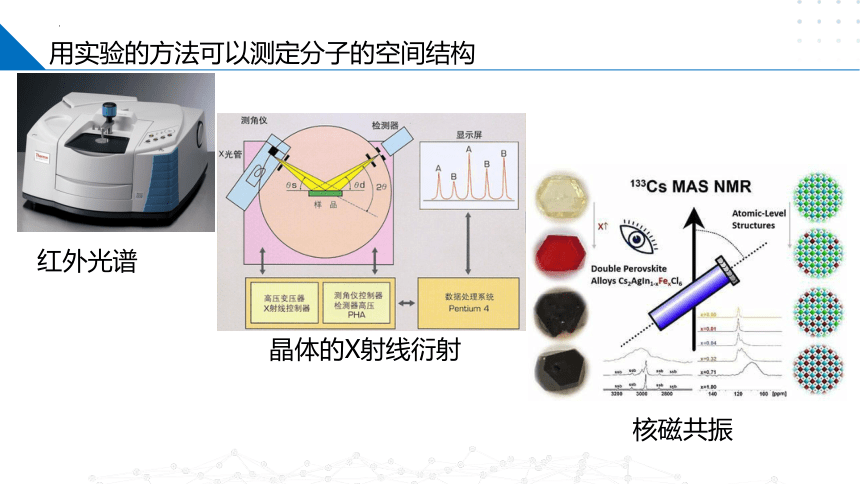
用实验的方法可以测定分子的空间结构
红外光谱
晶体的X射线衍射
核磁共振
CO2 直线形 180° 键长116pm
H2O V形 104°30′ 键长116pm
NH3 三角锥形 107°18′ 键长101pm
CH4、NH3、H2O分子中,中心原子形成什么类型的杂化轨道?
CH4 正四面体形 109°28′ 键长109pm
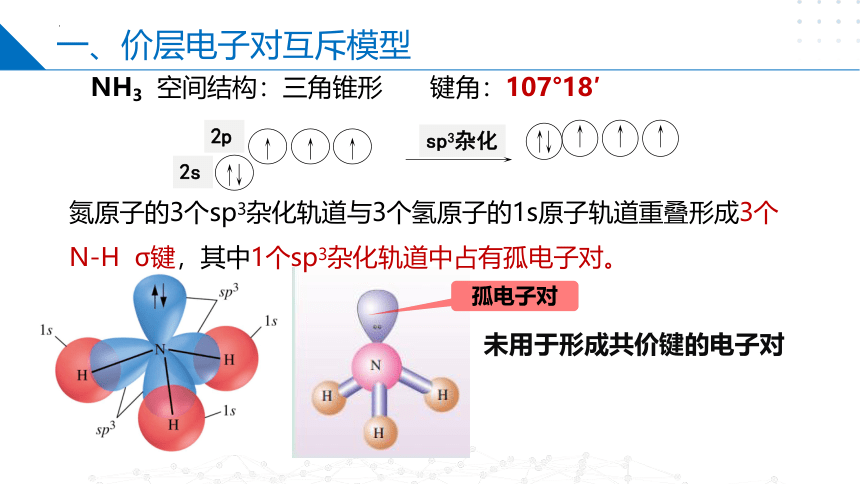
一、价层电子对互斥模型
NH3 空间结构:三角锥形
键角:107°18′
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-H σ键,其中1个sp3杂化轨道中占有孤电子对。
sp3杂化
2s
2p
未用于形成共价键的电子对
孤电子对
一、价层电子对互斥模型
H2O 空间结构:V形
键角为:104°30′
sp3杂化
2s
2p
109°28′
孤电子对
109°28′
氧原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个O-H σ键,其中2个sp3杂化轨道中占有孤电子对。
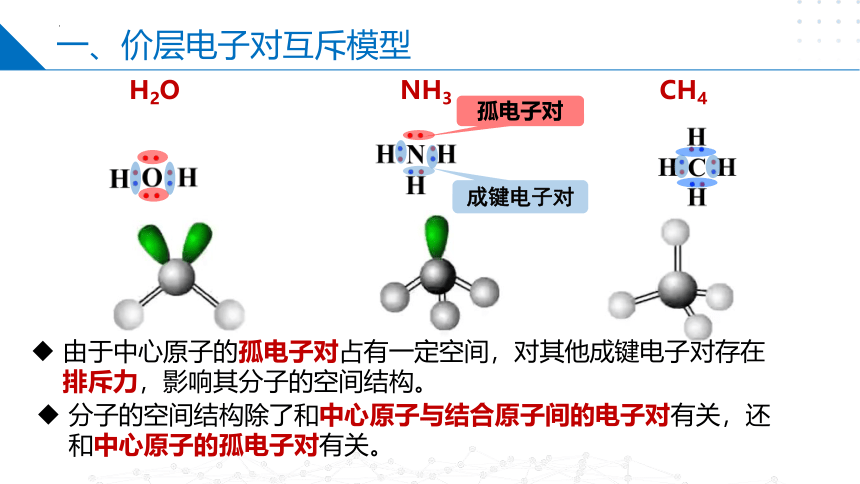
一、价层电子对互斥模型
H2O
CH4
NH3
成键电子对
孤电子对
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
分子的空间结构除了和中心原子与结合原子间的电子对有关,还和中心原子的孤电子对有关。
在1940年,希吉维克(Sedgwick)和坡维尔(Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经吉列斯比(R.J,Gillespie)和尼霍尔姆(Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR(Valence Shell Electron Pair Repulsion)。
价层电子对互斥理论
一、价层电子对互斥模型
一、价层电子对互斥模型
分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间结构。
内容:分子的空间结构是中心原子的“价电子对”相互排斥的结果。
一
价层电子对互斥(VSEPR models)模型
一、价层电子对互斥模型
ABm型分子的价电子对计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
二
价电子对的计算
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
对于主族元素,等于原子的最外层电子数,如:C为4个,N为5个;
对于阳离子,等于价电子数-离子电荷数,如:NH4+为5-1=4个;
对于阴离子,等于价电子数+|离子电荷数|,如:PO43-为5+3=8个。
一、价层电子对互斥模型
作为配位原子,卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算;
作为中心原子,卤素原子按提供7个价电子计算,氧族原子按提供6个价电子计算;
为与中心原子结合的原子最多能接受的电子数,H为1,
其他原子= 8-该原子的价电子数。 如:O为2、N为3(化合价数)
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
一、价层电子对互斥模型
价电子对数
空间结构
2
3
4
直线形
平面三角形
正四面体形
109°28′
价电子对(n)分布的几何构型
一、价层电子对互斥模型
价电子对互斥模型(VSEPR模型)的用途
预测分子或离子的空间构型
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构
一、价层电子对互斥模型
思考:
CO2为什么不是直角形状,而是直线型呢?
CO2 直线形 180° 键长116pm
CO2分子的价电子对数:
2
4+0×2
n=
=2
CO2分子价电子对为2。这2对价层电子对之间彼此排斥,便得到了直线型的VSEPR模型,也就是二氧化碳分子的空间构型。
一、价层电子对互斥模型
中心原子无孤电子对的分子
中心原子有孤电子对的分子
CH4
H2O
NH3
含孤电子对的VSEPR模型
分子的空间结构模型
V形
三角锥形
正四面体形
一、价层电子对互斥模型
CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为正四面体。
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。
一、价层电子对互斥模型
如果分子中中心原子的杂化轨道上存在孤电子对,由于孤电子对比成键电子对更靠近中心原子的原子核,因而价电子对之间的斥力大小顺序为:
随着孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。
孤电子对与孤电子对之间的斥力
>
孤电子对与成键电子对之间的斥力
成键电子对与成键电子对之间的斥力
>
一、价层电子对互斥模型
因此CH4、NH3和H2O分子中键角依次减小。
CH4分子中C原子的杂化轨道上没有孤电子对
NH3分子中N原子的杂化轨道上有1对孤电子对
H2O分子中O原子的杂化轨道上有2对孤电子对
一、价层电子对互斥模型
分子或离子 孤电子对数 价电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
SO2 1
CO32- 0
NH4+ 0
2
3
3
4
直线形
平面
三角形
平面
三角形
正四
面体形
直线形
V形
平面
三角形
正四
面体形
一、价层电子对互斥模型
价电子 对数 σ键电子 对数 孤电子 对数 电子对的 排列方式 价层电子对互斥模型 分子或离 子的空间结构 实例
2 0 2 直线形 直线形 BeCl2、
CO2
根据分子中成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
3 3 0 平面 三角形 平面三 角形 BF3、
BCl3
V形 PbCl2
2 1 一、价层电子对互斥模型
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
4 4 0 四面 体形 正四面 体形 CH4、
CCl4
三角 锥形 NH3
3 1 V形 H2O
2 2 一、价层电子对互斥模型
典例解析
例1 下列微粒的中心原子的孤电子对数或空间结构错误的是( )
D
二、等电子原理
1、等电子体
具有相同价电子数和相同原子数的分子或离子
具有相同的结构特征,性质相近
2、等电子体原理
C O
N N
结构
性质
决定
反映
原子总数 价电子数 空间结构 键能 KJ/mol 熔点℃ 沸点℃ 溶解度
25℃
CO 2 10 直线形 1071.1 -205 -191 2.3ml
N2 2 10 直线形 946 -210 -195 1.6ml
1个σ键和2个π键
典例解析
(1)同族元素互换法:即将既定粒子中的某元素换成它的同族元素。
(2)价电子迁移法:即将既定粒子中的某元素原子的价电子逐一转移给粒子中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
(3)电子电荷互换法:即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷,相应原子的质子数也随之减少或增加。这种方法可实现分子与离子的互换。
等电子体的确定方法
二、等电子原理
常见等电子体
CO N2
2个原子
价电子总数 10
3个原子
价电子总数 16
3个原子
价电子总数 18
4个原子
价电子总数 24
5个原子
价电子总数 32
平面
三角
直线型
V型
CO2 CS2
SO2 O3
SO3 BF3
CCl4 SiF4
CN– NO+ C22–
NO2+ N3–
NO2–
CO32– NO3–
SO42– PO43–
正四面体
核外电子总数不一定相同;
等电子体可以拓展到离子。
3、等电子原理应用:可以判断一些简单分子或离子的立体结构。
二、等电子原理
等电子体不仅有相似的空间结构,而且有相似的性质。
晶体硅、锗是良好的半导体材料,它们的等电子体磷化铝(AlP)、砷化镓(GaAs)也都是良好的半导体材料。
3、等电子原理应用:制造新材料等。
晶体硅
砷化镓
典例解析
B
课堂小结
价层电子对互斥模型
等电子原理
不良反应
价层电子对互斥理论
价电子对数计算方法
价层电子对互斥模型与分子空间结构
等电子体的确定方法
等电子原理应用
随堂练习
1.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的几何构型和中心原子(S)采取杂化方式的说法正确的是( )
A.平面三角形、sp2 B.V形、sp2
C.三角锥形、sp3 D.三角锥形、sp2
C
随堂练习
2.通常把原子总数和价电子总数相同的分子或离子称为等电子体,等电子体具有相似的化学结构,下列说法正确的是( )
A.H3O+和PCl3是等电子体,均为三角锥形结构
B.SO2和O3是等电子体,SO2和O3具有相同的化学性质
C.B3N3H6和苯是等电子体,所有原子共平面,均能发生取代反应
D.CO和N2是等电子体,都是非极性分子
C
谢谢观看
THANKS
第一节 分子的空间结构
课时2 价层电子对互斥模型和等电子原理
第四章 分子空间结构与物质性质
授课人:
学习目标
1.了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
2.了解价层电子对互斥理论,通过对价层电子对互斥模型的探究,建立判断分子空间结构的思维模型。
常见分子的空间结构
CH3CH2OH
CH3COOH
C6H6
C20
用实验的方法可以测定分子的空间结构
红外光谱
晶体的X射线衍射
核磁共振
CO2 直线形 180° 键长116pm
H2O V形 104°30′ 键长116pm
NH3 三角锥形 107°18′ 键长101pm
CH4、NH3、H2O分子中,中心原子形成什么类型的杂化轨道?
CH4 正四面体形 109°28′ 键长109pm
一、价层电子对互斥模型
NH3 空间结构:三角锥形
键角:107°18′
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-H σ键,其中1个sp3杂化轨道中占有孤电子对。
sp3杂化
2s
2p
未用于形成共价键的电子对
孤电子对
一、价层电子对互斥模型
H2O 空间结构:V形
键角为:104°30′
sp3杂化
2s
2p
109°28′
孤电子对
109°28′
氧原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个O-H σ键,其中2个sp3杂化轨道中占有孤电子对。
一、价层电子对互斥模型
H2O
CH4
NH3
成键电子对
孤电子对
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
分子的空间结构除了和中心原子与结合原子间的电子对有关,还和中心原子的孤电子对有关。
在1940年,希吉维克(Sedgwick)和坡维尔(Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经吉列斯比(R.J,Gillespie)和尼霍尔姆(Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR(Valence Shell Electron Pair Repulsion)。
价层电子对互斥理论
一、价层电子对互斥模型
一、价层电子对互斥模型
分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间结构。
内容:分子的空间结构是中心原子的“价电子对”相互排斥的结果。
一
价层电子对互斥(VSEPR models)模型
一、价层电子对互斥模型
ABm型分子的价电子对计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
二
价电子对的计算
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
对于主族元素,等于原子的最外层电子数,如:C为4个,N为5个;
对于阳离子,等于价电子数-离子电荷数,如:NH4+为5-1=4个;
对于阴离子,等于价电子数+|离子电荷数|,如:PO43-为5+3=8个。
一、价层电子对互斥模型
作为配位原子,卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算;
作为中心原子,卤素原子按提供7个价电子计算,氧族原子按提供6个价电子计算;
为与中心原子结合的原子最多能接受的电子数,H为1,
其他原子= 8-该原子的价电子数。 如:O为2、N为3(化合价数)
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
一、价层电子对互斥模型
价电子对数
空间结构
2
3
4
直线形
平面三角形
正四面体形
109°28′
价电子对(n)分布的几何构型
一、价层电子对互斥模型
价电子对互斥模型(VSEPR模型)的用途
预测分子或离子的空间构型
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构
一、价层电子对互斥模型
思考:
CO2为什么不是直角形状,而是直线型呢?
CO2 直线形 180° 键长116pm
CO2分子的价电子对数:
2
4+0×2
n=
=2
CO2分子价电子对为2。这2对价层电子对之间彼此排斥,便得到了直线型的VSEPR模型,也就是二氧化碳分子的空间构型。
一、价层电子对互斥模型
中心原子无孤电子对的分子
中心原子有孤电子对的分子
CH4
H2O
NH3
含孤电子对的VSEPR模型
分子的空间结构模型
V形
三角锥形
正四面体形
一、价层电子对互斥模型
CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为正四面体。
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。
一、价层电子对互斥模型
如果分子中中心原子的杂化轨道上存在孤电子对,由于孤电子对比成键电子对更靠近中心原子的原子核,因而价电子对之间的斥力大小顺序为:
随着孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。
孤电子对与孤电子对之间的斥力
>
孤电子对与成键电子对之间的斥力
成键电子对与成键电子对之间的斥力
>
一、价层电子对互斥模型
因此CH4、NH3和H2O分子中键角依次减小。
CH4分子中C原子的杂化轨道上没有孤电子对
NH3分子中N原子的杂化轨道上有1对孤电子对
H2O分子中O原子的杂化轨道上有2对孤电子对
一、价层电子对互斥模型
分子或离子 孤电子对数 价电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
SO2 1
CO32- 0
NH4+ 0
2
3
3
4
直线形
平面
三角形
平面
三角形
正四
面体形
直线形
V形
平面
三角形
正四
面体形
一、价层电子对互斥模型
价电子 对数 σ键电子 对数 孤电子 对数 电子对的 排列方式 价层电子对互斥模型 分子或离 子的空间结构 实例
2 0 2 直线形 直线形 BeCl2、
CO2
根据分子中成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
3 3 0 平面 三角形 平面三 角形 BF3、
BCl3
V形 PbCl2
2 1 一、价层电子对互斥模型
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
4 4 0 四面 体形 正四面 体形 CH4、
CCl4
三角 锥形 NH3
3 1 V形 H2O
2 2 一、价层电子对互斥模型
典例解析
例1 下列微粒的中心原子的孤电子对数或空间结构错误的是( )
D
二、等电子原理
1、等电子体
具有相同价电子数和相同原子数的分子或离子
具有相同的结构特征,性质相近
2、等电子体原理
C O
N N
结构
性质
决定
反映
原子总数 价电子数 空间结构 键能 KJ/mol 熔点℃ 沸点℃ 溶解度
25℃
CO 2 10 直线形 1071.1 -205 -191 2.3ml
N2 2 10 直线形 946 -210 -195 1.6ml
1个σ键和2个π键
典例解析
(1)同族元素互换法:即将既定粒子中的某元素换成它的同族元素。
(2)价电子迁移法:即将既定粒子中的某元素原子的价电子逐一转移给粒子中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
(3)电子电荷互换法:即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷,相应原子的质子数也随之减少或增加。这种方法可实现分子与离子的互换。
等电子体的确定方法
二、等电子原理
常见等电子体
CO N2
2个原子
价电子总数 10
3个原子
价电子总数 16
3个原子
价电子总数 18
4个原子
价电子总数 24
5个原子
价电子总数 32
平面
三角
直线型
V型
CO2 CS2
SO2 O3
SO3 BF3
CCl4 SiF4
CN– NO+ C22–
NO2+ N3–
NO2–
CO32– NO3–
SO42– PO43–
正四面体
核外电子总数不一定相同;
等电子体可以拓展到离子。
3、等电子原理应用:可以判断一些简单分子或离子的立体结构。
二、等电子原理
等电子体不仅有相似的空间结构,而且有相似的性质。
晶体硅、锗是良好的半导体材料,它们的等电子体磷化铝(AlP)、砷化镓(GaAs)也都是良好的半导体材料。
3、等电子原理应用:制造新材料等。
晶体硅
砷化镓
典例解析
B
课堂小结
价层电子对互斥模型
等电子原理
不良反应
价层电子对互斥理论
价电子对数计算方法
价层电子对互斥模型与分子空间结构
等电子体的确定方法
等电子原理应用
随堂练习
1.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的几何构型和中心原子(S)采取杂化方式的说法正确的是( )
A.平面三角形、sp2 B.V形、sp2
C.三角锥形、sp3 D.三角锥形、sp2
C
随堂练习
2.通常把原子总数和价电子总数相同的分子或离子称为等电子体,等电子体具有相似的化学结构,下列说法正确的是( )
A.H3O+和PCl3是等电子体,均为三角锥形结构
B.SO2和O3是等电子体,SO2和O3具有相同的化学性质
C.B3N3H6和苯是等电子体,所有原子共平面,均能发生取代反应
D.CO和N2是等电子体,都是非极性分子
C
谢谢观看
THANKS
