第4章 分子空间结构与物质性质(同步课件)(共37张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册)
文档属性
| 名称 | 第4章 分子空间结构与物质性质(同步课件)(共37张PPT)-2023-2024学年高二化学同步精品课堂(苏教版2019选择性必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:23:34 | ||
图片预览








文档简介
(共37张PPT)
第四章
分子空间结构与物质性质
授课人:
目录
CONTENTS
第一节
分子的空间结构模型——杂化轨道理论
第二节
价层电子对互斥模型和等电子原理
第三节
分子的极性和手性分子
第四节
配合物的形成和应用
第一节
Part One
分子的空间结构模型——杂化轨道理论
为了解释CH4等分子的空间结构,美国化学家鲍林于1931年提出了杂化轨道理论。
美国化学家鲍林
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组能量相等、成分相同的新轨道,这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。
一、杂化轨道理论
一、杂化轨道理论
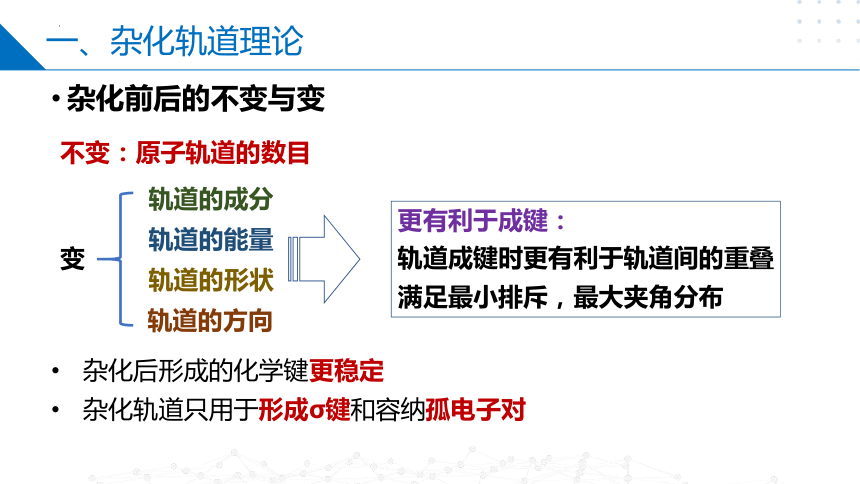
杂化前后的不变与变
不变:原子轨道的数目
变
轨道的成分
轨道的能量
轨道的形状
轨道的方向
更有利于成键:
轨道成键时更有利于轨道间的重叠
满足最小排斥,最大夹角分布
杂化后形成的化学键更稳定
杂化轨道只用于形成σ键和容纳孤电子对
一、杂化轨道理论
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个相同的C-H σ键,呈正四面体形。
甲烷分子中C—H键之间的夹角——键角
都是109°28'。
一、杂化轨道理论
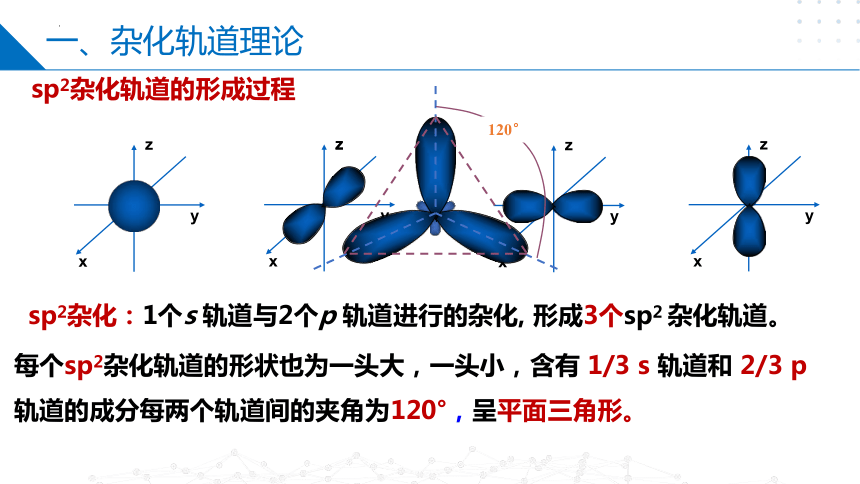
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分每两个轨道间的夹角为120°,呈平面三角形。
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
一、杂化轨道理论
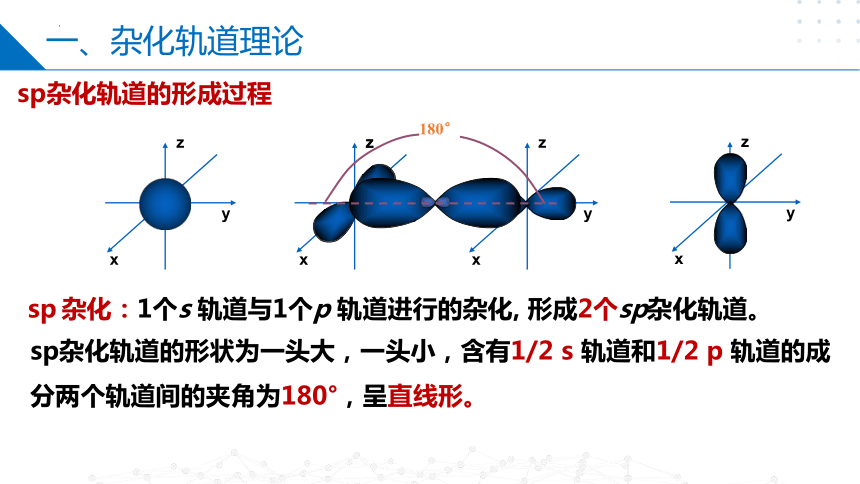
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线形。
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
总结
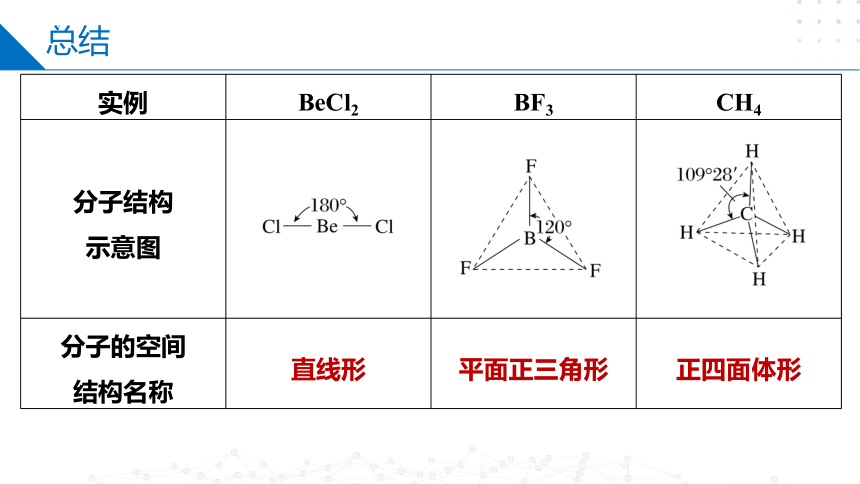
1.分子的空间结构与杂化轨道类型的关系
(1)杂化轨道全部用于形成σ键时
杂化轨道类型 sp sp2 sp3
参与杂化的 原子轨道 一个ns和 一个np轨道 一个ns和 两个np轨道 一个ns和
三个np轨道
轨道夹角 180° 120° 109°28′
杂化轨道 示意图
实例 BeCl2 BF3 CH4
分子结构 示意图
分子的空间 结构名称 直线形 平面正三角形 正四面体形
总结
第二节
Part Two
价层电子对互斥模型和等电子原理
一、价层电子对互斥模型
分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间结构。
内容:分子的空间结构是中心原子的“价电子对”相互排斥的结果。
一
价层电子对互斥(VSEPR models)模型
一、价层电子对互斥模型
ABm型分子的价电子对计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
二
价电子对的计算
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
对于主族元素,等于原子的最外层电子数,如:C为4个,N为5个;
对于阳离子,等于价电子数-离子电荷数,如:NH4+为5-1=4个;
对于阴离子,等于价电子数+|离子电荷数|,如:PO43-为5+3=8个。
一、价层电子对互斥模型
作为配位原子,卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算;
作为中心原子,卤素原子按提供7个价电子计算,氧族原子按提供6个价电子计算;
为与中心原子结合的原子最多能接受的电子数,H为1,
其他原子= 8-该原子的价电子数。 如:O为2、N为3(化合价数)
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
一、价层电子对互斥模型
价电子 对数 σ键电子 对数 孤电子 对数 电子对的 排列方式 价层电子对互斥模型 分子或离 子的空间结构 实例
2 0 2 直线形 直线形 BeCl2、
CO2
根据分子中成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
3 3 0 平面 三角形 平面三 角形 BF3、
BCl3
V形 PbCl2
2 1 一、价层电子对互斥模型
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
4 4 0 四面 体形 正四面 体形 CH4、
CCl4
三角 锥形 NH3
3 1 V形 H2O
2 2 一、价层电子对互斥模型
二、等电子原理
1、等电子体
具有相同价电子数和相同原子数的分子或离子
具有相同的结构特征,性质相近
2、等电子体原理
C O
N N
结构
性质
决定
反映
原子总数 价电子数 空间结构 键能 KJ/mol 熔点℃ 沸点℃ 溶解度
25℃
CO 2 10 直线形 1071.1 -205 -191 2.3ml
N2 2 10 直线形 946 -210 -195 1.6ml
1个σ键和2个π键
典例解析
(1)同族元素互换法:即将既定粒子中的某元素换成它的同族元素。
(2)价电子迁移法:即将既定粒子中的某元素原子的价电子逐一转移给粒子中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
(3)电子电荷互换法:即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷,相应原子的质子数也随之减少或增加。这种方法可实现分子与离子的互换。
等电子体的确定方法
二、等电子原理
常见等电子体
CO N2
2个原子
价电子总数 10
3个原子
价电子总数 16
3个原子
价电子总数 18
4个原子
价电子总数 24
5个原子
价电子总数 32
平面
三角
直线型
V型
CO2 CS2
SO2 O3
SO3 BF3
CCl4 SiF4
CN– NO+ C22–
NO2+ N3–
NO2–
CO32– NO3–
SO42– PO43–
正四面体
核外电子总数不一定相同;
等电子体可以拓展到离子。
等电子原理应用:可以判断一些简单分子或离子的立体结构。
第三节
Part Three
分子的极性和手性分子
一、分子的极性
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
一、分子的极性
②根据所含共价键的类型及分子的空间结构判断
分子类型 键的极性 分子空间结构 分子极性 举例
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
一、分子的极性
分子类型 键的极性 分子空间结构 分子极性 举例
四原子 分子 AB3 极性键 平面三角形 (对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体形 (对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
一、分子的极性
“相似相溶”规则
非极性溶质一般能溶于非极性溶剂,
而极性溶质一般能溶于极性溶剂。
极性分子
蔗糖
硼酸
H2O
萘
碘
CCl4
非极性分子
溶质
溶剂
一、分子的极性
氢键的影响
溶剂与溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
发生化学反应
如果溶质与水能发生化学反应,也会增大溶质的溶解度。如SO2与水发生反应生成H2SO3,而H2SO3可溶于水,因此,SO2的溶解度较大。
二、手性分子
左手和右手互为镜像,但不能相互叠合。
如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能重叠,这对分子互称手性异构体。
有手性异构体的分子称为手性分子。
二、手性分子
当四个不同的原子或基团连接在碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
每个手性碳原子所连接的原子或基团在空间的排布就像左右手关系(或实物与其镜像关系)那样,相似但不能重叠。
手性碳原子
第四节
Part Four
配合物的形成和应用
一、配合物的形成
Cu
NH3
NH3
H3N
NH3
2+
SO4
配体
配位键
配离子
中心离子
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。
2-
硫酸四氨合铜
一、配合物的形成
配位数
[Cu(NH3)4]SO4
配位体
中心原子
外界(离子)
内界(配离子)
硫酸四氨合铜
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
配合物的命名
配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
一、配合物的形成
中心原子
具有空轨道的原子或离子,常是过渡金属的原子或离子。
配位原子
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子。
不一定,有的配合物没有外界。如Fe(CO)5、Fe(SCN)3。有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
思考:配合物一定是由内界和外界组成吗?
一、配合物的形成
配合物的空间结构
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2就有顺式和反式两种异构体。
一、配合物的形成
配位数 杂化轨道类型 空间结构 结构示意图 实例
2 sp 直线形 [Ag(NH3)2]+ [Cu(NH3)2]+
4 sp3 正四面 体形 [Zn(NH3)4]2+ [ZnCl4]2-
sp2d (dsp2) 平面正 方形 [Ni(CN)4]2- [Cu(NH3)4]2+
6 sp3d2 (d2sp3) 正八 面体 [AlF6]3- [Co(NH3)6]3+
二、配合物的应用
配合键的稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
电子对给予体形成配位键的能力:NH3 > H2O
接受体形成配位键的能力:H+ > 过渡金属> 主族金属
配位键越强,配合物越稳定:
Cu2+——OH- < Cu2+——NH3 < H+——NH3
本章小结
分子的空间结构模型——杂化轨道理论
分子的极性和手性分子
不良反应
价层电子对互斥模型和等电子原理
分子的极性
手性分子
价层电子对互斥模型
等电子原理
杂化轨道理论
配合物的形成和应用
配合物的形成
配合物的应用
谢谢观看
THANKS
第四章
分子空间结构与物质性质
授课人:
目录
CONTENTS
第一节
分子的空间结构模型——杂化轨道理论
第二节
价层电子对互斥模型和等电子原理
第三节
分子的极性和手性分子
第四节
配合物的形成和应用
第一节
Part One
分子的空间结构模型——杂化轨道理论
为了解释CH4等分子的空间结构,美国化学家鲍林于1931年提出了杂化轨道理论。
美国化学家鲍林
在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组能量相等、成分相同的新轨道,这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。
一、杂化轨道理论
一、杂化轨道理论
杂化前后的不变与变
不变:原子轨道的数目
变
轨道的成分
轨道的能量
轨道的形状
轨道的方向
更有利于成键:
轨道成键时更有利于轨道间的重叠
满足最小排斥,最大夹角分布
杂化后形成的化学键更稳定
杂化轨道只用于形成σ键和容纳孤电子对
一、杂化轨道理论
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个相同的C-H σ键,呈正四面体形。
甲烷分子中C—H键之间的夹角——键角
都是109°28'。
一、杂化轨道理论
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分每两个轨道间的夹角为120°,呈平面三角形。
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
一、杂化轨道理论
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线形。
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
总结
1.分子的空间结构与杂化轨道类型的关系
(1)杂化轨道全部用于形成σ键时
杂化轨道类型 sp sp2 sp3
参与杂化的 原子轨道 一个ns和 一个np轨道 一个ns和 两个np轨道 一个ns和
三个np轨道
轨道夹角 180° 120° 109°28′
杂化轨道 示意图
实例 BeCl2 BF3 CH4
分子结构 示意图
分子的空间 结构名称 直线形 平面正三角形 正四面体形
总结
第二节
Part Two
价层电子对互斥模型和等电子原理
一、价层电子对互斥模型
分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间结构。
内容:分子的空间结构是中心原子的“价电子对”相互排斥的结果。
一
价层电子对互斥(VSEPR models)模型
一、价层电子对互斥模型
ABm型分子的价电子对计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
二
价电子对的计算
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
对于主族元素,等于原子的最外层电子数,如:C为4个,N为5个;
对于阳离子,等于价电子数-离子电荷数,如:NH4+为5-1=4个;
对于阴离子,等于价电子数+|离子电荷数|,如:PO43-为5+3=8个。
一、价层电子对互斥模型
作为配位原子,卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算;
作为中心原子,卤素原子按提供7个价电子计算,氧族原子按提供6个价电子计算;
为与中心原子结合的原子最多能接受的电子数,H为1,
其他原子= 8-该原子的价电子数。 如:O为2、N为3(化合价数)
2
中心原子的价电子数+每个配位原子提供的价电子数×m
n=
一、价层电子对互斥模型
价电子 对数 σ键电子 对数 孤电子 对数 电子对的 排列方式 价层电子对互斥模型 分子或离 子的空间结构 实例
2 0 2 直线形 直线形 BeCl2、
CO2
根据分子中成键电子对数和孤电子对数,可以确定相应的较稳定的分子空间结构。
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
3 3 0 平面 三角形 平面三 角形 BF3、
BCl3
V形 PbCl2
2 1 一、价层电子对互斥模型
价电子 对数 σ键 电子 对数 孤电子 对数 电子对的 排列方式 价层电 子对互 斥模型 分子或离 子的空间 结构 实例
4 4 0 四面 体形 正四面 体形 CH4、
CCl4
三角 锥形 NH3
3 1 V形 H2O
2 2 一、价层电子对互斥模型
二、等电子原理
1、等电子体
具有相同价电子数和相同原子数的分子或离子
具有相同的结构特征,性质相近
2、等电子体原理
C O
N N
结构
性质
决定
反映
原子总数 价电子数 空间结构 键能 KJ/mol 熔点℃ 沸点℃ 溶解度
25℃
CO 2 10 直线形 1071.1 -205 -191 2.3ml
N2 2 10 直线形 946 -210 -195 1.6ml
1个σ键和2个π键
典例解析
(1)同族元素互换法:即将既定粒子中的某元素换成它的同族元素。
(2)价电子迁移法:即将既定粒子中的某元素原子的价电子逐一转移给粒子中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
(3)电子电荷互换法:即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷,相应原子的质子数也随之减少或增加。这种方法可实现分子与离子的互换。
等电子体的确定方法
二、等电子原理
常见等电子体
CO N2
2个原子
价电子总数 10
3个原子
价电子总数 16
3个原子
价电子总数 18
4个原子
价电子总数 24
5个原子
价电子总数 32
平面
三角
直线型
V型
CO2 CS2
SO2 O3
SO3 BF3
CCl4 SiF4
CN– NO+ C22–
NO2+ N3–
NO2–
CO32– NO3–
SO42– PO43–
正四面体
核外电子总数不一定相同;
等电子体可以拓展到离子。
等电子原理应用:可以判断一些简单分子或离子的立体结构。
第三节
Part Three
分子的极性和手性分子
一、分子的极性
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
一、分子的极性
②根据所含共价键的类型及分子的空间结构判断
分子类型 键的极性 分子空间结构 分子极性 举例
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
一、分子的极性
分子类型 键的极性 分子空间结构 分子极性 举例
四原子 分子 AB3 极性键 平面三角形 (对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体形 (对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
一、分子的极性
“相似相溶”规则
非极性溶质一般能溶于非极性溶剂,
而极性溶质一般能溶于极性溶剂。
极性分子
蔗糖
硼酸
H2O
萘
碘
CCl4
非极性分子
溶质
溶剂
一、分子的极性
氢键的影响
溶剂与溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
发生化学反应
如果溶质与水能发生化学反应,也会增大溶质的溶解度。如SO2与水发生反应生成H2SO3,而H2SO3可溶于水,因此,SO2的溶解度较大。
二、手性分子
左手和右手互为镜像,但不能相互叠合。
如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像(对映异构),在三维空间里不能重叠,这对分子互称手性异构体。
有手性异构体的分子称为手性分子。
二、手性分子
当四个不同的原子或基团连接在碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
每个手性碳原子所连接的原子或基团在空间的排布就像左右手关系(或实物与其镜像关系)那样,相似但不能重叠。
手性碳原子
第四节
Part Four
配合物的形成和应用
一、配合物的形成
Cu
NH3
NH3
H3N
NH3
2+
SO4
配体
配位键
配离子
中心离子
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。
2-
硫酸四氨合铜
一、配合物的形成
配位数
[Cu(NH3)4]SO4
配位体
中心原子
外界(离子)
内界(配离子)
硫酸四氨合铜
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
配合物的命名
配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
一、配合物的形成
中心原子
具有空轨道的原子或离子,常是过渡金属的原子或离子。
配位原子
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子。
不一定,有的配合物没有外界。如Fe(CO)5、Fe(SCN)3。有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
思考:配合物一定是由内界和外界组成吗?
一、配合物的形成
配合物的空间结构
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2就有顺式和反式两种异构体。
一、配合物的形成
配位数 杂化轨道类型 空间结构 结构示意图 实例
2 sp 直线形 [Ag(NH3)2]+ [Cu(NH3)2]+
4 sp3 正四面 体形 [Zn(NH3)4]2+ [ZnCl4]2-
sp2d (dsp2) 平面正 方形 [Ni(CN)4]2- [Cu(NH3)4]2+
6 sp3d2 (d2sp3) 正八 面体 [AlF6]3- [Co(NH3)6]3+
二、配合物的应用
配合键的稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。
电子对给予体形成配位键的能力:NH3 > H2O
接受体形成配位键的能力:H+ > 过渡金属> 主族金属
配位键越强,配合物越稳定:
Cu2+——OH- < Cu2+——NH3 < H+——NH3
本章小结
分子的空间结构模型——杂化轨道理论
分子的极性和手性分子
不良反应
价层电子对互斥模型和等电子原理
分子的极性
手性分子
价层电子对互斥模型
等电子原理
杂化轨道理论
配合物的形成和应用
配合物的形成
配合物的应用
谢谢观看
THANKS
