2024年新高一化学暑假自学课(人教版2019必修第一册)第04讲氧化还原反应的基本概念(含解析)
文档属性
| 名称 | 2024年新高一化学暑假自学课(人教版2019必修第一册)第04讲氧化还原反应的基本概念(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:32:49 | ||
图片预览




文档简介
第04讲 氧化还原反应的基本概念
模块一 思维导图串知识 模块二 基础知识全梳理(吃透教材) 模块三 教材习题学解题 模块四 核心考点精准练(7大考点) 模块五 小试牛刀过关测 (基础练10题) (提升练6题) 1.从化合价变化和电子转移的角度认识并判断氧化还原反应。 2.理解氧化还原反应与四种基本反应类型的关系。 3.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念。 4.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性。
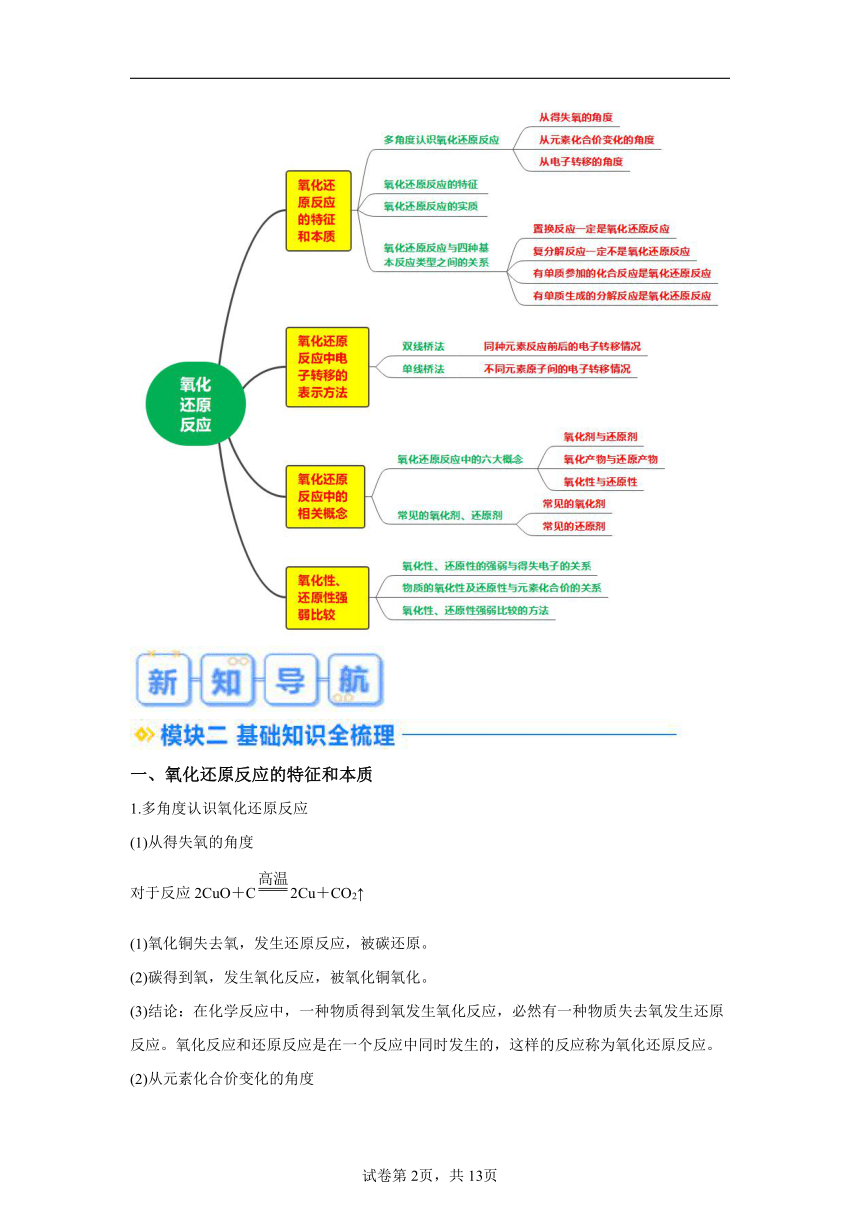
一、氧化还原反应的特征和本质
1.多角度认识氧化还原反应
(1)从得失氧的角度
对于反应2CuO+C2Cu+CO2↑
(1)氧化铜失去氧,发生还原反应,被碳还原。
(2)碳得到氧,发生氧化反应,被氧化铜氧化。
(3)结论:在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
(2)从元素化合价变化的角度
(1)对于有氧得失的反应2CuO+C2Cu+CO2↑
①铜元素化合价降低,发生还原反应。
②碳元素化合价升高,发生氧化反应。
(2)对于无氧得失的反应Fe+CuSO4=FeSO4+Cu
①铜元素化合价降低,发生还原反应。
②铁元素化合价升高,发生氧化反应。
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应。
③氧化还原反应的特征:反应前后有元素化合价的变化(升降)。
(3)从电子转移的角度
(1)从电子得失的角度分析反应:2Na+Cl22NaCl
在有些氧化还原反应中,物质所含元素的原子失去电子,该物质发生氧化反应;得到电子,该物质发生还原反应。
(2)从共用电子对偏移的角度分析反应:H2+Cl22HCl
在有些氧化还原反应中,元素的原子间有共用电子对的偏移(偏离和偏向)。
共用电子对偏离的物质发生氧化反应,共用电子对偏向的物质发生还原反应。
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
③氧化还原反应的本质是电子转移。
2.氧化还原反应的特征
一种或几种元素的化合价发生变化。
3.氧化还原反应的实质
氧化还原反应的实质是电子转移(得失或偏移)。
4.氧化还原反应与四种基本反应类型之间的关系
(1)置换反应一定是氧化还原反应。
(2)复分解反应一定不是氧化还原反应。
(3)有单质参加的化合反应是氧化还原反应。
(4)有单质生成的分解反应是氧化还原反应。
二、氧化还原反应中电子转移的表示方法
1.双线桥法
表明同一种元素反应前后的电子得失(或偏移)情况。
①双线桥法表示电子转移的基本步骤
【易错警示】
a.箭尾、箭头必须指向反应物、生成物中相应的同种元素。
b.采用a×be-形式表示得失电子数,a为得失电子的原子总数,b为每个原子得失电子数,a、b是“1”时省略。得到与失去的电子总数相等。
2.单线桥法
表明反应中化合价变化的元素原子间的电子转移情况。
①单线桥法表示电子转移的基本步骤
【易错警示】
a.单线桥法从反应物中失电子的元素指向反应物中得电子的元素,表示反应物中变价元素原子间电子的转移情况;
b.箭头已标明电子转移的方向,因此不需再标明“得”或“失”,只标明电子转移数目。
三、氧化还原反应中的相关概念
1.氧化还原反应中的六大概念
(1)氧化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
(2)氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
(3)氧化性与还原性
氧化性:物质得电子的性质或能力。
还原性:物质失电子的性质或能力。
【归纳提升】氧化还原反应概念间的关系
记忆口诀:
升→失→氧→氧→氧
降→得→还→还→还
2.常见的氧化剂、还原剂
(1)常见的氧化剂
①活泼的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物
a.某些酸:如浓H2SO4、HNO3、HClO等;
b.某些氧化物、过氧化物:如MnO2、H2O2、Na2O2等;
c.某些盐:如KMnO4、FeCl3、NaClO等。
(2)常见的还原剂
①活泼的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如H2、S、C等。
③变价元素的低价态化合物
a.某些氧化物:如CO、SO2等;
b.某些氢化物:如HCl、H2S等;
c.某些盐:如KI、Na2S、FeCl2等。
【易错警示】
(1)在一个具体的化学反应中氧化剂和还原剂可能是同一物质,被氧化和被还原的也可能是同种元素,氧化产物和还原产物也可能是同一物质。
(2)氧化还原反应中的反应物可能既不是氧化剂也不是还原剂,生成物也可能既不是氧化产物也不是还原产物。
四、氧化性、还原性强弱比较
1.氧化性、还原性的强弱与得失电子的关系
(1)氧化性:物质越易得电子,氧化性越强。
(2)还原性:物质越易失电子,还原性越强。
【易错警示】
物质氧化性、还原性的强弱与得失电子的难易有关,与得失电子的多少无关。
2.物质的氧化性及还原性与元素化合价的关系
核心元素化合价 实例 性质
最高价 KO4、浓HO3、浓H2O4 只有氧化性
中间价 O2、Na2O3、SO4、 既有氧化性又有还原性
最低价 、、K 只有还原性
3.氧化性、还原性强弱比较的方法
(1)根据元素的活动性顺序比较
如:Fe+CuSO4=FeSO4+Cu
金属还原性:Fe>Cu
在反应中Fe是还原剂,Cu是还原产物。
(2)根据氧化还原反应的化学方程式比较
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(3)根据氧化产物的价态高低判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
例如:2Fe+3Cl22FeCl3、Fe+SFeS
Fe被Cl2氧化成+3价,而S只能把其氧化成+2价,故氧化性:Cl2>S;判断还原剂还原性的原理类似。
(4)根据反应条件来判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。如:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
后者比前者更容易发生,故氧化性:KMnO4>MnO2。
教材习题01
1.下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
教材习题02
2.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,它可以根据反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+NaCl+2H2O制备,对于该反应,下列说法正确的是
A.该反应属于置换反应 B.HCl是氧化剂 C.NaClO3是还原剂 D.ClO2是还原产物
核心考点一:氧化还原反应的概念及判断
【例1】
3.下列铜及其化合物的性质实验中,涉及到的反应不属于氧化还原反应的是
A.铜丝在空气中加热 B.用氢气还原氧化铜
C.将铁丝插入溶液中 D.向溶液中滴加NaOH溶液
核心考点二:氧化还原反应与四种基本反应类型的关系
【例2】
4.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
A.2HClO2HCl+O2↑ B.NH4HCO3NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 D.Fe2O3+3CO2Fe+3CO2
核心考点三:氧化还原反应中的电子转移
【例3】
5.下列氧化还原反应中电子转移数目及方向都正确的是
A. B.
C. D.
核心考点四:氧化剂和还原剂等概念的判断
【例4】
6.下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.SO3+H2O=H2SO4
B.3NO2+H2O=2HNO3+NO
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
核心考点五:物质氧化性、还原性的判断
【例5】
7.硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为S2O+4Cl2+5H2O = 2SO+10H++8Cl-,关于该反应的说法正确的是
A.S2O表现氧化性 B.H2O既表现氧化性又表现还原性
C.S2O既表现氧化性又表现还原性 D.Cl2表现氧化性
核心考点六:氧化还原反应的综合考查
【例6】
8.为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成一层致密保护层。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.上述反应涉及的物质中,Fe的还原性最强
B.上述反应涉及的物质中,Na2FeO2的氧化性最强
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.NO的氧化性强于FeO的氧化性
【基础练】
9.下列技术应用中,其工作原理不涉及化学反应的是
A.火药使用 B.用和合成 C.转轮排字 D.用氧化铁冶炼铁
A.A B.B C.C D.D
10.下列化学反应基本类型中一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
11.下列关于氧化还原反应的说法中正确的是
A.得到电子的一定是还原剂
B.氧化还原反应前后可以没有元素化合价发生变化
C.元素化合价升高的反应是氧化反应
D.氧化剂和还原剂一定是不同的物质
12.下列化学反应中,属于化合反应但不属于氧化还原反应的是
A. B.
C. D.
13.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是
A. B.
C. D.
14.下列反应中,只作为氧化剂的是
A. B.
C. D.
15.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
16.自然界中的元素大多以化合态存在,而我们在生产和生活中需要许多单质如金属铁、硅单质等。如果需要把某元素由化合态转变为游离态,则该元素
A.被氧化 B.被还原
C.有可能被氧化,也有可能被还原 D.由高价变为0价
17.下列物质中的硫元素不能表现出氧化性的是
A.S B. C. D.
18.反应在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。在该反应中: 元素的化合价升高,该元素的原子 电子,被 ;在该反应中,Fe2O3发生了 反应, 是还原剂, 是氧化产物, 是还原产物。
【提升练】
19.浩瀚的海洋是一个巨大的宝库,从海水中除了可以提取食盐外,还可以从海水提取食盐后的母液(也称苦卤水,含、等)中提取镁、钾、溴及其他化工产品。从海带灰浸取液提取碘单质发生的反应为。下列有关该反应的说法正确的是
A.发生还原反应 B.是还原产物
C.是氧化剂 D.得到电子
20.下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2Fe+3CO2
D.2KMnO4K2MnO4+МnO2+O2↑
21.下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是
A.与 B.与
C.与盐酸 D.溶液与溶液
22.ClO2是可代替Cl2进行自来水消毒的新一代消毒剂。我国成功研制出制取ClO2的新方法,其反应的微观过程如图所示,下列有关该反应的叙述正确的是
A.该反应属于置换反应
B.该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl
C.NaClO2转化为ClO2的过程是还原反应
D.Cl2既是氧化剂又是还原剂
23.已知:①;②。则下列判断正确的是
A.在反应②中只表现出还原性
B.氧化性强弱:
C.只有氧化性,只有还原性
D.用双线桥法表示反应②电子得失情况:
24.氧化还原反应在物质的制备和转化中有重要的应用。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。写出该反应的化学方程式: 。
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液。生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为 。
②该反应中氧化剂为 (填化学式,下同),还原剂为 。
③用双线桥法表示该反应中电子转移的方向和数目: 。
④产生CO2的离子方程式为 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.B
【分析】化合价升降为氧化还原反应的特征,则若反应中存在元素化台价变化的反应为氧化还原反应,以此进行判断。
【详解】A.炸药爆炸中涉及的反应中有元素化合价的变化,反应属于氧化还原反应,A错误;
B.吹尽狂沙始到金,是根据物质的密度大小分离混合物,为物理变化,不涉及氧化还原反应,B正确;
C.野火烧不尽,存在物质燃烧反应,燃烧反应有元素化合价的变化,反应一定属于氧化还原反应,C错误;
D.蜡烛主要成分是石蜡,蜡炬成灰泪始干,存在石蜡的燃烧现象,燃烧反应属于氧化还原反应,D错误;
故合理选项是B。
2.D
【详解】A.反应物中没有单质参加反应,则该反应不是置换反应,故A错误;
B.HCl中Cl元素的化合价升高,则HCl是还原剂,故B错误;
C.NaClO3中Cl元素的化合价降低,则NaClO3是氧化剂,故C错误;
D.NaClO3中Cl元素的化合价由+5价降低为+4价,在反应中得电子被还原,则ClO2是还原产物,故D正确;
故选:D。
3.D
【详解】A.铜丝在空气中加热反应生成氧化铜,反应前后元素有化合价的变化,属于氧化还原反应,故A不合题意;
B.用氢气还原氧化铜发生的反应为加热条件下氢气与氧化铜反应生成铜和水,反应前后元素有化合价的变化,属于氧化还原反应,故B不合题意;
C.将铁丝插入硫酸铜溶液中发生的反应为铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应前后元素有化合价的变化,属于氧化还原反应,故C不合题意;
D.向硫酸铜溶液中滴加氢氧化钠溶液发生的反应为硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,反应前后元素没有化合价的变化,不属于氧化还原反应,故D合题意;
故选D。
4.D
【详解】A.2HClO2HCl+O2↑,有化合价升降,是氧化还原反应,但是分解反应,故A不符合题意;
B.NH4HCO3NH3↑+H2O+CO2↑,没有化合价升降,故B不符合题意;
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3,有化合价升降,是氧化还原反应,但是化合反应,故C不符合题意;
D.Fe2O3+3CO2Fe+3CO2,有化合价升降,是氧化还原反应,不属于置换反应、化合反应、分解反应,故D符合题意。
综上所述,答案为D。
5.B
【详解】A.氧元素的化合价升高总数=[0-(-2)]×2×3=12或氯元素的化合价降低总数=[(+5)-(-1)]×2=12,则转移电子数为12,不是6,A错误;
B.碘元素的化合价升高总数=[0-(-1)]×2=2或铁元素的化合价降低总数=[(+3)-(+2)]×2=2,则转移电子数为2,B正确;
C.氧元素的化合价升高总数=[0-(-2)]×2=4或氟元素的化合价降低总数=[0-(-1)]×2×2=4,则转移电子数为4,但转移电子的方向为从氧到氟,而不是从氟到氧,C错误;
D.硫元素的化合价升高总数=[(+6)-(+4)]×1=2或溴元素的化合价降低总数=[0-(-1)]×2=2,则转移电子数为2,但转移电子的方向是从硫到溴,而不是从溴到硫,D错误;
答案选B。
6.B
【详解】A、该反应不是氧化还原反应,A不符合题意;
B、该反应是氧化还原反应,且只有N的化合价发生改变,H2O中的元素化合价没有发生改变,水既不作氧化剂又不作还原剂,B符合题意;
C、该反应是氧化还原反应,且水中氧元素的化合价升高了,H2O做还原剂,C不符合题意;
D、该反应是氧化还原反应,且H2O的H的化合价降低,H2O做氧化剂,D不符合题意;
故选B。
7.D
【详解】A.S2O中S元素化合价升高,S2O表现还原性,故A错误;
B.H2O中元素化合价不变,既不表现氧化性又不表现还原性,故B错误;
C.S2O中S元素化合价升高,S2O表现还原性,故C错误;
D.Cl2中Cl元素化合价降低,Cl2表现氧化性,故D正确;
选D。
8.BC
【详解】A.该步反应中,氮元素化合价由+3降至-3,NaNO2是氧化剂;铁元素化合价由0价升至+2价,Fe作还原剂,Fe的还原性最强,故A正确;
B.N元素从NaNO2中的+3价变为NH3中的-3价,则NaNO2为氧化剂,所以上述反应涉及到的物质中,NaNO2的氧化性最强,故B错误;
C.该反应中,Fe作还原剂,NaNO2是氧化剂,NaOH中元素化合价不变,既不是氧化剂也不是还原剂,故C错误;
D.该反应中,NaNO2是氧化剂,Na2FeO2是氧化产物,所以的氧化性强于的氧化性,故D正确;
故选BC。
9.C
【详解】A.火药使用中发生氧化还原反应,涉及到化学反应,A不符合题意;
B.氮气与氢气在一定条件下发生化合反应合成,B不符合题意;
C.转轮排字属于物理变化,C符合题意;
D.用氧化铁冶炼铁发生氧化还原反应,涉及到化学反应,D不符合题意;
故答案为:C。
10.D
【详解】凡有元素化合价升降或变化的化学反应就是氧化还原反应,在四大基本类型的反应中,只有置换反应一定有化合价变化,所以置换反应一定是氧化还原反应,故选D。
11.C
【详解】A.氧化还原反应中,得到电子的为氧化剂,失去电子的为还原剂,A错误;
B.氧化还原反应的宏观特征为元素化合价发生变化,B错误;
C.氧化还原反应中,元素化合价升高的为氧化反应,化合价降低的为还原反应,C正确;
D.氧化剂和还原剂未必一定不同,如水的分解反应,氧化剂与还原剂均为,D错误;
故答案为:C。
12.B
【详解】A.属于化合反应且有化合价的变化,属于氧化还原反应,A错误;
B.属于化合反应但没有化合价的变化,不属于氧化还原反应,B正确;
C.属于分解反应且属于氧化还原反应,C错误;
D.不属于化合反应但属于氧化还原反应,D错误。
故选B。
13.D
【详解】A.Cl2+2KBr=Br2+2KCl是置换反应,属于氧化还原反应,属于区域4,A不符合题意;
B.是复分解反应,不是氧化还原反应,B不符合题意;
C.是化合反应,属于氧化还原反应,属于区域1,C不符合题意;
D.不属于四大基本反应类型,属于氧化还原反应,属于区域3,D符合题意;
故选D。
14.D
【详解】A.F元素的化合价降低,水中上元素的化合价升高,水为还原剂,A错误;
B.只有Cl元素的化合价变化,水既不是氧化剂也不是还原剂,B错误;
C.没有元素的化合价变化,不是氧化还原反应,C错误;
D.Na元素的化合价升高,水中H元素的化合价降低,水为氧化剂,D正确;
故选D。
15.B
【详解】A.转移的电子数目应该是12,选项A错误;
B.得失电子的数目是4,Mg元素失去电子,氧元素得到电子,选项B正确;
C.Cu元素得到电子,C元素失去电子,选项C中得失电子标反了,选项C错误;
D.得失电子的数目不相等,选项D错误;
答案选B。
16.C
【详解】这里的“某元素”可能是金属元素,也可能是非金属元素.金属元素在化合物里都显正价,非金属元素在化合物里既可能显正价又可能显负价。因此,元素由化合态转变为游离态(元素的单质),既有可能由正价变为零价,被还原,又有可能由负价变为零价,被氧化;
故答案选C。
17.B
【详解】A.在单质S中元素化合价为0价,可以得到电子变为-2价,也可以失去电子变为+4、+6价,因此S既表现氧化性,又表现还原性,A不符合题意;
B.在K2S中S为-2价,是S元素的最低化合价,只能失去电子变为较高价态,因此只有还原性,而没有氧化性,B符合题意;
C.在SO2中S为+4价,介于S元素的最低-2价和最高+6价之间,既可以得到电子变为低价态,也可以失去电子变为高价态,因此SO2既可表现氧化性,又可表现还原性,C不符合题意
D.在H2SO4中S元素化合价为+6价,是S元素的最高化合价,只能得到电子变为低价态,因此只有氧化性,而不具有还原性,D不符合题意;
故选B。
18. Al(铝) 失去 氧化 还原 Al Al2O3 Fe
【详解】该反应是置换反应,在该反应中,铝元素的化合价由0价升到+3价,失去电子,被氧化,发生氧化反应,铝为还原剂,对应的产物氧化铝为氧化产物;氧化铁中的铁元素化合价由+3价降到0价,得到电子,被还原,发生还原反应,氧化铁为氧化剂,对应的产物氧化铁为还原产物。
19.D
【分析】反应中I元素化合价由-1价升高到0价,失去电子发生氧化反应,KI为还原剂,I2为氧化产物;H2O2中O元素化合价由-1价降低到-2价,得到电子发生还原反应,H2O2为氧化剂,H2O为还原产物,据此判断:
【详解】A.KI发生氧化反应,A错误;
B.K2SO4既不是氧化产物又不是还原产物,B错误;
C.H2SO4既不是氧化剂又不是还原剂,C错误;
D.H2O2中O元素化合价由-1价降低到-2价,得到电子发生还原反应,D正确;
故选D。
20.C
【详解】A.属于置换反应,属于氧化还原反应,A错误;
B.属于复分解反应,不属于氧化还原反应,B错误;
C.不属于四种基本反应类型,但Fe、C元素化合价发生变化,属于氧化还原反应,C正确;
D.属于有单质生成的分解反应,属于氧化还原反应,D错误;
故选C。
21.B
【详解】A.与反应生成三氯化铁是氧化还原反应,但不是离子反应,A错误;
B.与是氧化还原反应,2Na+2H2O═2Na+ +2OH- +H2↑,也是离子反应,B正确;
C.与盐酸反应生成氯化铁与水,元素化合价没有发生改变,是非氧化还原反应,C错误;
D.NaCl溶液与AgNO3生成硝酸钠和氯化银沉淀,元素化合价没有发生改变,是非氧化还原反应,D错误;
故选B。
22.B
【详解】A.置换反应是指单质与化合物反应生成另一种单质和另一种化合物,而此反应生成物中不含有单质,故此反应不是置换反应,是氧化还原反应,A错误;
B.根据分析可知该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl,B正确;
C.NaClO2转化为ClO2的反应中Cl的化合价由+3价升高为+4价,是氧化反应,C错误;
D.该反应中Cl2中Cl元素化合价由0价降低为-1价,故Cl2为氧化剂,发生得电子的还原反应,D错误;
故选B。
23.B
【详解】A.反应中有5个HCl的Cl由-1价升高为0价,作还原剂,表现还原性,有1个HCl的Cl化合价不变,表现酸性,A错误;
B.氧化剂的氧化性大于氧化产物,反应中Cl2作氧化剂,Fe3+作氧化产物,则氧化性Cl2> FeCl3,反应中KClO3作氧化剂,Cl2作氧化产物,则氧化性KClO3>Cl2,综上氧化性强弱:,B正确;
C.是Fe元素的最高价态,只有氧化性,是Fe元素的中间价态,既有氧化性又有还原性,C错误;
D.氧化还原反应中同种元素遵循只靠拢不交叉的原则,根据得失电子守恒,该反应用双线桥法表示电子得失情况为,D错误;
答案选B。
24.(1)
(2) NaClO2 NaClO2
【详解】(1)I2与KOH溶液共热生成KIO3、H2O和另一种化合物,I的化合价由0价升至+5价,根据氧化还原反应的规律,另一种化合物为KI,根据得失电子守恒和原子守恒,反应的化学方程式为;
(2)①NaClO2、NaHSO4、NaCl、Na2SO4要改成离子形式,ClO2、H2O以化学式保留,由化学方程式5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O可知,反应的离子方程式为;
②NaClO2中部分Cl元素化合价由+3升至ClO2中+4、部分Cl元素化合价由+3降至NaCl中-1,该反应中氧化剂为NaClO2,还原剂为NaClO2;
③NaClO2中部分Cl元素化合价由+3升至ClO2中+4、部分Cl元素化合价由+3降至NaCl中-1,用双线桥法表示该反应中电子转移的方向和数目为。
④NaHSO4与NaHCO3反应生成硫酸钠、二氧化碳、水,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
模块一 思维导图串知识 模块二 基础知识全梳理(吃透教材) 模块三 教材习题学解题 模块四 核心考点精准练(7大考点) 模块五 小试牛刀过关测 (基础练10题) (提升练6题) 1.从化合价变化和电子转移的角度认识并判断氧化还原反应。 2.理解氧化还原反应与四种基本反应类型的关系。 3.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念。 4.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性。
一、氧化还原反应的特征和本质
1.多角度认识氧化还原反应
(1)从得失氧的角度
对于反应2CuO+C2Cu+CO2↑
(1)氧化铜失去氧,发生还原反应,被碳还原。
(2)碳得到氧,发生氧化反应,被氧化铜氧化。
(3)结论:在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
(2)从元素化合价变化的角度
(1)对于有氧得失的反应2CuO+C2Cu+CO2↑
①铜元素化合价降低,发生还原反应。
②碳元素化合价升高,发生氧化反应。
(2)对于无氧得失的反应Fe+CuSO4=FeSO4+Cu
①铜元素化合价降低,发生还原反应。
②铁元素化合价升高,发生氧化反应。
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应。
③氧化还原反应的特征:反应前后有元素化合价的变化(升降)。
(3)从电子转移的角度
(1)从电子得失的角度分析反应:2Na+Cl22NaCl
在有些氧化还原反应中,物质所含元素的原子失去电子,该物质发生氧化反应;得到电子,该物质发生还原反应。
(2)从共用电子对偏移的角度分析反应:H2+Cl22HCl
在有些氧化还原反应中,元素的原子间有共用电子对的偏移(偏离和偏向)。
共用电子对偏离的物质发生氧化反应,共用电子对偏向的物质发生还原反应。
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
③氧化还原反应的本质是电子转移。
2.氧化还原反应的特征
一种或几种元素的化合价发生变化。
3.氧化还原反应的实质
氧化还原反应的实质是电子转移(得失或偏移)。
4.氧化还原反应与四种基本反应类型之间的关系
(1)置换反应一定是氧化还原反应。
(2)复分解反应一定不是氧化还原反应。
(3)有单质参加的化合反应是氧化还原反应。
(4)有单质生成的分解反应是氧化还原反应。
二、氧化还原反应中电子转移的表示方法
1.双线桥法
表明同一种元素反应前后的电子得失(或偏移)情况。
①双线桥法表示电子转移的基本步骤
【易错警示】
a.箭尾、箭头必须指向反应物、生成物中相应的同种元素。
b.采用a×be-形式表示得失电子数,a为得失电子的原子总数,b为每个原子得失电子数,a、b是“1”时省略。得到与失去的电子总数相等。
2.单线桥法
表明反应中化合价变化的元素原子间的电子转移情况。
①单线桥法表示电子转移的基本步骤
【易错警示】
a.单线桥法从反应物中失电子的元素指向反应物中得电子的元素,表示反应物中变价元素原子间电子的转移情况;
b.箭头已标明电子转移的方向,因此不需再标明“得”或“失”,只标明电子转移数目。
三、氧化还原反应中的相关概念
1.氧化还原反应中的六大概念
(1)氧化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
(2)氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
(3)氧化性与还原性
氧化性:物质得电子的性质或能力。
还原性:物质失电子的性质或能力。
【归纳提升】氧化还原反应概念间的关系
记忆口诀:
升→失→氧→氧→氧
降→得→还→还→还
2.常见的氧化剂、还原剂
(1)常见的氧化剂
①活泼的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物
a.某些酸:如浓H2SO4、HNO3、HClO等;
b.某些氧化物、过氧化物:如MnO2、H2O2、Na2O2等;
c.某些盐:如KMnO4、FeCl3、NaClO等。
(2)常见的还原剂
①活泼的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如H2、S、C等。
③变价元素的低价态化合物
a.某些氧化物:如CO、SO2等;
b.某些氢化物:如HCl、H2S等;
c.某些盐:如KI、Na2S、FeCl2等。
【易错警示】
(1)在一个具体的化学反应中氧化剂和还原剂可能是同一物质,被氧化和被还原的也可能是同种元素,氧化产物和还原产物也可能是同一物质。
(2)氧化还原反应中的反应物可能既不是氧化剂也不是还原剂,生成物也可能既不是氧化产物也不是还原产物。
四、氧化性、还原性强弱比较
1.氧化性、还原性的强弱与得失电子的关系
(1)氧化性:物质越易得电子,氧化性越强。
(2)还原性:物质越易失电子,还原性越强。
【易错警示】
物质氧化性、还原性的强弱与得失电子的难易有关,与得失电子的多少无关。
2.物质的氧化性及还原性与元素化合价的关系
核心元素化合价 实例 性质
最高价 KO4、浓HO3、浓H2O4 只有氧化性
中间价 O2、Na2O3、SO4、 既有氧化性又有还原性
最低价 、、K 只有还原性
3.氧化性、还原性强弱比较的方法
(1)根据元素的活动性顺序比较
如:Fe+CuSO4=FeSO4+Cu
金属还原性:Fe>Cu
在反应中Fe是还原剂,Cu是还原产物。
(2)根据氧化还原反应的化学方程式比较
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(3)根据氧化产物的价态高低判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
例如:2Fe+3Cl22FeCl3、Fe+SFeS
Fe被Cl2氧化成+3价,而S只能把其氧化成+2价,故氧化性:Cl2>S;判断还原剂还原性的原理类似。
(4)根据反应条件来判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。如:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
后者比前者更容易发生,故氧化性:KMnO4>MnO2。
教材习题01
1.下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
教材习题02
2.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,它可以根据反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+NaCl+2H2O制备,对于该反应,下列说法正确的是
A.该反应属于置换反应 B.HCl是氧化剂 C.NaClO3是还原剂 D.ClO2是还原产物
核心考点一:氧化还原反应的概念及判断
【例1】
3.下列铜及其化合物的性质实验中,涉及到的反应不属于氧化还原反应的是
A.铜丝在空气中加热 B.用氢气还原氧化铜
C.将铁丝插入溶液中 D.向溶液中滴加NaOH溶液
核心考点二:氧化还原反应与四种基本反应类型的关系
【例2】
4.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影3区域的是
A.2HClO2HCl+O2↑ B.NH4HCO3NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 D.Fe2O3+3CO2Fe+3CO2
核心考点三:氧化还原反应中的电子转移
【例3】
5.下列氧化还原反应中电子转移数目及方向都正确的是
A. B.
C. D.
核心考点四:氧化剂和还原剂等概念的判断
【例4】
6.下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.SO3+H2O=H2SO4
B.3NO2+H2O=2HNO3+NO
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
核心考点五:物质氧化性、还原性的判断
【例5】
7.硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为S2O+4Cl2+5H2O = 2SO+10H++8Cl-,关于该反应的说法正确的是
A.S2O表现氧化性 B.H2O既表现氧化性又表现还原性
C.S2O既表现氧化性又表现还原性 D.Cl2表现氧化性
核心考点六:氧化还原反应的综合考查
【例6】
8.为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成一层致密保护层。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.上述反应涉及的物质中,Fe的还原性最强
B.上述反应涉及的物质中,Na2FeO2的氧化性最强
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.NO的氧化性强于FeO的氧化性
【基础练】
9.下列技术应用中,其工作原理不涉及化学反应的是
A.火药使用 B.用和合成 C.转轮排字 D.用氧化铁冶炼铁
A.A B.B C.C D.D
10.下列化学反应基本类型中一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
11.下列关于氧化还原反应的说法中正确的是
A.得到电子的一定是还原剂
B.氧化还原反应前后可以没有元素化合价发生变化
C.元素化合价升高的反应是氧化反应
D.氧化剂和还原剂一定是不同的物质
12.下列化学反应中,属于化合反应但不属于氧化还原反应的是
A. B.
C. D.
13.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是
A. B.
C. D.
14.下列反应中,只作为氧化剂的是
A. B.
C. D.
15.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
16.自然界中的元素大多以化合态存在,而我们在生产和生活中需要许多单质如金属铁、硅单质等。如果需要把某元素由化合态转变为游离态,则该元素
A.被氧化 B.被还原
C.有可能被氧化,也有可能被还原 D.由高价变为0价
17.下列物质中的硫元素不能表现出氧化性的是
A.S B. C. D.
18.反应在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。在该反应中: 元素的化合价升高,该元素的原子 电子,被 ;在该反应中,Fe2O3发生了 反应, 是还原剂, 是氧化产物, 是还原产物。
【提升练】
19.浩瀚的海洋是一个巨大的宝库,从海水中除了可以提取食盐外,还可以从海水提取食盐后的母液(也称苦卤水,含、等)中提取镁、钾、溴及其他化工产品。从海带灰浸取液提取碘单质发生的反应为。下列有关该反应的说法正确的是
A.发生还原反应 B.是还原产物
C.是氧化剂 D.得到电子
20.下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2Fe+3CO2
D.2KMnO4K2MnO4+МnO2+O2↑
21.下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是
A.与 B.与
C.与盐酸 D.溶液与溶液
22.ClO2是可代替Cl2进行自来水消毒的新一代消毒剂。我国成功研制出制取ClO2的新方法,其反应的微观过程如图所示,下列有关该反应的叙述正确的是
A.该反应属于置换反应
B.该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl
C.NaClO2转化为ClO2的过程是还原反应
D.Cl2既是氧化剂又是还原剂
23.已知:①;②。则下列判断正确的是
A.在反应②中只表现出还原性
B.氧化性强弱:
C.只有氧化性,只有还原性
D.用双线桥法表示反应②电子得失情况:
24.氧化还原反应在物质的制备和转化中有重要的应用。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。写出该反应的化学方程式: 。
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液。生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为 。
②该反应中氧化剂为 (填化学式,下同),还原剂为 。
③用双线桥法表示该反应中电子转移的方向和数目: 。
④产生CO2的离子方程式为 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.B
【分析】化合价升降为氧化还原反应的特征,则若反应中存在元素化台价变化的反应为氧化还原反应,以此进行判断。
【详解】A.炸药爆炸中涉及的反应中有元素化合价的变化,反应属于氧化还原反应,A错误;
B.吹尽狂沙始到金,是根据物质的密度大小分离混合物,为物理变化,不涉及氧化还原反应,B正确;
C.野火烧不尽,存在物质燃烧反应,燃烧反应有元素化合价的变化,反应一定属于氧化还原反应,C错误;
D.蜡烛主要成分是石蜡,蜡炬成灰泪始干,存在石蜡的燃烧现象,燃烧反应属于氧化还原反应,D错误;
故合理选项是B。
2.D
【详解】A.反应物中没有单质参加反应,则该反应不是置换反应,故A错误;
B.HCl中Cl元素的化合价升高,则HCl是还原剂,故B错误;
C.NaClO3中Cl元素的化合价降低,则NaClO3是氧化剂,故C错误;
D.NaClO3中Cl元素的化合价由+5价降低为+4价,在反应中得电子被还原,则ClO2是还原产物,故D正确;
故选:D。
3.D
【详解】A.铜丝在空气中加热反应生成氧化铜,反应前后元素有化合价的变化,属于氧化还原反应,故A不合题意;
B.用氢气还原氧化铜发生的反应为加热条件下氢气与氧化铜反应生成铜和水,反应前后元素有化合价的变化,属于氧化还原反应,故B不合题意;
C.将铁丝插入硫酸铜溶液中发生的反应为铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应前后元素有化合价的变化,属于氧化还原反应,故C不合题意;
D.向硫酸铜溶液中滴加氢氧化钠溶液发生的反应为硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,反应前后元素没有化合价的变化,不属于氧化还原反应,故D合题意;
故选D。
4.D
【详解】A.2HClO2HCl+O2↑,有化合价升降,是氧化还原反应,但是分解反应,故A不符合题意;
B.NH4HCO3NH3↑+H2O+CO2↑,没有化合价升降,故B不符合题意;
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3,有化合价升降,是氧化还原反应,但是化合反应,故C不符合题意;
D.Fe2O3+3CO2Fe+3CO2,有化合价升降,是氧化还原反应,不属于置换反应、化合反应、分解反应,故D符合题意。
综上所述,答案为D。
5.B
【详解】A.氧元素的化合价升高总数=[0-(-2)]×2×3=12或氯元素的化合价降低总数=[(+5)-(-1)]×2=12,则转移电子数为12,不是6,A错误;
B.碘元素的化合价升高总数=[0-(-1)]×2=2或铁元素的化合价降低总数=[(+3)-(+2)]×2=2,则转移电子数为2,B正确;
C.氧元素的化合价升高总数=[0-(-2)]×2=4或氟元素的化合价降低总数=[0-(-1)]×2×2=4,则转移电子数为4,但转移电子的方向为从氧到氟,而不是从氟到氧,C错误;
D.硫元素的化合价升高总数=[(+6)-(+4)]×1=2或溴元素的化合价降低总数=[0-(-1)]×2=2,则转移电子数为2,但转移电子的方向是从硫到溴,而不是从溴到硫,D错误;
答案选B。
6.B
【详解】A、该反应不是氧化还原反应,A不符合题意;
B、该反应是氧化还原反应,且只有N的化合价发生改变,H2O中的元素化合价没有发生改变,水既不作氧化剂又不作还原剂,B符合题意;
C、该反应是氧化还原反应,且水中氧元素的化合价升高了,H2O做还原剂,C不符合题意;
D、该反应是氧化还原反应,且H2O的H的化合价降低,H2O做氧化剂,D不符合题意;
故选B。
7.D
【详解】A.S2O中S元素化合价升高,S2O表现还原性,故A错误;
B.H2O中元素化合价不变,既不表现氧化性又不表现还原性,故B错误;
C.S2O中S元素化合价升高,S2O表现还原性,故C错误;
D.Cl2中Cl元素化合价降低,Cl2表现氧化性,故D正确;
选D。
8.BC
【详解】A.该步反应中,氮元素化合价由+3降至-3,NaNO2是氧化剂;铁元素化合价由0价升至+2价,Fe作还原剂,Fe的还原性最强,故A正确;
B.N元素从NaNO2中的+3价变为NH3中的-3价,则NaNO2为氧化剂,所以上述反应涉及到的物质中,NaNO2的氧化性最强,故B错误;
C.该反应中,Fe作还原剂,NaNO2是氧化剂,NaOH中元素化合价不变,既不是氧化剂也不是还原剂,故C错误;
D.该反应中,NaNO2是氧化剂,Na2FeO2是氧化产物,所以的氧化性强于的氧化性,故D正确;
故选BC。
9.C
【详解】A.火药使用中发生氧化还原反应,涉及到化学反应,A不符合题意;
B.氮气与氢气在一定条件下发生化合反应合成,B不符合题意;
C.转轮排字属于物理变化,C符合题意;
D.用氧化铁冶炼铁发生氧化还原反应,涉及到化学反应,D不符合题意;
故答案为:C。
10.D
【详解】凡有元素化合价升降或变化的化学反应就是氧化还原反应,在四大基本类型的反应中,只有置换反应一定有化合价变化,所以置换反应一定是氧化还原反应,故选D。
11.C
【详解】A.氧化还原反应中,得到电子的为氧化剂,失去电子的为还原剂,A错误;
B.氧化还原反应的宏观特征为元素化合价发生变化,B错误;
C.氧化还原反应中,元素化合价升高的为氧化反应,化合价降低的为还原反应,C正确;
D.氧化剂和还原剂未必一定不同,如水的分解反应,氧化剂与还原剂均为,D错误;
故答案为:C。
12.B
【详解】A.属于化合反应且有化合价的变化,属于氧化还原反应,A错误;
B.属于化合反应但没有化合价的变化,不属于氧化还原反应,B正确;
C.属于分解反应且属于氧化还原反应,C错误;
D.不属于化合反应但属于氧化还原反应,D错误。
故选B。
13.D
【详解】A.Cl2+2KBr=Br2+2KCl是置换反应,属于氧化还原反应,属于区域4,A不符合题意;
B.是复分解反应,不是氧化还原反应,B不符合题意;
C.是化合反应,属于氧化还原反应,属于区域1,C不符合题意;
D.不属于四大基本反应类型,属于氧化还原反应,属于区域3,D符合题意;
故选D。
14.D
【详解】A.F元素的化合价降低,水中上元素的化合价升高,水为还原剂,A错误;
B.只有Cl元素的化合价变化,水既不是氧化剂也不是还原剂,B错误;
C.没有元素的化合价变化,不是氧化还原反应,C错误;
D.Na元素的化合价升高,水中H元素的化合价降低,水为氧化剂,D正确;
故选D。
15.B
【详解】A.转移的电子数目应该是12,选项A错误;
B.得失电子的数目是4,Mg元素失去电子,氧元素得到电子,选项B正确;
C.Cu元素得到电子,C元素失去电子,选项C中得失电子标反了,选项C错误;
D.得失电子的数目不相等,选项D错误;
答案选B。
16.C
【详解】这里的“某元素”可能是金属元素,也可能是非金属元素.金属元素在化合物里都显正价,非金属元素在化合物里既可能显正价又可能显负价。因此,元素由化合态转变为游离态(元素的单质),既有可能由正价变为零价,被还原,又有可能由负价变为零价,被氧化;
故答案选C。
17.B
【详解】A.在单质S中元素化合价为0价,可以得到电子变为-2价,也可以失去电子变为+4、+6价,因此S既表现氧化性,又表现还原性,A不符合题意;
B.在K2S中S为-2价,是S元素的最低化合价,只能失去电子变为较高价态,因此只有还原性,而没有氧化性,B符合题意;
C.在SO2中S为+4价,介于S元素的最低-2价和最高+6价之间,既可以得到电子变为低价态,也可以失去电子变为高价态,因此SO2既可表现氧化性,又可表现还原性,C不符合题意
D.在H2SO4中S元素化合价为+6价,是S元素的最高化合价,只能得到电子变为低价态,因此只有氧化性,而不具有还原性,D不符合题意;
故选B。
18. Al(铝) 失去 氧化 还原 Al Al2O3 Fe
【详解】该反应是置换反应,在该反应中,铝元素的化合价由0价升到+3价,失去电子,被氧化,发生氧化反应,铝为还原剂,对应的产物氧化铝为氧化产物;氧化铁中的铁元素化合价由+3价降到0价,得到电子,被还原,发生还原反应,氧化铁为氧化剂,对应的产物氧化铁为还原产物。
19.D
【分析】反应中I元素化合价由-1价升高到0价,失去电子发生氧化反应,KI为还原剂,I2为氧化产物;H2O2中O元素化合价由-1价降低到-2价,得到电子发生还原反应,H2O2为氧化剂,H2O为还原产物,据此判断:
【详解】A.KI发生氧化反应,A错误;
B.K2SO4既不是氧化产物又不是还原产物,B错误;
C.H2SO4既不是氧化剂又不是还原剂,C错误;
D.H2O2中O元素化合价由-1价降低到-2价,得到电子发生还原反应,D正确;
故选D。
20.C
【详解】A.属于置换反应,属于氧化还原反应,A错误;
B.属于复分解反应,不属于氧化还原反应,B错误;
C.不属于四种基本反应类型,但Fe、C元素化合价发生变化,属于氧化还原反应,C正确;
D.属于有单质生成的分解反应,属于氧化还原反应,D错误;
故选C。
21.B
【详解】A.与反应生成三氯化铁是氧化还原反应,但不是离子反应,A错误;
B.与是氧化还原反应,2Na+2H2O═2Na+ +2OH- +H2↑,也是离子反应,B正确;
C.与盐酸反应生成氯化铁与水,元素化合价没有发生改变,是非氧化还原反应,C错误;
D.NaCl溶液与AgNO3生成硝酸钠和氯化银沉淀,元素化合价没有发生改变,是非氧化还原反应,D错误;
故选B。
22.B
【详解】A.置换反应是指单质与化合物反应生成另一种单质和另一种化合物,而此反应生成物中不含有单质,故此反应不是置换反应,是氧化还原反应,A错误;
B.根据分析可知该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl,B正确;
C.NaClO2转化为ClO2的反应中Cl的化合价由+3价升高为+4价,是氧化反应,C错误;
D.该反应中Cl2中Cl元素化合价由0价降低为-1价,故Cl2为氧化剂,发生得电子的还原反应,D错误;
故选B。
23.B
【详解】A.反应中有5个HCl的Cl由-1价升高为0价,作还原剂,表现还原性,有1个HCl的Cl化合价不变,表现酸性,A错误;
B.氧化剂的氧化性大于氧化产物,反应中Cl2作氧化剂,Fe3+作氧化产物,则氧化性Cl2> FeCl3,反应中KClO3作氧化剂,Cl2作氧化产物,则氧化性KClO3>Cl2,综上氧化性强弱:,B正确;
C.是Fe元素的最高价态,只有氧化性,是Fe元素的中间价态,既有氧化性又有还原性,C错误;
D.氧化还原反应中同种元素遵循只靠拢不交叉的原则,根据得失电子守恒,该反应用双线桥法表示电子得失情况为,D错误;
答案选B。
24.(1)
(2) NaClO2 NaClO2
【详解】(1)I2与KOH溶液共热生成KIO3、H2O和另一种化合物,I的化合价由0价升至+5价,根据氧化还原反应的规律,另一种化合物为KI,根据得失电子守恒和原子守恒,反应的化学方程式为;
(2)①NaClO2、NaHSO4、NaCl、Na2SO4要改成离子形式,ClO2、H2O以化学式保留,由化学方程式5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O可知,反应的离子方程式为;
②NaClO2中部分Cl元素化合价由+3升至ClO2中+4、部分Cl元素化合价由+3降至NaCl中-1,该反应中氧化剂为NaClO2,还原剂为NaClO2;
③NaClO2中部分Cl元素化合价由+3升至ClO2中+4、部分Cl元素化合价由+3降至NaCl中-1,用双线桥法表示该反应中电子转移的方向和数目为。
④NaHSO4与NaHCO3反应生成硫酸钠、二氧化碳、水,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
