2024年新高一化学暑假自学课(人教版2019必修第一册)第16讲常见的合金及应用(含解析)
文档属性
| 名称 | 2024年新高一化学暑假自学课(人教版2019必修第一册)第16讲常见的合金及应用(含解析) | 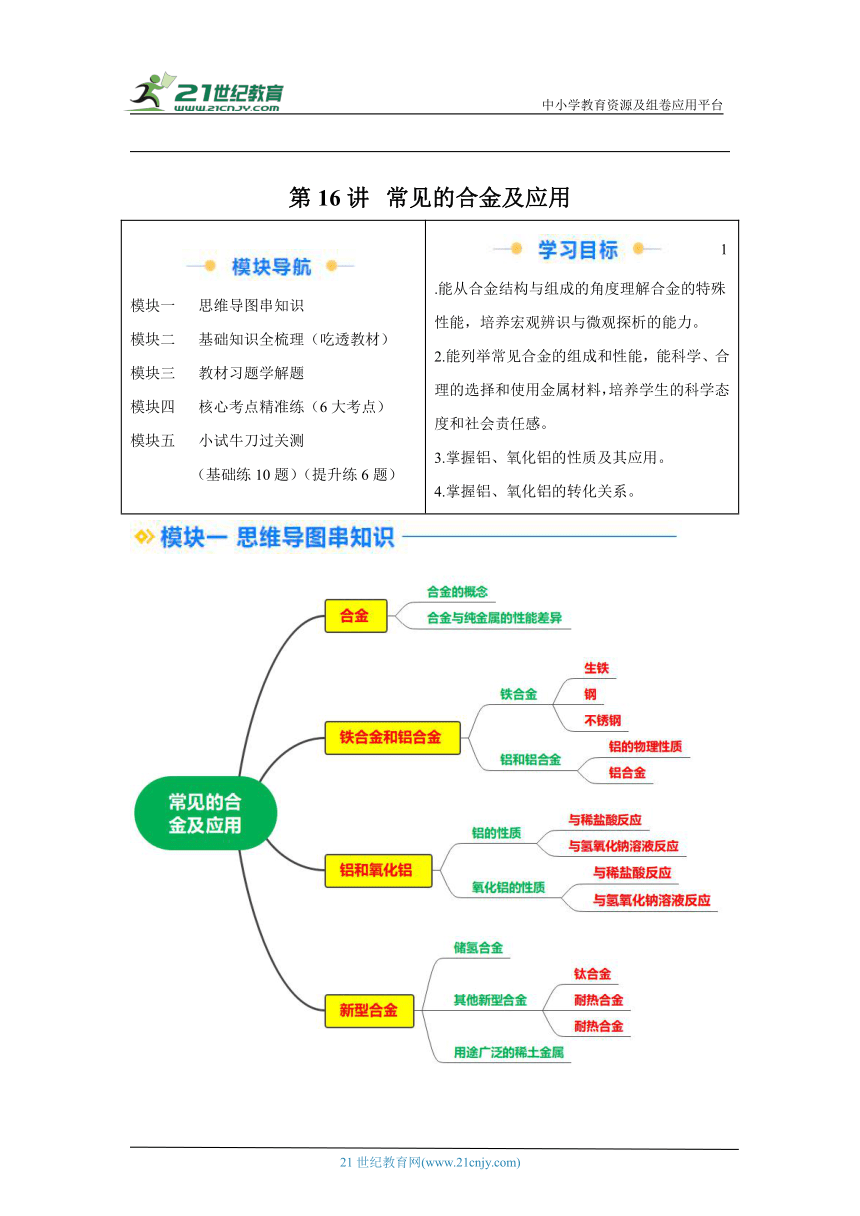 | |
| 格式 | docx | ||
| 文件大小 | 542.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:38:27 | ||
图片预览





文档简介
第16讲 常见的合金及应用
模块一 思维导图串知识 模块二 基础知识全梳理(吃透教材) 模块三 教材习题学解题 模块四 核心考点精准练(6大考点) 模块五 小试牛刀过关测 (基础练10题)(提升练6题) 1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析的能力。 2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。 3.掌握铝、氧化铝的性质及其应用。 4.掌握铝、氧化铝的转化关系。
一、合金
1.合金的概念
合金是指由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2.合金与纯金属的性能差异
(1)合金具有各成分金属的优良性能。合金一定是混合物。
(2)合金的硬度及机械性能一般大于它的各成分金属。
(3)合金的熔点一般低于它的各成分金属。
二、铁合金和铝合金
1.铁合金
(1)铁和碳形成的合金,因含碳量不同分为生铁(含碳量为2%~4.3%)和钢(含碳量为0.03%~2%)。
(2)钢是用量最大、用途最广的合金。
(3)不锈钢是最常见的一种合金钢,合金元素主要是铬和镍,在大气中比较稳定,不易生锈,抗腐蚀能力强。
思考与交流:已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
【答案】不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
2.铝和铝合金
(1)铝是地壳中含量最多的金属元素,常温下就能与空气中的氧气发生反应,表面生成一层致密的氧化铝薄膜,保护内部金属。银白色固体,ρ=2.7g/cm3,熔点660.4℃,沸点2467℃,导电热性,轻金属。
【特别提醒】在常温下形成致密保护膜的金属,如铝、镁等金属。铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度小,强度高,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
三、铝和氧化铝
1.铝、氧化铝的性质
(1)铝、氧化铝与稀盐酸反应
实验操作
实验现象 铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
化学方程式 Al2O3+6HCl=2AlCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑
离子方程式 Al2O3+6H+=2Al3++3H2O、2Al+6H+=2Al3++3H2↑
(2)铝、氧化铝与氢氧化钠溶液反应
实验操作
实验现象 试管①中一开始无气泡产生,一段时间后,铝片溶解,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有爆鸣声
化学方程式 Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑
离子方程式 Al2O3+2OH-=2AlO+H2O、2Al+2OH-+2H2O=2AlO+3H2↑
2.氧化铝——两性氧化物
(1)俗名(刚玉)
(2)物理性质:白色固体难溶于水,熔沸点高,含有钛的叫蓝宝石,含有铬的叫红宝石硬度大,可做钻头。
(3)化学性质
与H+反应Al2O3+6H+=2Al3++3H2O
与强碱反应Al2O3+2OH-=2AlO+H2O
Al2O3是两性氧化物因为既能和H+反应又能和OH-反应生成盐和水的氧化物称为两性氧化物。
思考与交流:铝是活泼金属,但在日常生活中铝制品却能稳定存在,原因是什么?
【答案】常温下铝与氧气反应,在铝制品表面形成致密的氧化铝薄膜,保护铝不被腐蚀。
思考与交流:向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有______________。
【答案】①CO2+2OH-=CO+H2O
②Al2O3+2OH-=2AlO+H2O
③2Al+2OH-+2H2O=2AlO+3H2↑
【解析】向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
四、新型合金
1.储氢合金:一类能够大量吸收H2,并与H2结合成金属氢化物的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
2.其他新型合金:钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国是稀土资源大国,到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
教材习题01我国“蛟龙”号载人潜水器已成功下潜至海里7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( ) A.钛合金是一种新型金属单质 B.钛合金熔点比钛金属高 C.钛合金的硬度与钛单质相同 D.青铜、合金钢和硬铝都是合金 解题思路合金含有两种或者两种以上元素,不是单质,故A错误;合金熔点一般比其组分中任一金属的熔点低,故B错误;合金硬度一般比其组分中任一金属的硬度大,故C错误;青铜、合金钢和硬铝都是合金,故D正确。
【答案】D
教材习题02钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( ) A.用来做保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于家庭装修,做钛合金装饰门 解题思路由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;由于钛和钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排异反应,因此可以用来制造人造骨,C正确;由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确;只有A错误,由于其熔点高,不适合做保险丝。
【答案】A
核心考点一:合金及铁合金
1.2020年11月24日4时30分,我国在中国文昌航天发射场,用长征五号遥五运载火箭成功发射探月工程“嫦娥五号”探测器,开启我国首次地外天体采样返回之旅。“嫦娥五号”中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般合金的熔点比各成分金属的低
C.合金的化学性质与其成分金属的化学性质不同
D.改变原料的配比、生成合金的条件,可以得到具有不同性能的合金
核心考点二:铝和铝合金
2.铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用溶液除去粉末中少量的
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
核心考点三:新型合金
3.储氢合金是一种新型合金。下列关于储氢合金的说法,错误的是
A.储氢合金是一类能大量吸收,并与结合成金属氢化物的材料
B.储氢合金吸收的过程属于物理变化
C.储氢合金中氢元素的化合价为-1
D.具有实用价值的储氢合金在室温下吸、放氢的速率快
核心考点四:隐含条件下的离子共存
4.向某溶液中加入铝粉能放出,下列各组离子一定不能在该溶液中大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
核心考点五:氧化铝的性质
5.下列说法正确的是
A.铝制品在生活中被广泛应用,说明铝是一种不活泼金属
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸、碱溶液反应
D.Al2O3能跟强的酸、碱溶液反应
核心考点六:铝的综合应用
6.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示,下列说法正确的是
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
【基础练】
7.我国最早使用的合金是
A.钢铁 B.黄铜 C.白铜 D.青铜
8.合金在生产生活中有广泛的用途,下列所用材料不属于合金的是
A.家用的铝窗 B.温度计用的水银
C.铸造用的黄铜 D.建筑用的钢筋
9.下列关于合金的说法正确的是
①合金只能由两种或两种以上的金属组成 ②合金具有金属特性 ③碳钢和生铁的主要成分相同,故性能相同 ④改变原料的配比及生成合金的条件,可得到具有不同性能的合金
A.②③ B.②④ C.①② D.①④
10.铁和铁合金是生活中常见的材料,下列说法正确的是
A.纯铁的熔点低于铁合金 B.纯铁和铁合金都能导电、传热
C.纯铁的硬度和强度都高于铁合金 D.不锈钢是铁合金,只含金属元素
11.现有MgO、Al2O3、Fe2O3、CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂
A.氨水 B.浓NaOH溶液 C.NaCl溶液 D.稀H2SO4
12.铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用溶液除去粉末中少量的
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
13.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.生铁和钢是含碳量不同的两种铁碳合金,生铁的含碳量比钢的含碳量高
D.合金的熔点比其成分金属的熔点高
14.下列关于合金的说法中,正确的是
A.在我国使用最早的合金是钢
B.生铁的含碳量为0.03~0.2%
C.储氢合金是一类能够大量吸收H2,并与H2结合成具有广阔前景的金属氢化物的材料
D.稀土金属不能用于生产合金
15.铁是人类较早使用的金属之一、据有关报道,目前已能冶炼出纯度高达的铁。纯铁的实际使用范围有限,人们大量使用的是铁的合金。钢铁是铁碳合金的总称,其强度高、价格便宜、应用广泛。以下关于不锈钢和普通钢的认识中,你认为正确的是
A.它们的组成元素是相同的
B.耐腐蚀的性能不同
C.都属于钢,物理性质相同
D.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质完全相同
16.下列关于合金的说法中,正确的是
A.合金的硬度一般比其各成分金属的硬度高,熔点一定比其各成分金属的熔点低
B.合金的物理性质一般与其各成分金属的物理性质相同
C.生铁的含碳量为0.03%~2%
D.目前世界上用途最广、使用量最大的合金是钢
【提升练】
17.下列有关铝及其化合物的说法正确的是
A.在常温下,铝不能与氧气反应
B.氧化铝只能与酸反应,不能与碱反应
C.铝既能溶于盐酸,又能溶于氢氧化钠溶液
D.向氯化铝溶液中加入过量的氢氧化钠溶液可制得氢氧化铝
18.下列说法正确的是( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应是两性氧化物
19.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为
A.1:1 B.1:2 C.1:3 D.2:1
20.下列离子方程式书写正确的是
A.稀硝酸与过量的铁屑反应:
B.和氢氧化钠溶液反应:
C.和水反应:
D.向溶液中通入气体:
21.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.、Fe3+、Cl-、 B.Na+、K+、Cl-、
C.Mg2+、H+、Cl-、 D.K+、Ca2+、、Cl-
22.合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是 (填字母)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻划(如图所示),纯铜片上留下明显的划痕,说明 。
(4)黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为不溶性杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
①Ⅱ中反应的化学方程式为 。
②下列说法正确的是 (填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A的质量小于溶液B
d.溶液C中溶质的质量分数小于溶液B
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A. 生铁由铁和碳等元素组成,属于合金,故A正确;
B. 形成合金后,结构发生了改变,一般合金的熔点比各成分金属的低,故B正确;
C. 合金的化学性质与其成分金属的化学性质相同,故C错误;
D. 改变原料的配比、生成合金的条件,组成合金的成分、结构不同,对合金的性质产生不同的影响,可以得到具有不同性能的合金,故D正确;
故选C。
2.D
【详解】A.制造机器零部件要求材料硬度高、强度好,而纯铝硬度、强度较小,不适合,A正确;
B.氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,B正确;
C.铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船是理想材料,C正确;
D.铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误;
答案选D。
3.B
【详解】A.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料.如镧镍合金,它吸收氢气可结合成金属氢化物,故A正确;
B.氢气在储存过程中与金属反应生成其他物质,是化学变化,故B错误;
C.中Na是+1价,Al是+3价,则H为-1价,故C正确;
D.储氢合金储氢量大、吸放氢速率快,所以可用于氢燃料汽车,故D正确;
故选:B。
4.B
【分析】加入铝粉能放出,说明该溶液可能呈酸性,也可能呈碱性。关注题干信息“一定不能”,即酸性和碱性溶液中都不能大量共存。
【详解】加入铝粉能放出,说明该溶液可能呈酸性,也可能呈碱性;
A.碱性条件下,和OH-不能大量共存;可在酸性溶液中,、、、之间以及与H+不反应,能大量共存,故A不符合题意;
B. 在碱性溶液中,、与OH-不能大量共存,在碱性溶液中生成,与会生成沉淀;在酸性溶液中,与H+生成,不能大量共存,故B符合题意;
C.在酸性条件下,与H+不能大量共存;在碱性溶液中,、、、之间以及与OH-不反应,可以大量共存,故C不符合题意;
D.在酸性溶液、碱性溶液中,、、、之间以及与H+或OH-均不反应,都可以大量共存,故D不符合题意;
答案选B。
5.D
【详解】A.铝制品在生活中被广泛应用,是由于Al比较活泼,与空气中的氧气反应产生的Al2O3薄膜非常致密,对内层金属起保护作用,而不是因为铝是不活泼金属,A错误;
B.Al2O3是金属氧化物,但氧化铝既能与强酸反应产生盐和水,也能与强碱反应产生盐和水,因此它是两性氧化物,而不是碱性氧化物,B错误;
C.Al2O3只能跟强酸、强碱溶液反应,而不能与弱碱反应,C错误;
D.Al2O3是两性氧化物,能跟强的酸、碱溶液反应,D正确;
故合理选项是D。
6.B
【详解】A.铝与稀烧碱反应放出氢气,铝球表面有气泡产生,产物偏铝酸钠可溶于水,没有白色沉淀生成,铝球质量减少,铁置换出铜,铁球质量增加,杠杆不平衡,A错误;
B.铝与稀烧碱反应放出氢气,铝球表面有气泡产生,产物偏铝酸钠可溶于水,溶液澄清;铁与硫酸铜溶液发生置换反应生成铜单质和硫酸亚铁,铁球表面有红色物质铜析出,溶液蓝色变浅,铝球质量减少,铁置换出铜,铁球质量增加,杠杆右边下沉,B正确;
C.反应后去掉两烧杯,杠杆不平衡,杠杆右边下沉,C错误;
D.右边球上铁置换出铜,出现红色,左边铝与稀烧碱溶液反应,c(OH-)减少,D错误;
故选B。
7.D
【详解】人类对金属材料的使用、跟金属的活泼性息息相关,金属越不活泼人类越早使用。A.钢铁为铁碳合金、铁比铜活泼;B. 黄铜为铜锌合金;C.白铜中含有锌、铝铁等等;D. 青铜为铜锡合金,锌比锡活泼,则D满足;
答案选D。
8.B
【详解】A.家用的铝窗含有的元素有铝、铜、硅、镁、锌、锰等,所以是合金,故A不选;
B.水银是单质,所以温度计用的水银不是合金,故B选;
C.黄铜中含有铜和锌,所以铸造用的黄铜是合金,故C不选;
D.钢筋中含有铁、碳等元素,所以建筑用的钢筋是合金,故D不选;
故选:B。
9.B
【详解】①合金可由两种或两种以上的金属或者金属与非金属熔合而成,故错误;
②合金是指在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,故正确;
③碳钢和生铁含碳量不同,含碳量越高,硬度越大,因此两者的性能不同,故错误;
④合金的性质与合金的原料配比以及制造工艺有关,所以改变原料的配比、变更制造合金的工艺,可以制得具有不同性能的合金,故正确;
故选:B;
10.B
【详解】A.合金的熔点比其组成金属的熔点要低,故纯铁的熔点高于铁合金,A错误;
B.纯铁和铁合金中都含有金属,故都能导电、传热,B正确;
C.合金的强度和硬度一般比组成金属的纯金属更高,故纯铁的硬度和强度都低于铁合金,C错误;
D.不锈钢是铁合金,里面还有碳元素,D错误;
故选B。
11.B
【详解】A.MgO、Al2O3、Fe2O3、CuO与氨水都不反应,故A不符合题意;
B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3、CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;
C.MgO、Al2O3、Fe2O3、CuO与NaCl溶液都不反应,故C不符合题意;
D.MgO、Al2O3、Fe2O3、CuO与稀H2SO4都反应,故D不符合题意;
故答案为B。
12.D
【详解】A.制造机器零部件要求材料硬度高、强度好,而纯铝硬度、强度较小,不适合,A正确;
B.氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,B正确;
C.铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船是理想材料,C正确;
D.铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误;
答案选D。
13.D
【详解】A.镧镍合金能大量吸收H2,并与H2结合成金属氢化物,金属氢化物稍稍加热又容易分解,所以可用作储氢材料,故A正确;
B.钛合金生物相容性好,强度大,常用作人造骨骼,故B正确;
C.生铁是含碳量大于2%的铁碳合金,钢是对含碳量在0.02%~2%之间的铁碳合金的统称,生铁的含碳量比钢高,故C正确;
D.合金的熔点比其成分金属的熔点低,故D错误;
答案为D。
14.C
【详解】A.我国是最早冶炼金属铜的国家,所以我国最早使用的合金是铜合金, A错误;
B.生铁的含碳量为2~4.3%,B错误;
C.储氢合金可以吸收大量的H2,H2与金属发生化学反应生成金属氢化物,储氢合金要求储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、放氢速率快,C正确;
D.稀土金属可以用于生产合金,如钇-镁合金、钇-铝合金,均在自己的领域例发挥重要的作用,D错误;
故答案选C。
15.B
【详解】A.普碳钢主要成分是Fe、C,不锈钢则是由普碳钢与Cr、Ni、Mo等融合而成,因此二者组成元素是不同的,A错误;
B.不锈钢抗腐蚀能力比普通钢强,B正确;
C.不锈钢和普通钢尽管都属于钢,但由于组成成分不同,物理及机械性能都存在较大的差异,C错误;
D.不锈钢中含有Ni、Cr、Mo等元素,使不锈钢的化学性质有别于普碳钢,D错误;
故合理选项是B。
16.D
【详解】A.多数合金的硬度一般比其各成分的金属的硬度高,合金的熔点一般比各成分金属的熔点低,故A错误;
B.合金的化学性质一般与各成分金属的化学性质相同,合金的物理性质一般与其各成分金属的物理性质不相同,如合金的硬度高、熔点低等,故B错误;
C.钢中含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,故C错误;
D.目前世界上用途最广、使用量最大的合金是钢,如炊具、建筑材料等,故D正确;
故选D。
17.C
【详解】A.常温下,铝和氧气反应生成氧化铝,反应化学方程式为2Al+3O2=Al2O3,A错误;
B.Al2O3属于两性氧化物,既能与酸反应,又能与碱反应,B错误;
C.铝和盐酸反应生成氯化铝和氢气,铝和氢氧化钠和水反应生成偏铝酸钠和氢气,C正确;
D.向氯化铝溶液中加入过量的氢氧化钠溶液得到的是偏铝酸钠,D错误;
故选C。
18.D
【详解】A.Al2O3难溶于水,不跟水反应,但它是Al(OH)3对应的氧化物,A错误;
B.Al2O3是两性氧化物,B错误;
C.Al2O3是两性氧化物,能跟强酸强碱反应,不能与所有的酸碱溶液反应,C错误;
D.Al2O3是两性氧化物,能跟强的酸碱溶液反应,D正确。
答案选D。
19.A
【详解】由反应2Al+2NaOH+2H2O=2NaAlO2+3H2和2Al+6HCl=2AlCl3+3H2知,相同质量的铝即铝的物质的量相同,所以与足量的盐酸和氢氧化钠溶液反应放出的氢气物质的量相同,则在同温同压下体积相同,即1:1;故选A。
20.D
【详解】A.稀硝酸与过量的铁屑反应生成亚铁离子,应为:,故A错误;
B.离子方程式元素不守恒,应为:,故B错误;
C.过氧化钠为氧化物,书写离子方程式时,不可拆开,应为:,故C错误;
D.碳酸钠与二氧化碳和水可以反应生成碳酸氢钠,故D正确;
故选D。
21.B
【详解】某溶液与Al反应能放出H2,则该溶液可能是强酸性溶液也可能是强碱性溶液,据此分析解题:
A.碱性溶液中,和OH-因生成弱电解质而不能大量共存,A不合题意;
B.Na+、K+、Cl-、与H+或者OH-均不反应,能大量共存,B符合题意;
C.碱性溶液中,Mg2+和OH-生成沉淀,不能大量共存,C不合题意;
D.和H+或者OH-均不能大量共存,D不合题意;
故答案为:B。
22.(1)C
(2)混合物
(3)黄铜的硬度比纯铜的硬度大
(4) Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu abc
【分析】(4)黄铜渣(约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为不溶性杂质)中加过量稀硫酸酸浸,经操作Ⅰ过滤后所得溶液A中溶质为ZnSO4、CuSO4和过量的H2SO4,滤渣为铜和其余不溶性杂质。溶液A中加过量Zn,Zn与过量的稀硫酸和生成的CuSO4反应,化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu,经操作Ⅱ过滤除去锌和置换出的铜,将溶液B加热蒸发,过滤得到硫酸锌晶体和溶液C,其中溶液C为ZnSO4的饱和溶液。
【详解】(1)青花瓷瓶属于陶瓷,橡胶属于有机物,不锈钢属于铁、碳合金,故选C。
(2)生铁为铁、碳合金,含碳量较高,属于混合物。
(3)将纯铜片和黄铜片互相刻划,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大。
(4)①Ⅱ中,加入的Zn与过量的稀硫酸和生成的CuSO4反应,化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu。
②a.由题中流程可知,操作Ⅰ中过滤是为了除去铜和其余杂质,操作Ⅱ中过滤是为了除去锌和置换出的铜,a正确;
b.因氧化锌的质量大于氧化铜,且锌也能和稀硫酸反应生成硫酸锌,而铜和稀硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜,b正确;
c.溶液A中加入锌后,反应的化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu;对反应Zn+H2SO4=ZnSO4+H2↑分析可知,每65份质量的锌进入溶液,从溶液中逸出2份质量的氢气,使得溶液质量增加;对于反应Zn+CuSO4=ZnSO4+Cu来说,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,也使得溶液质量增加;故溶液A的质量小于溶液B,c正确;
d.溶液C为ZnSO4的饱和溶液,溶质质量分数达到同温度下的最大值,d错误;
故选abc。
答案第1页,共2页
答案第1页,共2页
模块一 思维导图串知识 模块二 基础知识全梳理(吃透教材) 模块三 教材习题学解题 模块四 核心考点精准练(6大考点) 模块五 小试牛刀过关测 (基础练10题)(提升练6题) 1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与微观探析的能力。 2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。 3.掌握铝、氧化铝的性质及其应用。 4.掌握铝、氧化铝的转化关系。
一、合金
1.合金的概念
合金是指由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2.合金与纯金属的性能差异
(1)合金具有各成分金属的优良性能。合金一定是混合物。
(2)合金的硬度及机械性能一般大于它的各成分金属。
(3)合金的熔点一般低于它的各成分金属。
二、铁合金和铝合金
1.铁合金
(1)铁和碳形成的合金,因含碳量不同分为生铁(含碳量为2%~4.3%)和钢(含碳量为0.03%~2%)。
(2)钢是用量最大、用途最广的合金。
(3)不锈钢是最常见的一种合金钢,合金元素主要是铬和镍,在大气中比较稳定,不易生锈,抗腐蚀能力强。
思考与交流:已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?
【答案】不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
2.铝和铝合金
(1)铝是地壳中含量最多的金属元素,常温下就能与空气中的氧气发生反应,表面生成一层致密的氧化铝薄膜,保护内部金属。银白色固体,ρ=2.7g/cm3,熔点660.4℃,沸点2467℃,导电热性,轻金属。
【特别提醒】在常温下形成致密保护膜的金属,如铝、镁等金属。铁在高温下形成致密保护膜,俗称“烤蓝”,铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
(2)铝合金
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的Cu、Mg、Mn、Si,它的密度小,强度高,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
三、铝和氧化铝
1.铝、氧化铝的性质
(1)铝、氧化铝与稀盐酸反应
实验操作
实验现象 铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
化学方程式 Al2O3+6HCl=2AlCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑
离子方程式 Al2O3+6H+=2Al3++3H2O、2Al+6H+=2Al3++3H2↑
(2)铝、氧化铝与氢氧化钠溶液反应
实验操作
实验现象 试管①中一开始无气泡产生,一段时间后,铝片溶解,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有爆鸣声
化学方程式 Al2O3+2NaOH=2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑
离子方程式 Al2O3+2OH-=2AlO+H2O、2Al+2OH-+2H2O=2AlO+3H2↑
2.氧化铝——两性氧化物
(1)俗名(刚玉)
(2)物理性质:白色固体难溶于水,熔沸点高,含有钛的叫蓝宝石,含有铬的叫红宝石硬度大,可做钻头。
(3)化学性质
与H+反应Al2O3+6H+=2Al3++3H2O
与强碱反应Al2O3+2OH-=2AlO+H2O
Al2O3是两性氧化物因为既能和H+反应又能和OH-反应生成盐和水的氧化物称为两性氧化物。
思考与交流:铝是活泼金属,但在日常生活中铝制品却能稳定存在,原因是什么?
【答案】常温下铝与氧气反应,在铝制品表面形成致密的氧化铝薄膜,保护铝不被腐蚀。
思考与交流:向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有______________。
【答案】①CO2+2OH-=CO+H2O
②Al2O3+2OH-=2AlO+H2O
③2Al+2OH-+2H2O=2AlO+3H2↑
【解析】向集满CO2的易拉罐中加入过量NaOH浓溶液,易拉罐渐渐凹瘪,是由于CO2被NaOH溶液吸收,气体压强减小,发生了①反应;铝制易拉罐表面的Al2O3会与NaOH溶液反应,发生了②反应;NaOH溶液能与Al发生反应生成H2,使易拉罐凸起,发生了③反应。
四、新型合金
1.储氢合金:一类能够大量吸收H2,并与H2结合成金属氢化物的材料。如Ti-Fe合金、La-Ni合金等,为氢气作为能源的实际应用起到重要的推动作用。
2.其他新型合金:钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
3.用途广泛的稀土金属
(1)镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国是稀土资源大国,到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
(2)稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。
(3)稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
教材习题01我国“蛟龙”号载人潜水器已成功下潜至海里7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是( ) A.钛合金是一种新型金属单质 B.钛合金熔点比钛金属高 C.钛合金的硬度与钛单质相同 D.青铜、合金钢和硬铝都是合金 解题思路合金含有两种或者两种以上元素,不是单质,故A错误;合金熔点一般比其组分中任一金属的熔点低,故B错误;合金硬度一般比其组分中任一金属的硬度大,故C错误;青铜、合金钢和硬铝都是合金,故D正确。
【答案】D
教材习题02钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( ) A.用来做保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于家庭装修,做钛合金装饰门 解题思路由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;由于钛和钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排异反应,因此可以用来制造人造骨,C正确;由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确;只有A错误,由于其熔点高,不适合做保险丝。
【答案】A
核心考点一:合金及铁合金
1.2020年11月24日4时30分,我国在中国文昌航天发射场,用长征五号遥五运载火箭成功发射探月工程“嫦娥五号”探测器,开启我国首次地外天体采样返回之旅。“嫦娥五号”中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般合金的熔点比各成分金属的低
C.合金的化学性质与其成分金属的化学性质不同
D.改变原料的配比、生成合金的条件,可以得到具有不同性能的合金
核心考点二:铝和铝合金
2.铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用溶液除去粉末中少量的
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
核心考点三:新型合金
3.储氢合金是一种新型合金。下列关于储氢合金的说法,错误的是
A.储氢合金是一类能大量吸收,并与结合成金属氢化物的材料
B.储氢合金吸收的过程属于物理变化
C.储氢合金中氢元素的化合价为-1
D.具有实用价值的储氢合金在室温下吸、放氢的速率快
核心考点四:隐含条件下的离子共存
4.向某溶液中加入铝粉能放出,下列各组离子一定不能在该溶液中大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
核心考点五:氧化铝的性质
5.下列说法正确的是
A.铝制品在生活中被广泛应用,说明铝是一种不活泼金属
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸、碱溶液反应
D.Al2O3能跟强的酸、碱溶液反应
核心考点六:铝的综合应用
6.在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示,下列说法正确的是
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
【基础练】
7.我国最早使用的合金是
A.钢铁 B.黄铜 C.白铜 D.青铜
8.合金在生产生活中有广泛的用途,下列所用材料不属于合金的是
A.家用的铝窗 B.温度计用的水银
C.铸造用的黄铜 D.建筑用的钢筋
9.下列关于合金的说法正确的是
①合金只能由两种或两种以上的金属组成 ②合金具有金属特性 ③碳钢和生铁的主要成分相同,故性能相同 ④改变原料的配比及生成合金的条件,可得到具有不同性能的合金
A.②③ B.②④ C.①② D.①④
10.铁和铁合金是生活中常见的材料,下列说法正确的是
A.纯铁的熔点低于铁合金 B.纯铁和铁合金都能导电、传热
C.纯铁的硬度和强度都高于铁合金 D.不锈钢是铁合金,只含金属元素
11.现有MgO、Al2O3、Fe2O3、CuO混合物,如果只用一种试剂把Al2O3分离出来,应选用试剂
A.氨水 B.浓NaOH溶液 C.NaCl溶液 D.稀H2SO4
12.铝是地壳中含量最高的金属元素,下列关于铝及其化合物的性质、用途的说法错误的是
A.纯铝的硬度和强度较小,不适合用于制造机器零部件
B.可用溶液除去粉末中少量的
C.铝合金是用来制造飞机和宇宙飞船的理想材料
D.铝制品廉价易得,适用于厨房蒸煮和长期存放碱性食物
13.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.生铁和钢是含碳量不同的两种铁碳合金,生铁的含碳量比钢的含碳量高
D.合金的熔点比其成分金属的熔点高
14.下列关于合金的说法中,正确的是
A.在我国使用最早的合金是钢
B.生铁的含碳量为0.03~0.2%
C.储氢合金是一类能够大量吸收H2,并与H2结合成具有广阔前景的金属氢化物的材料
D.稀土金属不能用于生产合金
15.铁是人类较早使用的金属之一、据有关报道,目前已能冶炼出纯度高达的铁。纯铁的实际使用范围有限,人们大量使用的是铁的合金。钢铁是铁碳合金的总称,其强度高、价格便宜、应用广泛。以下关于不锈钢和普通钢的认识中,你认为正确的是
A.它们的组成元素是相同的
B.耐腐蚀的性能不同
C.都属于钢,物理性质相同
D.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质完全相同
16.下列关于合金的说法中,正确的是
A.合金的硬度一般比其各成分金属的硬度高,熔点一定比其各成分金属的熔点低
B.合金的物理性质一般与其各成分金属的物理性质相同
C.生铁的含碳量为0.03%~2%
D.目前世界上用途最广、使用量最大的合金是钢
【提升练】
17.下列有关铝及其化合物的说法正确的是
A.在常温下,铝不能与氧气反应
B.氧化铝只能与酸反应,不能与碱反应
C.铝既能溶于盐酸,又能溶于氢氧化钠溶液
D.向氯化铝溶液中加入过量的氢氧化钠溶液可制得氢氧化铝
18.下列说法正确的是( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3能跟所有的酸碱溶液反应
D.Al2O3能跟强的酸碱溶液反应是两性氧化物
19.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为
A.1:1 B.1:2 C.1:3 D.2:1
20.下列离子方程式书写正确的是
A.稀硝酸与过量的铁屑反应:
B.和氢氧化钠溶液反应:
C.和水反应:
D.向溶液中通入气体:
21.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.、Fe3+、Cl-、 B.Na+、K+、Cl-、
C.Mg2+、H+、Cl-、 D.K+、Ca2+、、Cl-
22.合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是 (填字母)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻划(如图所示),纯铜片上留下明显的划痕,说明 。
(4)黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为不溶性杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
①Ⅱ中反应的化学方程式为 。
②下列说法正确的是 (填字母)。
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液A中ZnSO4的质量大于CuSO4
c.溶液A的质量小于溶液B
d.溶液C中溶质的质量分数小于溶液B
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A. 生铁由铁和碳等元素组成,属于合金,故A正确;
B. 形成合金后,结构发生了改变,一般合金的熔点比各成分金属的低,故B正确;
C. 合金的化学性质与其成分金属的化学性质相同,故C错误;
D. 改变原料的配比、生成合金的条件,组成合金的成分、结构不同,对合金的性质产生不同的影响,可以得到具有不同性能的合金,故D正确;
故选C。
2.D
【详解】A.制造机器零部件要求材料硬度高、强度好,而纯铝硬度、强度较小,不适合,A正确;
B.氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,B正确;
C.铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船是理想材料,C正确;
D.铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误;
答案选D。
3.B
【详解】A.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料.如镧镍合金,它吸收氢气可结合成金属氢化物,故A正确;
B.氢气在储存过程中与金属反应生成其他物质,是化学变化,故B错误;
C.中Na是+1价,Al是+3价,则H为-1价,故C正确;
D.储氢合金储氢量大、吸放氢速率快,所以可用于氢燃料汽车,故D正确;
故选:B。
4.B
【分析】加入铝粉能放出,说明该溶液可能呈酸性,也可能呈碱性。关注题干信息“一定不能”,即酸性和碱性溶液中都不能大量共存。
【详解】加入铝粉能放出,说明该溶液可能呈酸性,也可能呈碱性;
A.碱性条件下,和OH-不能大量共存;可在酸性溶液中,、、、之间以及与H+不反应,能大量共存,故A不符合题意;
B. 在碱性溶液中,、与OH-不能大量共存,在碱性溶液中生成,与会生成沉淀;在酸性溶液中,与H+生成,不能大量共存,故B符合题意;
C.在酸性条件下,与H+不能大量共存;在碱性溶液中,、、、之间以及与OH-不反应,可以大量共存,故C不符合题意;
D.在酸性溶液、碱性溶液中,、、、之间以及与H+或OH-均不反应,都可以大量共存,故D不符合题意;
答案选B。
5.D
【详解】A.铝制品在生活中被广泛应用,是由于Al比较活泼,与空气中的氧气反应产生的Al2O3薄膜非常致密,对内层金属起保护作用,而不是因为铝是不活泼金属,A错误;
B.Al2O3是金属氧化物,但氧化铝既能与强酸反应产生盐和水,也能与强碱反应产生盐和水,因此它是两性氧化物,而不是碱性氧化物,B错误;
C.Al2O3只能跟强酸、强碱溶液反应,而不能与弱碱反应,C错误;
D.Al2O3是两性氧化物,能跟强的酸、碱溶液反应,D正确;
故合理选项是D。
6.B
【详解】A.铝与稀烧碱反应放出氢气,铝球表面有气泡产生,产物偏铝酸钠可溶于水,没有白色沉淀生成,铝球质量减少,铁置换出铜,铁球质量增加,杠杆不平衡,A错误;
B.铝与稀烧碱反应放出氢气,铝球表面有气泡产生,产物偏铝酸钠可溶于水,溶液澄清;铁与硫酸铜溶液发生置换反应生成铜单质和硫酸亚铁,铁球表面有红色物质铜析出,溶液蓝色变浅,铝球质量减少,铁置换出铜,铁球质量增加,杠杆右边下沉,B正确;
C.反应后去掉两烧杯,杠杆不平衡,杠杆右边下沉,C错误;
D.右边球上铁置换出铜,出现红色,左边铝与稀烧碱溶液反应,c(OH-)减少,D错误;
故选B。
7.D
【详解】人类对金属材料的使用、跟金属的活泼性息息相关,金属越不活泼人类越早使用。A.钢铁为铁碳合金、铁比铜活泼;B. 黄铜为铜锌合金;C.白铜中含有锌、铝铁等等;D. 青铜为铜锡合金,锌比锡活泼,则D满足;
答案选D。
8.B
【详解】A.家用的铝窗含有的元素有铝、铜、硅、镁、锌、锰等,所以是合金,故A不选;
B.水银是单质,所以温度计用的水银不是合金,故B选;
C.黄铜中含有铜和锌,所以铸造用的黄铜是合金,故C不选;
D.钢筋中含有铁、碳等元素,所以建筑用的钢筋是合金,故D不选;
故选:B。
9.B
【详解】①合金可由两种或两种以上的金属或者金属与非金属熔合而成,故错误;
②合金是指在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,故正确;
③碳钢和生铁含碳量不同,含碳量越高,硬度越大,因此两者的性能不同,故错误;
④合金的性质与合金的原料配比以及制造工艺有关,所以改变原料的配比、变更制造合金的工艺,可以制得具有不同性能的合金,故正确;
故选:B;
10.B
【详解】A.合金的熔点比其组成金属的熔点要低,故纯铁的熔点高于铁合金,A错误;
B.纯铁和铁合金中都含有金属,故都能导电、传热,B正确;
C.合金的强度和硬度一般比组成金属的纯金属更高,故纯铁的硬度和强度都低于铁合金,C错误;
D.不锈钢是铁合金,里面还有碳元素,D错误;
故选B。
11.B
【详解】A.MgO、Al2O3、Fe2O3、CuO与氨水都不反应,故A不符合题意;
B.Al2O3能与浓NaOH溶液反应溶解,MgO、Fe2O3、CuO与NaOH溶液都不反应,可以把Al2O3分离出来,故B符合题意;
C.MgO、Al2O3、Fe2O3、CuO与NaCl溶液都不反应,故C不符合题意;
D.MgO、Al2O3、Fe2O3、CuO与稀H2SO4都反应,故D不符合题意;
故答案为B。
12.D
【详解】A.制造机器零部件要求材料硬度高、强度好,而纯铝硬度、强度较小,不适合,A正确;
B.氧化铁不与氢氧化钠溶液反应,氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,B正确;
C.铝合金硬度高、质量轻,是用来制造飞机和宇宙飞船是理想材料,C正确;
D.铝能与酸、碱发生反应,铝制品不能长期存放酸性或碱性较强的食物,D错误;
答案选D。
13.D
【详解】A.镧镍合金能大量吸收H2,并与H2结合成金属氢化物,金属氢化物稍稍加热又容易分解,所以可用作储氢材料,故A正确;
B.钛合金生物相容性好,强度大,常用作人造骨骼,故B正确;
C.生铁是含碳量大于2%的铁碳合金,钢是对含碳量在0.02%~2%之间的铁碳合金的统称,生铁的含碳量比钢高,故C正确;
D.合金的熔点比其成分金属的熔点低,故D错误;
答案为D。
14.C
【详解】A.我国是最早冶炼金属铜的国家,所以我国最早使用的合金是铜合金, A错误;
B.生铁的含碳量为2~4.3%,B错误;
C.储氢合金可以吸收大量的H2,H2与金属发生化学反应生成金属氢化物,储氢合金要求储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,室温下吸、放氢速率快,C正确;
D.稀土金属可以用于生产合金,如钇-镁合金、钇-铝合金,均在自己的领域例发挥重要的作用,D错误;
故答案选C。
15.B
【详解】A.普碳钢主要成分是Fe、C,不锈钢则是由普碳钢与Cr、Ni、Mo等融合而成,因此二者组成元素是不同的,A错误;
B.不锈钢抗腐蚀能力比普通钢强,B正确;
C.不锈钢和普通钢尽管都属于钢,但由于组成成分不同,物理及机械性能都存在较大的差异,C错误;
D.不锈钢中含有Ni、Cr、Mo等元素,使不锈钢的化学性质有别于普碳钢,D错误;
故合理选项是B。
16.D
【详解】A.多数合金的硬度一般比其各成分的金属的硬度高,合金的熔点一般比各成分金属的熔点低,故A错误;
B.合金的化学性质一般与各成分金属的化学性质相同,合金的物理性质一般与其各成分金属的物理性质不相同,如合金的硬度高、熔点低等,故B错误;
C.钢中含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,故C错误;
D.目前世界上用途最广、使用量最大的合金是钢,如炊具、建筑材料等,故D正确;
故选D。
17.C
【详解】A.常温下,铝和氧气反应生成氧化铝,反应化学方程式为2Al+3O2=Al2O3,A错误;
B.Al2O3属于两性氧化物,既能与酸反应,又能与碱反应,B错误;
C.铝和盐酸反应生成氯化铝和氢气,铝和氢氧化钠和水反应生成偏铝酸钠和氢气,C正确;
D.向氯化铝溶液中加入过量的氢氧化钠溶液得到的是偏铝酸钠,D错误;
故选C。
18.D
【详解】A.Al2O3难溶于水,不跟水反应,但它是Al(OH)3对应的氧化物,A错误;
B.Al2O3是两性氧化物,B错误;
C.Al2O3是两性氧化物,能跟强酸强碱反应,不能与所有的酸碱溶液反应,C错误;
D.Al2O3是两性氧化物,能跟强的酸碱溶液反应,D正确。
答案选D。
19.A
【详解】由反应2Al+2NaOH+2H2O=2NaAlO2+3H2和2Al+6HCl=2AlCl3+3H2知,相同质量的铝即铝的物质的量相同,所以与足量的盐酸和氢氧化钠溶液反应放出的氢气物质的量相同,则在同温同压下体积相同,即1:1;故选A。
20.D
【详解】A.稀硝酸与过量的铁屑反应生成亚铁离子,应为:,故A错误;
B.离子方程式元素不守恒,应为:,故B错误;
C.过氧化钠为氧化物,书写离子方程式时,不可拆开,应为:,故C错误;
D.碳酸钠与二氧化碳和水可以反应生成碳酸氢钠,故D正确;
故选D。
21.B
【详解】某溶液与Al反应能放出H2,则该溶液可能是强酸性溶液也可能是强碱性溶液,据此分析解题:
A.碱性溶液中,和OH-因生成弱电解质而不能大量共存,A不合题意;
B.Na+、K+、Cl-、与H+或者OH-均不反应,能大量共存,B符合题意;
C.碱性溶液中,Mg2+和OH-生成沉淀,不能大量共存,C不合题意;
D.和H+或者OH-均不能大量共存,D不合题意;
故答案为:B。
22.(1)C
(2)混合物
(3)黄铜的硬度比纯铜的硬度大
(4) Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu abc
【分析】(4)黄铜渣(约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为不溶性杂质)中加过量稀硫酸酸浸,经操作Ⅰ过滤后所得溶液A中溶质为ZnSO4、CuSO4和过量的H2SO4,滤渣为铜和其余不溶性杂质。溶液A中加过量Zn,Zn与过量的稀硫酸和生成的CuSO4反应,化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu,经操作Ⅱ过滤除去锌和置换出的铜,将溶液B加热蒸发,过滤得到硫酸锌晶体和溶液C,其中溶液C为ZnSO4的饱和溶液。
【详解】(1)青花瓷瓶属于陶瓷,橡胶属于有机物,不锈钢属于铁、碳合金,故选C。
(2)生铁为铁、碳合金,含碳量较高,属于混合物。
(3)将纯铜片和黄铜片互相刻划,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大。
(4)①Ⅱ中,加入的Zn与过量的稀硫酸和生成的CuSO4反应,化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu。
②a.由题中流程可知,操作Ⅰ中过滤是为了除去铜和其余杂质,操作Ⅱ中过滤是为了除去锌和置换出的铜,a正确;
b.因氧化锌的质量大于氧化铜,且锌也能和稀硫酸反应生成硫酸锌,而铜和稀硫酸不反应,故溶液A中硫酸锌的质量大于硫酸铜,b正确;
c.溶液A中加入锌后,反应的化学方程式分别为Zn+H2SO4=ZnSO4+H2↑、Zn+CuSO4=ZnSO4+Cu;对反应Zn+H2SO4=ZnSO4+H2↑分析可知,每65份质量的锌进入溶液,从溶液中逸出2份质量的氢气,使得溶液质量增加;对于反应Zn+CuSO4=ZnSO4+Cu来说,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,也使得溶液质量增加;故溶液A的质量小于溶液B,c正确;
d.溶液C为ZnSO4的饱和溶液,溶质质量分数达到同温度下的最大值,d错误;
故选abc。
答案第1页,共2页
答案第1页,共2页
