湖南省湖南师范大学附属中学2023-2024学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 湖南省湖南师范大学附属中学2023-2024学年高一下学期期末考试化学试卷(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 985.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-07 19:45:04 | ||
图片预览



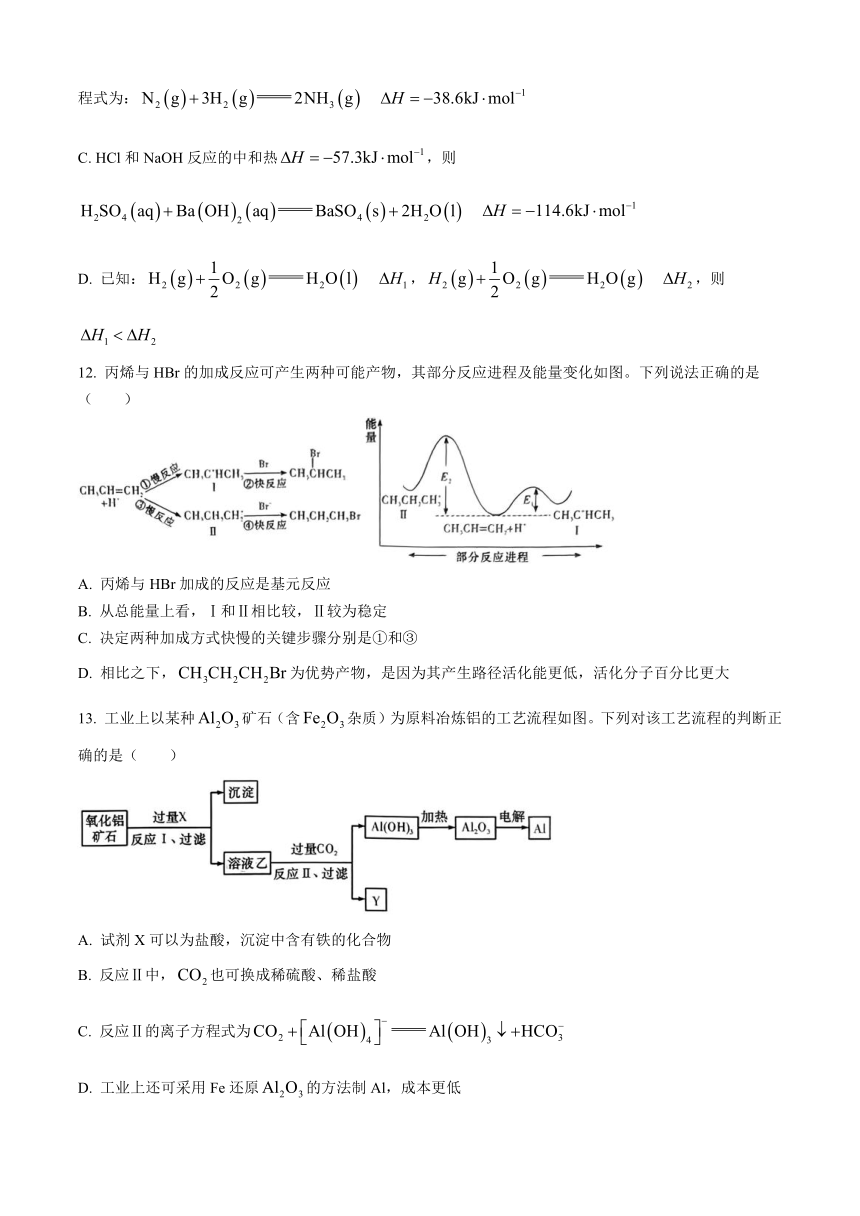
文档简介
湖南师大附中2023—2024学年度高一第二学期期末考试
化 学
时量:75分钟 满分:100分
可能用到的相对原子质量:H~1 C~12 N~14
一、选择题(本题共14小题,每小题只有一项符合题意,每小题3分,共42分)
1. 绿色化学是我们追求的目标,下列最符合“原子经济性反应”的是( )
A. 用碳还原二氧化硅制备高纯硅 B. 以铜和浓硝酸为原料生产硝酸铜
C. 用甲烷与氯气制备一氯甲烷 D. 乙烯与氧气在Ag催化下制备环氧乙烷
2. 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A. 质量数为14的碳原子: B. 丙烯的键线式:
C. 的电子式为 D. 的结构示意图:
3. 下列实验方案有误的是( )
实验方案
目的 A. 实验室制备光亮的银镜 B. 比较乙醇中羟基氢原子和水分子中氢原子的活泼性
实验方案
目的 C. 检验石蜡油分解气中是否含有不饱和烃 D. 实验室制备乙酸乙酯
4. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A. 反应开始到10s时,用Z表示的反应速率为
B. 在10s时,Y的转化率为21%
C. 反应的化学方程式为
D. 当容器内压强不变时,反应达到平衡
5. 类比法是化学上研究物质的重要方法之一,下列类比结果正确的是( )
A. 铜与氯气反应生成,则铁与氯气反应也生成
B. 工业上电解熔融的冶炼Mg,则也可电解熔融的冶炼Al
C. 王水能溶解铂,则一定浓度的和HCl的混合溶液也可能溶解铂
D. 碳酸钙的分解反应是吸热反应,则过氧化氢的分解反应也为吸热反应
6. 化石燃料的综合利用有利于环境保护,提高经济效益,如图是石油分馏塔的示意图。下列有关叙述正确的是( )
A. 石油的分馏、煤的干馏都是物理变化 B. 煤中含苯、甲苯、二甲苯
C. 对重油加工处理可以获得沥青、润滑油等产品 D. a、b、c三种馏分中a的沸点最高
7. 浓硫酸是实验室常用的试剂之一。将浓硫酸分别和三种钠盐反应,现象如图所示。下列分析正确的是( )
A. ①②③均体现了浓硫酸的强氧化性
B. 对比①和②可以说明还原性:
C. ②中试管口白雾是盐酸小液滴,说明酸性:
D. ③中气体使溴水褪色的原理与使品红溶液褪色的原理不同
8. 用如图所示装置来测定某原电池工作时,在一段时间内通过导线的电子的物质的量。量筒的规格为1000mL,电极材料是铁片和铜片。下列有关说法正确的是( )
A. b电极材料是铁片
B. 电子由b电极经导线流向a电极
C. 若用浓硝酸代替稀硫酸,溶液中的移向铜片
D. 当量筒中收集到672mL(标准状况)气体时,通过导线的电子的物质的量为0.03mol
9. 化合物M是一种制造压塑粉的原料,结构简式如图所示,其组成元素X、Y、Z、W位于短周期,质子数依次增大且满足。下列说法正确的是( )
A. 原子半径: B. 氧化物对应水化物的酸性:
C. X、Z、W形成的化合物一定不含有离子键 D. 简单氢化物稳定性:
10. 莽草酸可以合成甲流药物奥司他韦,部分路线如图。下列说法正确的是( )
A. 奥司他韦分子式为
B. 莽草酸与中间体互为同系物
C. 莽草酸既可以发生氧化反应,又可以发生还原反应
D. 莽草酸最多能消耗
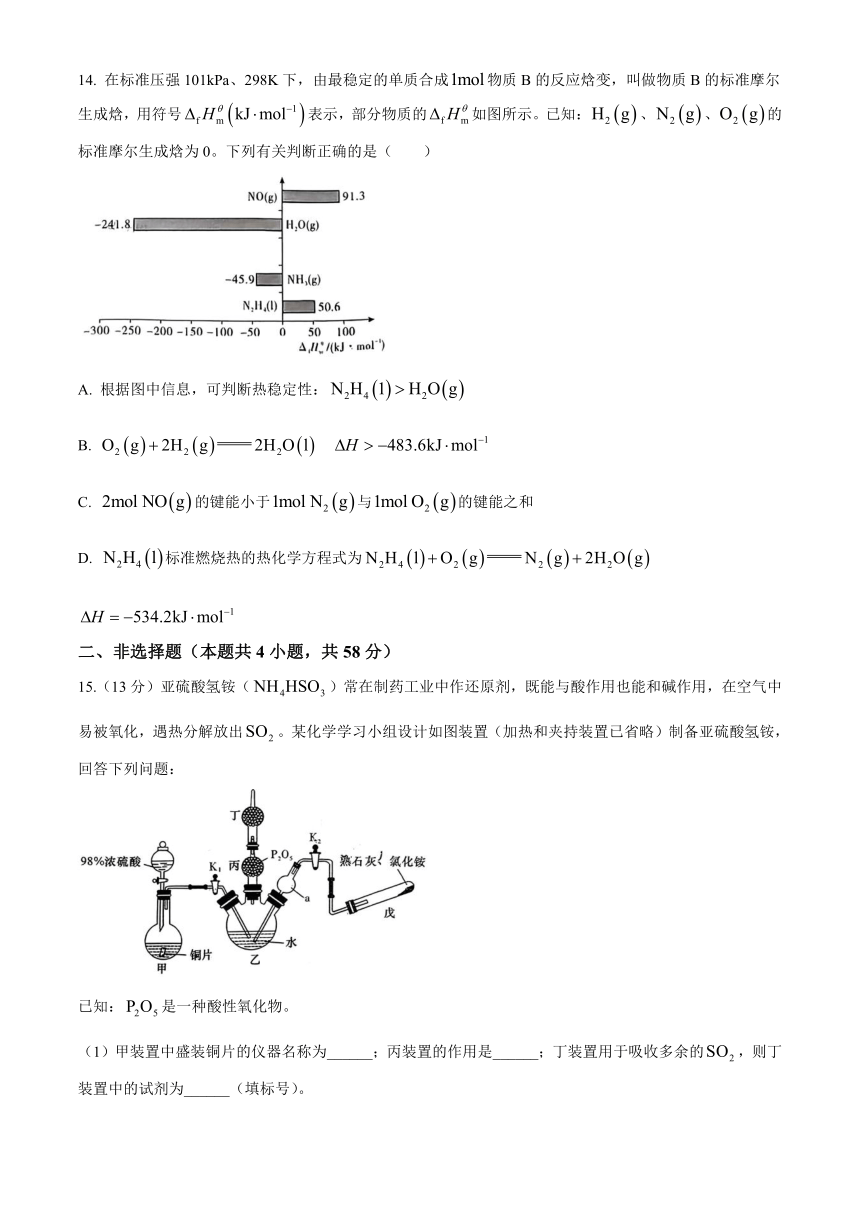
11. 下列有关热化学方程式的说法正确的是( )
A. 甲烷的燃烧热,则
B. 将和置于密闭的容器中充分反应生成,放热19.3kJ,则其热化学反应方程式为:
C. HCl和NaOH反应的中和热,则
D. 已知: , ,则
12. 丙烯与HBr的加成反应可产生两种可能产物,其部分反应进程及能量变化如图。下列说法正确的是( )
A. 丙烯与HBr加成的反应是基元反应
B. 从总能量上看,Ⅰ和Ⅱ相比较,Ⅱ较为稳定
C. 决定两种加成方式快慢的关键步骤分别是①和③
D. 相比之下,为优势产物,是因为其产生路径活化能更低,活化分子百分比更大
13. 工业上以某种矿石(含杂质)为原料冶炼铝的工艺流程如图。下列对该工艺流程的判断正确的是( )
A. 试剂X可以为盐酸,沉淀中含有铁的化合物
B. 反应Ⅱ中,也可换成稀硫酸、稀盐酸
C. 反应Ⅱ的离子方程式为
D. 工业上还可采用Fe还原的方法制Al,成本更低
14. 在标准压强101kPa、298K下,由最稳定的单质合成物质B的反应焓变,叫做物质B的标准摩尔生成焓,用符号表示,部分物质的如图所示。已知:、、的标准摩尔生成焓为0。下列有关判断正确的是( )
A. 根据图中信息,可判断热稳定性:
B.
C. 的键能小于与的键能之和
D. 标准燃烧热的热化学方程式为
二、非选择题(本题共4小题,共58分)
15.(13分)亚硫酸氢铵()常在制药工业中作还原剂,既能与酸作用也能和碱作用,在空气中易被氧化,遇热分解放出。某化学学习小组设计如图装置(加热和夹持装置已省略)制备亚硫酸氢铵,回答下列问题:
已知:是一种酸性氧化物。
(1)甲装置中盛装铜片的仪器名称为______;丙装置的作用是______;丁装置用于吸收多余的,则丁装置中的试剂为______(填标号)。
a. 无水 b. 碱石灰 c. d. 浓硫酸
(2)戊装置的试管内发生反应的化学方程式为______。
(3)实验开始时,先关闭,打开,一段时间后,关闭,打开。先打开后打开的原因可能是______。
(4)写出亚硫酸氢铵与等物质的量的氢氧化钡溶液反应的离子方程式:______。
(5)亚硫酸氢铵有较强的还原性,设计实验检验制备的亚硫酸氢铵样品是否被氧化:______(填操作、现象及相应的结论,可供选择的试剂:水、稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液)。
16.(15分)以淀粉为主要原料模拟合成其他重要化工原料的流程如图所示,据图回答下列问题。
已知:①烃E是一种基础化工原料,标准状况下密度为。
②;两个羟基连在同一个碳原子上不稳定。
③G能使溴水褪色;H有果香味。
(1)A的结构简式为______,乳酸分子中的官能团的名称为______,②的反应类型为______。
(2)写出下列两个反应的化学方程式(有机物用结构简式表示):
反应①__________________;
反应③__________________。
(3)下列说法正确的是______(填标号)。
a. 淀粉、油脂、蛋白质和纤维素都属于天然高分子
b. D可与新制氢氧化铜悬浊液反应生成蓝色溶液
c. B、C和G均能使酸性高锰酸钾溶液褪色
d. A→B的反应类型为水解反应
e. B和F属于同系物,D和G也属于同系物
(4)等物质的量的D、乳酸和G分别与足量金属钠反应,产生氢气的物质的量之比为______。
(5)久置的H自身会发生聚合反应得到弹性较好的聚合物,该聚合物的结构简式为______。
17.(16分)氯及其化合物在生产、生活中有着广泛的应用,请回答下列问题:
(1)已知:①
②
则反应 ______。
(2)几种含氯离子的相对能量如下表所示:
离子
相对能量/() 0 60 101 63 38
①在上述五种离子中,最不稳定的离子是______(填离子符号)。
②反应的______。
③写出由反应生成和的热化学方程式:____________。
(3)某实验小组设计用的盐酸100mL与的NaOH溶液100mL置于如图所示的装置中进行测定中和反应反应热的实验。
①该装置中缺少的一种玻璃仪器是______;大烧杯杯口若不盖泡沫塑料板,测得中和反应的反应热将______(填“偏大”“偏小”或“无影响”)。
②实验中,所用NaOH稍过量的原因是____________。
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各100mL,并记录原始数据:
实验序号 起始温度 终止温度 温差
盐酸 NaOH溶液 平均值
1 25.1 24.9 28.1
2 25.1 25.1 28.3
3 25.1 25.1 28.1
已知盐酸、NaOH溶液密度均近似为。中和后混合液,则该中和反应生成水的反应热______(保留到小数点后1位)。
根据计算结果,分析上述实验产生偏差的原因可能是______(填标号)。
a. 实验装置保温、隔热效果差
b. 量筒量取溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
18.(14分)研究反应机理对于认识和调控化学反应意义重大,下面是NO、等大气污染物治理中的相关反应机理,回答下列问题:
Ⅰ. NO在一定条件下与反应生成可参与大气生态循环的无毒气体,反应原理为:,已知每生成,放出166kJ的热量。
(1)向容器中充入和,充分反应后,放出的热量______664kJ(填“>”“<”或“=”)。
(2)研究发现,NO与的反应过程可分为三步,每步均为基元反应:
i. (快) ii. (慢)
iii. ……(快)
①第iii 步对应的基元反应是____________。
②该反应的中间产物是____________。
③整个反应过程中活化能最大的反应是第______步(填标号)。
(3)反应速率方程可表示反应物浓度与反应速率的定量关系。NO与反应的速率方程为(k、m、n待测,其中k为常数,一般只受温度影响,指数m、n可以通过实验进行测定)。
已知在时,不同浓度NO与对应的反应速率如下表所示:
序号 速率/()
①
②
③
可以推测,速率方程中的______,______;该反应速率表达式为______。
Ⅱ. 催化剂参与反应过程,能加快反应速率。
(4)的反应速率很慢,NO和都可以作为该反应的催化剂,快速生成。NO做催化剂时发生两步基元反应: 、 。请结合催化剂的特点,在下图中画出加入催化剂时的能量变化过程(在图上画出)(已知、均小于0)。
湖南师大附中2023—2024学年度高一第二学期期末考试
化学参考答案
一、选择题(本题共14小题,每小题只有一项符合题意,每小题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D C A C C C D C A C D C C C
二、非选择题(本题共4小题,共58分)
15.(13分,除标注外,每空2分)
(1)圆底烧瓶(1分) 吸收尾气中的,防止污染空气 b
(2)
(3)氨气极易溶于水,先通氨气,使溶液呈碱性,有利于吸收更多,提高的产率
(4)
(5)取适量样品于试管中,加水溶解,加入足量稀盐酸酸化后,滴加氯化钡溶液,若无沉淀产生,说明样品未被氧化,反之,则被氧化
16.(15分,除标注外,每空2分)
(1) 羟基、羧基 加成反应(1分)
(2)
(3)bc
(4)
(5)
17.(16分,除标注外,每空2分)
(1)-415.5
(2)① ②-117 ③
(3)①玻璃搅拌器(1分) 偏大 ②确保HCl反应完全(1分)
(4) acd
18.(14分,除标注外,每空2分)
(1)<(1分)
(2)① ②和 ③ii(1分)
(3)2 1
(4)
化 学
时量:75分钟 满分:100分
可能用到的相对原子质量:H~1 C~12 N~14
一、选择题(本题共14小题,每小题只有一项符合题意,每小题3分,共42分)
1. 绿色化学是我们追求的目标,下列最符合“原子经济性反应”的是( )
A. 用碳还原二氧化硅制备高纯硅 B. 以铜和浓硝酸为原料生产硝酸铜
C. 用甲烷与氯气制备一氯甲烷 D. 乙烯与氧气在Ag催化下制备环氧乙烷
2. 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A. 质量数为14的碳原子: B. 丙烯的键线式:
C. 的电子式为 D. 的结构示意图:
3. 下列实验方案有误的是( )
实验方案
目的 A. 实验室制备光亮的银镜 B. 比较乙醇中羟基氢原子和水分子中氢原子的活泼性
实验方案
目的 C. 检验石蜡油分解气中是否含有不饱和烃 D. 实验室制备乙酸乙酯
4. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A. 反应开始到10s时,用Z表示的反应速率为
B. 在10s时,Y的转化率为21%
C. 反应的化学方程式为
D. 当容器内压强不变时,反应达到平衡
5. 类比法是化学上研究物质的重要方法之一,下列类比结果正确的是( )
A. 铜与氯气反应生成,则铁与氯气反应也生成
B. 工业上电解熔融的冶炼Mg,则也可电解熔融的冶炼Al
C. 王水能溶解铂,则一定浓度的和HCl的混合溶液也可能溶解铂
D. 碳酸钙的分解反应是吸热反应,则过氧化氢的分解反应也为吸热反应
6. 化石燃料的综合利用有利于环境保护,提高经济效益,如图是石油分馏塔的示意图。下列有关叙述正确的是( )
A. 石油的分馏、煤的干馏都是物理变化 B. 煤中含苯、甲苯、二甲苯
C. 对重油加工处理可以获得沥青、润滑油等产品 D. a、b、c三种馏分中a的沸点最高
7. 浓硫酸是实验室常用的试剂之一。将浓硫酸分别和三种钠盐反应,现象如图所示。下列分析正确的是( )
A. ①②③均体现了浓硫酸的强氧化性
B. 对比①和②可以说明还原性:
C. ②中试管口白雾是盐酸小液滴,说明酸性:
D. ③中气体使溴水褪色的原理与使品红溶液褪色的原理不同
8. 用如图所示装置来测定某原电池工作时,在一段时间内通过导线的电子的物质的量。量筒的规格为1000mL,电极材料是铁片和铜片。下列有关说法正确的是( )
A. b电极材料是铁片
B. 电子由b电极经导线流向a电极
C. 若用浓硝酸代替稀硫酸,溶液中的移向铜片
D. 当量筒中收集到672mL(标准状况)气体时,通过导线的电子的物质的量为0.03mol
9. 化合物M是一种制造压塑粉的原料,结构简式如图所示,其组成元素X、Y、Z、W位于短周期,质子数依次增大且满足。下列说法正确的是( )
A. 原子半径: B. 氧化物对应水化物的酸性:
C. X、Z、W形成的化合物一定不含有离子键 D. 简单氢化物稳定性:
10. 莽草酸可以合成甲流药物奥司他韦,部分路线如图。下列说法正确的是( )
A. 奥司他韦分子式为
B. 莽草酸与中间体互为同系物
C. 莽草酸既可以发生氧化反应,又可以发生还原反应
D. 莽草酸最多能消耗
11. 下列有关热化学方程式的说法正确的是( )
A. 甲烷的燃烧热,则
B. 将和置于密闭的容器中充分反应生成,放热19.3kJ,则其热化学反应方程式为:
C. HCl和NaOH反应的中和热,则
D. 已知: , ,则
12. 丙烯与HBr的加成反应可产生两种可能产物,其部分反应进程及能量变化如图。下列说法正确的是( )
A. 丙烯与HBr加成的反应是基元反应
B. 从总能量上看,Ⅰ和Ⅱ相比较,Ⅱ较为稳定
C. 决定两种加成方式快慢的关键步骤分别是①和③
D. 相比之下,为优势产物,是因为其产生路径活化能更低,活化分子百分比更大
13. 工业上以某种矿石(含杂质)为原料冶炼铝的工艺流程如图。下列对该工艺流程的判断正确的是( )
A. 试剂X可以为盐酸,沉淀中含有铁的化合物
B. 反应Ⅱ中,也可换成稀硫酸、稀盐酸
C. 反应Ⅱ的离子方程式为
D. 工业上还可采用Fe还原的方法制Al,成本更低
14. 在标准压强101kPa、298K下,由最稳定的单质合成物质B的反应焓变,叫做物质B的标准摩尔生成焓,用符号表示,部分物质的如图所示。已知:、、的标准摩尔生成焓为0。下列有关判断正确的是( )
A. 根据图中信息,可判断热稳定性:
B.
C. 的键能小于与的键能之和
D. 标准燃烧热的热化学方程式为
二、非选择题(本题共4小题,共58分)
15.(13分)亚硫酸氢铵()常在制药工业中作还原剂,既能与酸作用也能和碱作用,在空气中易被氧化,遇热分解放出。某化学学习小组设计如图装置(加热和夹持装置已省略)制备亚硫酸氢铵,回答下列问题:
已知:是一种酸性氧化物。
(1)甲装置中盛装铜片的仪器名称为______;丙装置的作用是______;丁装置用于吸收多余的,则丁装置中的试剂为______(填标号)。
a. 无水 b. 碱石灰 c. d. 浓硫酸
(2)戊装置的试管内发生反应的化学方程式为______。
(3)实验开始时,先关闭,打开,一段时间后,关闭,打开。先打开后打开的原因可能是______。
(4)写出亚硫酸氢铵与等物质的量的氢氧化钡溶液反应的离子方程式:______。
(5)亚硫酸氢铵有较强的还原性,设计实验检验制备的亚硫酸氢铵样品是否被氧化:______(填操作、现象及相应的结论,可供选择的试剂:水、稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液)。
16.(15分)以淀粉为主要原料模拟合成其他重要化工原料的流程如图所示,据图回答下列问题。
已知:①烃E是一种基础化工原料,标准状况下密度为。
②;两个羟基连在同一个碳原子上不稳定。
③G能使溴水褪色;H有果香味。
(1)A的结构简式为______,乳酸分子中的官能团的名称为______,②的反应类型为______。
(2)写出下列两个反应的化学方程式(有机物用结构简式表示):
反应①__________________;
反应③__________________。
(3)下列说法正确的是______(填标号)。
a. 淀粉、油脂、蛋白质和纤维素都属于天然高分子
b. D可与新制氢氧化铜悬浊液反应生成蓝色溶液
c. B、C和G均能使酸性高锰酸钾溶液褪色
d. A→B的反应类型为水解反应
e. B和F属于同系物,D和G也属于同系物
(4)等物质的量的D、乳酸和G分别与足量金属钠反应,产生氢气的物质的量之比为______。
(5)久置的H自身会发生聚合反应得到弹性较好的聚合物,该聚合物的结构简式为______。
17.(16分)氯及其化合物在生产、生活中有着广泛的应用,请回答下列问题:
(1)已知:①
②
则反应 ______。
(2)几种含氯离子的相对能量如下表所示:
离子
相对能量/() 0 60 101 63 38
①在上述五种离子中,最不稳定的离子是______(填离子符号)。
②反应的______。
③写出由反应生成和的热化学方程式:____________。
(3)某实验小组设计用的盐酸100mL与的NaOH溶液100mL置于如图所示的装置中进行测定中和反应反应热的实验。
①该装置中缺少的一种玻璃仪器是______;大烧杯杯口若不盖泡沫塑料板,测得中和反应的反应热将______(填“偏大”“偏小”或“无影响”)。
②实验中,所用NaOH稍过量的原因是____________。
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各100mL,并记录原始数据:
实验序号 起始温度 终止温度 温差
盐酸 NaOH溶液 平均值
1 25.1 24.9 28.1
2 25.1 25.1 28.3
3 25.1 25.1 28.1
已知盐酸、NaOH溶液密度均近似为。中和后混合液,则该中和反应生成水的反应热______(保留到小数点后1位)。
根据计算结果,分析上述实验产生偏差的原因可能是______(填标号)。
a. 实验装置保温、隔热效果差
b. 量筒量取溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
18.(14分)研究反应机理对于认识和调控化学反应意义重大,下面是NO、等大气污染物治理中的相关反应机理,回答下列问题:
Ⅰ. NO在一定条件下与反应生成可参与大气生态循环的无毒气体,反应原理为:,已知每生成,放出166kJ的热量。
(1)向容器中充入和,充分反应后,放出的热量______664kJ(填“>”“<”或“=”)。
(2)研究发现,NO与的反应过程可分为三步,每步均为基元反应:
i. (快) ii. (慢)
iii. ……(快)
①第iii 步对应的基元反应是____________。
②该反应的中间产物是____________。
③整个反应过程中活化能最大的反应是第______步(填标号)。
(3)反应速率方程可表示反应物浓度与反应速率的定量关系。NO与反应的速率方程为(k、m、n待测,其中k为常数,一般只受温度影响,指数m、n可以通过实验进行测定)。
已知在时,不同浓度NO与对应的反应速率如下表所示:
序号 速率/()
①
②
③
可以推测,速率方程中的______,______;该反应速率表达式为______。
Ⅱ. 催化剂参与反应过程,能加快反应速率。
(4)的反应速率很慢,NO和都可以作为该反应的催化剂,快速生成。NO做催化剂时发生两步基元反应: 、 。请结合催化剂的特点,在下图中画出加入催化剂时的能量变化过程(在图上画出)(已知、均小于0)。
湖南师大附中2023—2024学年度高一第二学期期末考试
化学参考答案
一、选择题(本题共14小题,每小题只有一项符合题意,每小题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D C A C C C D C A C D C C C
二、非选择题(本题共4小题,共58分)
15.(13分,除标注外,每空2分)
(1)圆底烧瓶(1分) 吸收尾气中的,防止污染空气 b
(2)
(3)氨气极易溶于水,先通氨气,使溶液呈碱性,有利于吸收更多,提高的产率
(4)
(5)取适量样品于试管中,加水溶解,加入足量稀盐酸酸化后,滴加氯化钡溶液,若无沉淀产生,说明样品未被氧化,反之,则被氧化
16.(15分,除标注外,每空2分)
(1) 羟基、羧基 加成反应(1分)
(2)
(3)bc
(4)
(5)
17.(16分,除标注外,每空2分)
(1)-415.5
(2)① ②-117 ③
(3)①玻璃搅拌器(1分) 偏大 ②确保HCl反应完全(1分)
(4) acd
18.(14分,除标注外,每空2分)
(1)<(1分)
(2)① ②和 ③ii(1分)
(3)2 1
(4)
同课章节目录
