山东省滨州市2023-2024学年高一下学期期末考试化学试题(无答案)
文档属性
| 名称 | 山东省滨州市2023-2024学年高一下学期期末考试化学试题(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-07 00:00:00 | ||
图片预览




文档简介
试卷类型:A
滨州市2023-2024学年高一下学期期末考试化学试题
2024.7
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共10页,满分100分,考试时间90分钟。
注意事项:
1..答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。将条形码横贴在答题卡对应位置“条形码粘贴处”。
2.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
3.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
4.考试结束,监考人员将答题卡收回。
可能用到的元素相对原子质量:H 1 Li 7 C 12 N 14 O 16 Mn 55
第Ⅰ卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.科技创新是新质生产力的核心要素,科技的发展离不开化学。下列说法错误的是( )
A.“国产大飞机C919”使用的航空煤油主要由煤的干馏得到
B.新型药物(VV116)所含氕与氘互为同位素,其物理性质不同
C.利用火星陨石制作的OER电催化剂中所含镍元素属于过渡元素
D.福建号航母使用高性能富锌底漆利用了牺牲阳极保护法保护船体
2.下列化学用语正确的是( )
A.的电子式:
B.和的结构示意图:
C.聚丙烯腈的结构简式:
D.四氯乙烯的空间填充模型:
3.利用反应可得到金属表面脱氧剂。下列叙述正确的是( )
A.和为共价化合物,均只含极性键
B.NaClO和NaCl为离子化合物,固体可以导电
C.氢原子与氧原子形成的过程可表示为
D.分子空间结构呈三角形
4.M是一种重要的有机合成中间体,结构简式如图。下列关于M的说法正确的是( )
A.分子式为
B.可以发生取代、氧化、加聚反应
C.1mol M最多与2mol NaOH反应
D.能使溴水和高锰酸钾溶液褪色,且褪色原理相同
5.W、X、Y、Z为原子序数依次增大的短周期主族元素。W与Y同族,Y的原子序数是W的2倍,X的次外层电子数是最外层电子数的2倍。下列说法正确的是( )
A.气态氢化物的稳定性:WB.最高价氧化物对应水化物的酸性:X>Y
C.W、X与Z三种元素的单质中,W单质的熔点最高
D.Z单质能与水反应,生成一种具有漂白性的物质
6.下列说法正确的是( )
A.灼烧白色粉末,火焰呈黄色,证明原粉末中有,无
B.实验室中通常用NaOH溶液除去乙酸乙酯中混有的乙醇和乙酸
C.中和反应的反应热测定实验中,分批加入NaOH溶液,测得的反应热误差更小
D.向蛋白质溶液中加入饱和溶液,蛋白质析出,再加水仍能溶解
7.下列实验装置能达到实验目的的是( )
A.电解精炼铜
B.除去甲烷中混有的少量乙烯
C.通过测定氧气的体积计算的分解速率
D.检验石蜡分解产物中是否含有不饱和烃
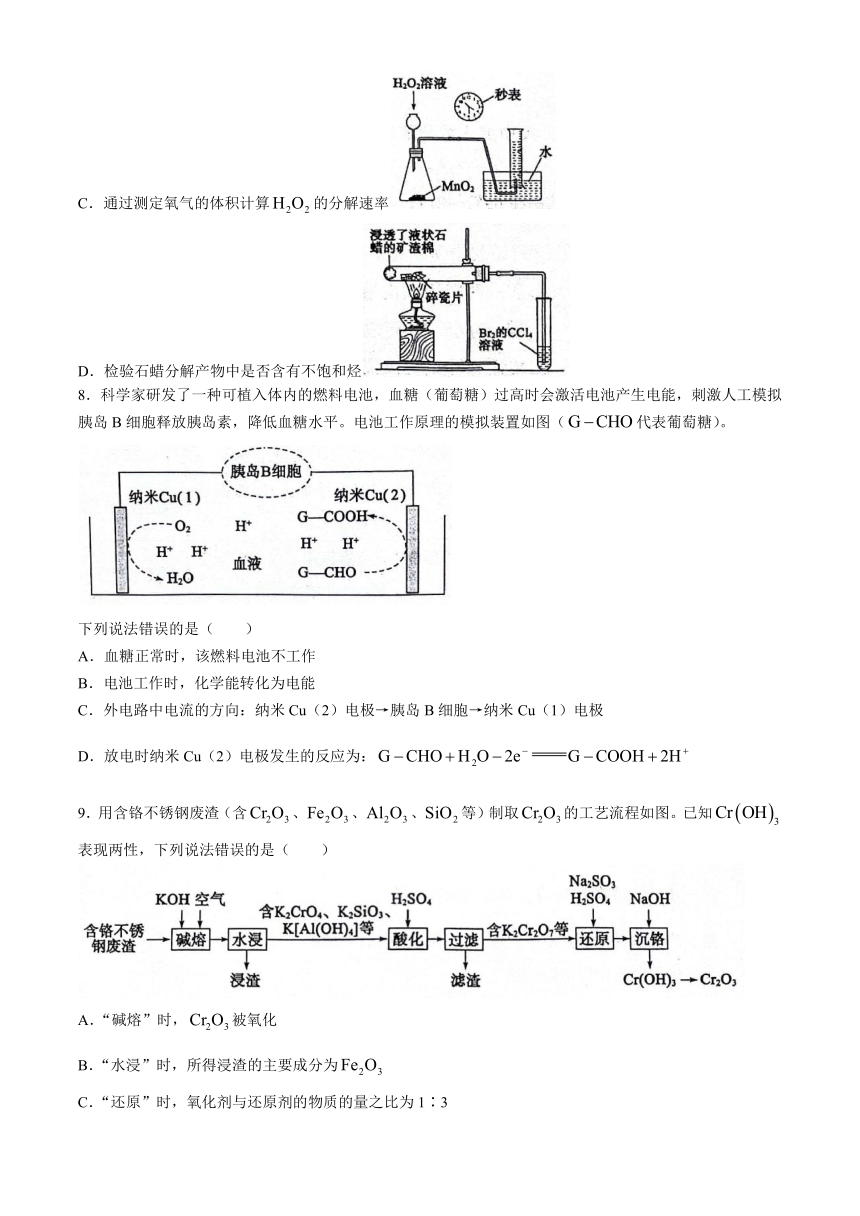
8.科学家研发了一种可植入体内的燃料电池,血糖(葡萄糖)过高时会激活电池产生电能,刺激人工模拟胰岛B细胞释放胰岛素,降低血糖水平。电池工作原理的模拟装置如图(代表葡萄糖)。
下列说法错误的是( )
A.血糖正常时,该燃料电池不工作
B.电池工作时,化学能转化为电能
C.外电路中电流的方向:纳米Cu(2)电极→胰岛B细胞→纳米Cu(1)电极
D.放电时纳米Cu(2)电极发生的反应为:
9.用含铬不锈钢废渣(含、、、等)制取的工艺流程如图。已知表现两性,下列说法错误的是( )
A.“碱熔”时,被氧化
B.“水浸”时,所得浸渣的主要成分为
C.“还原”时,氧化剂与还原剂的物质的量之比为1∶3
D.“沉铬”时,为确保沉淀完全,应加入过量的NaOH溶液
10.反应经历两步:①;②。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图。下列说法正确的是( )
A.a为随t的变化曲线 B.时,反应①和②均达到平衡状态
C.时,Y的消耗速率大于生成速率 D.后,
二、选择题:本题共5小题,每小14分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验的方案设计、现象和结论均正确的是( )
实验目的 方案设计 现象 结论
A 探究溴水与苯能否发生反应 向溴水中加入苯,振荡后静置 水层颜色变浅 溴水与苯发生了加成反应
B 探究钠与乙醇能否发生反应 向盛有医用酒精的试管中加入一小块金属钠 有气泡产生 钠能与乙醇发生反应
C 检验淀粉是否发生了水解 将加入少量唾液的淀粉溶液,水浴加热一段时间后,加入碘水数滴 溶液变蓝 淀粉未发生水解
D 比较镁、铝元素原子失电子能力的相对强弱 将表面积相同的镁条和铝条用砂纸打磨后,同时加入同浓度同体积的稀盐酸中 镁条与盐酸反应产生气泡的速率较快 失电子能力:Mg>Al
12.1,3-丁二烯()与HBr发生加成反应分两步:
第一步:进攻1,3一丁二烯生成碳正离子()
第二步:进攻碳正离子完成1,2-加成或1,4-加成
反应进程中的能量变化如图。
已知:
①
②在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。
下列说法正确的是( )
A.
B.选择高效催化剂可加快1,2-加成和1,4-加成的反应速率,、均减小
C.1,2-加成产物比1,4-加成产物稳定
D.从0℃升至40℃,1,2-加成正反应速率减小,1,4-加成正反应速率增大
13.己二酸()是一种重要的化工原料,合成路线有如下两种:
路线一:
路线二:
下列说法正确的是( )
A.的二氯代物有4种(不考虑立体异构)
B.己二酸与乙酸互为同系物
C.中六个碳原子共平面
D.与路线一相比,路线二更符合绿色化学的要求
14.实验室用如下装置(夹持和加热装置略)制备乙酸异戊酯(沸点142℃),其反应原理为
。
已知:实验中利用环己烷一水的共沸体系(沸点69℃)带出水分;体系中沸点最低的有机物是环己烷(沸点81℃)。
下列说法错误的是( )
A.实验时应依次向装置A中加入浓硫酸、乙酸、异戊醇、环己烷
B.装置A中的温度需控制在69℃~81℃
C.乙酸异戊酯在装置B中收集
D.以共沸体系带出水分促使反应正向进行
15.锂被誉为“白色石油”,海水中锂的总含量为陆地总含量的1.6万倍,可利用电解法富集海水中的锂,装置如图。工作时,向所在腔室通入海水,启动电源1,海水中的嵌入结构中形成;一段时间后,关闭电源1和海水通道,启动电源2,向电极2上通氧气。
下列说法正确的是( )
A.启动电源1,腔室1溶液中的阳离子向电极1附近迁移
B.启动电源1,电极1附近溶液的pH增大
C.启动电源2,阳极发生反应
D.启动电源2,电极2上每消耗5. 6L(标准状况),理论上腔室2溶液质量增加15g
第Ⅱ卷 非选择题(共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)离子液体是指在室温或接近室温时呈液态的盐类物质,某离子液体的结构如图。X、Y、Z、Q、W为原子序数依次增大的短周期主族元素,Q是地壳中含量最多的金属元素。
回答下列问题:
(1)该离子液体中存在的化学键类型有______。Y在元素周期表中的位置为______,Z的气态氢化物的电子式为______。
(2)Z、Q、W形成的简单离子半径由大到小的顺序为______(用离子符号表示)。Q的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为______。
(3)X和Z形成的18电子化合物甲是一种液态火箭燃料,已知甲的摩尔燃烧焓(298 K,101 kPa)为-622,写出甲在氧气中完全燃烧的热化学方程式______。
(4)Y、Z元素原子得电子能力的相对强弱:Y______Z(填“>”或“<”),写出能证明两者得电子能力强弱的离子方程式______。
17.(12分)实验室以一种尾矿(含、及铁元素的化合物)为原料提取锂的过程如下:
已知:
①TBP为萃取剂、为协萃剂,与结合成的形式被TBP萃取。
②浓盐酸与反应生成,易溶于有机溶剂。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,其目的是______。“滤渣1”的主要成分为______(填化学式),“氧化”温度不宜过高的原因是______。
(2)“萃取”、“反萃取”时需要使用分液漏斗,下列有关分液漏斗使用的说法错误的是______(填标号)。
A.使用前有两处需检查是否漏水
B.振荡萃取,操作如图
C.打开活塞分液,操作如图
D.分液时,下层液体从下口流出后,关闭活塞,上层液体从上口倒出
(3)“反萃取”的目的是将TBP中的转移到水层,加入的反萃取剂为______(填名称),为使尽多地发生上述转移,应采取的实验操作有______(写一条即可)。
(4)尾矿(含锂的质量分数为w%)的质量为m kg,“反萃取”后得到的V L水层中,该实验过程中锂的回收率为______%。(已知:,用含w、m、c、V的代数式表示)。
18.(12分)利用催化转化反应,可有效地将汽车尾气中的CO和NO同时除去。
(1)已知:
计算: ______。
(2)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度随时间t的变化曲线如图。
①0~2s内的平均反应速率______。
②下列有关该反应的说法正确的是______(填标号)。
A.体系中混合气体的平均摩尔质量不变时,该反应达到平衡状态
B.体系中保持不变时,该反应达到平衡状态
C.一定压强下充入惰性气体,、均不变
D.5s时,
(3)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T/℃ NO初始浓度 /() CO初始浓度 /() 催化剂的比表面积 /()
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①______。
②探究温度对该反应速率影响规律的实验有______(填实验编号)。
③实验Ⅰ和实验Ⅱ中,随时间t的变化曲线如图,表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
19.(12分)肉桂酸异丙酯(G)常用于饮料、冰制食品的调味与增香,合成路线如下:
已知:,R为烃基。
回答下列问题:
(1)工业上,以石油分馏产物为原料获得E的方法叫作______;写出E的化学名称______。
(2)B的结构简式为______;EF的反应类型为______;写出G中含氧官能团名称______。D+F→G化学方程式为______。
(3)D的同分异构体中,同时满足下列条件的有______种(不考虑立体异构)。
①能使溴的四氯化碳溶液褪色
②能与碳酸氢钠溶液反应生成
③含有苯环
(4)根据上述信息,设计以乙醇为主要原料制备的合成路线(无机试剂任选)。
合成路线表示方法:
20.(12分)乙烯的产量是衡量一个国家石油化工产业发展水平的重要标志之一。
(1)实验室制备乙烯的原理为,实验过程中会产生少量的。为验证反应所得混合气体中含有和,某同学设计实验装置如下。
①仪器A名称为______。在仪器A中加入乙醇和浓硫酸的混合物,再放入几块碎瓷片的目的是______。
②Ⅱ、Ⅲ、Ⅳ、Ⅴ装置中盛放的试剂依次是______(填标号,某些试剂可重复使用)。
a.品红溶液 b.NaOH溶液 c.酸性溶液
能说明混合气体中含有乙烯的现象是______。
(2)二氧化碳与氢气催化合成乙烯有助于研发“绿色”的塑料生产技术,反应如下:
一定条件下,向体积为V L的恒容密闭容器中通入1mol 和3mol 发生上述反应,达到平衡时,容器中为a mol,CO为6 mol,此时的浓度为______(用含a、b、V的代数式表示)。
(3)利用电解法可将转化为同时得到,装置如图。
①电解时,电极Ⅰ与电源的______极相连(填“正”或“负”),在电极Ⅱ上生成的电极反应为______。
②电解一段时间后,测得部分还原产物、的选择性(S)及电解效率()如下表所示。
2% 8%
15%
选择性(S)和电解效率()的定义(X代表或):
计算:______。
滨州市2023-2024学年高一下学期期末考试化学试题
2024.7
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共10页,满分100分,考试时间90分钟。
注意事项:
1..答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。将条形码横贴在答题卡对应位置“条形码粘贴处”。
2.第Ⅰ卷每小题选出答案后,用2B铅笔在答题卡上将对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
3.第Ⅱ卷所有题目的答案,考生须用0.5毫米黑色签字笔答在答题卡规定的区域内,在试卷上答题不得分。
4.考试结束,监考人员将答题卡收回。
可能用到的元素相对原子质量:H 1 Li 7 C 12 N 14 O 16 Mn 55
第Ⅰ卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.科技创新是新质生产力的核心要素,科技的发展离不开化学。下列说法错误的是( )
A.“国产大飞机C919”使用的航空煤油主要由煤的干馏得到
B.新型药物(VV116)所含氕与氘互为同位素,其物理性质不同
C.利用火星陨石制作的OER电催化剂中所含镍元素属于过渡元素
D.福建号航母使用高性能富锌底漆利用了牺牲阳极保护法保护船体
2.下列化学用语正确的是( )
A.的电子式:
B.和的结构示意图:
C.聚丙烯腈的结构简式:
D.四氯乙烯的空间填充模型:
3.利用反应可得到金属表面脱氧剂。下列叙述正确的是( )
A.和为共价化合物,均只含极性键
B.NaClO和NaCl为离子化合物,固体可以导电
C.氢原子与氧原子形成的过程可表示为
D.分子空间结构呈三角形
4.M是一种重要的有机合成中间体,结构简式如图。下列关于M的说法正确的是( )
A.分子式为
B.可以发生取代、氧化、加聚反应
C.1mol M最多与2mol NaOH反应
D.能使溴水和高锰酸钾溶液褪色,且褪色原理相同
5.W、X、Y、Z为原子序数依次增大的短周期主族元素。W与Y同族,Y的原子序数是W的2倍,X的次外层电子数是最外层电子数的2倍。下列说法正确的是( )
A.气态氢化物的稳定性:W
C.W、X与Z三种元素的单质中,W单质的熔点最高
D.Z单质能与水反应,生成一种具有漂白性的物质
6.下列说法正确的是( )
A.灼烧白色粉末,火焰呈黄色,证明原粉末中有,无
B.实验室中通常用NaOH溶液除去乙酸乙酯中混有的乙醇和乙酸
C.中和反应的反应热测定实验中,分批加入NaOH溶液,测得的反应热误差更小
D.向蛋白质溶液中加入饱和溶液,蛋白质析出,再加水仍能溶解
7.下列实验装置能达到实验目的的是( )
A.电解精炼铜
B.除去甲烷中混有的少量乙烯
C.通过测定氧气的体积计算的分解速率
D.检验石蜡分解产物中是否含有不饱和烃
8.科学家研发了一种可植入体内的燃料电池,血糖(葡萄糖)过高时会激活电池产生电能,刺激人工模拟胰岛B细胞释放胰岛素,降低血糖水平。电池工作原理的模拟装置如图(代表葡萄糖)。
下列说法错误的是( )
A.血糖正常时,该燃料电池不工作
B.电池工作时,化学能转化为电能
C.外电路中电流的方向:纳米Cu(2)电极→胰岛B细胞→纳米Cu(1)电极
D.放电时纳米Cu(2)电极发生的反应为:
9.用含铬不锈钢废渣(含、、、等)制取的工艺流程如图。已知表现两性,下列说法错误的是( )
A.“碱熔”时,被氧化
B.“水浸”时,所得浸渣的主要成分为
C.“还原”时,氧化剂与还原剂的物质的量之比为1∶3
D.“沉铬”时,为确保沉淀完全,应加入过量的NaOH溶液
10.反应经历两步:①;②。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图。下列说法正确的是( )
A.a为随t的变化曲线 B.时,反应①和②均达到平衡状态
C.时,Y的消耗速率大于生成速率 D.后,
二、选择题:本题共5小题,每小14分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验的方案设计、现象和结论均正确的是( )
实验目的 方案设计 现象 结论
A 探究溴水与苯能否发生反应 向溴水中加入苯,振荡后静置 水层颜色变浅 溴水与苯发生了加成反应
B 探究钠与乙醇能否发生反应 向盛有医用酒精的试管中加入一小块金属钠 有气泡产生 钠能与乙醇发生反应
C 检验淀粉是否发生了水解 将加入少量唾液的淀粉溶液,水浴加热一段时间后,加入碘水数滴 溶液变蓝 淀粉未发生水解
D 比较镁、铝元素原子失电子能力的相对强弱 将表面积相同的镁条和铝条用砂纸打磨后,同时加入同浓度同体积的稀盐酸中 镁条与盐酸反应产生气泡的速率较快 失电子能力:Mg>Al
12.1,3-丁二烯()与HBr发生加成反应分两步:
第一步:进攻1,3一丁二烯生成碳正离子()
第二步:进攻碳正离子完成1,2-加成或1,4-加成
反应进程中的能量变化如图。
已知:
①
②在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。
下列说法正确的是( )
A.
B.选择高效催化剂可加快1,2-加成和1,4-加成的反应速率,、均减小
C.1,2-加成产物比1,4-加成产物稳定
D.从0℃升至40℃,1,2-加成正反应速率减小,1,4-加成正反应速率增大
13.己二酸()是一种重要的化工原料,合成路线有如下两种:
路线一:
路线二:
下列说法正确的是( )
A.的二氯代物有4种(不考虑立体异构)
B.己二酸与乙酸互为同系物
C.中六个碳原子共平面
D.与路线一相比,路线二更符合绿色化学的要求
14.实验室用如下装置(夹持和加热装置略)制备乙酸异戊酯(沸点142℃),其反应原理为
。
已知:实验中利用环己烷一水的共沸体系(沸点69℃)带出水分;体系中沸点最低的有机物是环己烷(沸点81℃)。
下列说法错误的是( )
A.实验时应依次向装置A中加入浓硫酸、乙酸、异戊醇、环己烷
B.装置A中的温度需控制在69℃~81℃
C.乙酸异戊酯在装置B中收集
D.以共沸体系带出水分促使反应正向进行
15.锂被誉为“白色石油”,海水中锂的总含量为陆地总含量的1.6万倍,可利用电解法富集海水中的锂,装置如图。工作时,向所在腔室通入海水,启动电源1,海水中的嵌入结构中形成;一段时间后,关闭电源1和海水通道,启动电源2,向电极2上通氧气。
下列说法正确的是( )
A.启动电源1,腔室1溶液中的阳离子向电极1附近迁移
B.启动电源1,电极1附近溶液的pH增大
C.启动电源2,阳极发生反应
D.启动电源2,电极2上每消耗5. 6L(标准状况),理论上腔室2溶液质量增加15g
第Ⅱ卷 非选择题(共60分)
三、非选择题:本题共5小题,共60分。
16.(12分)离子液体是指在室温或接近室温时呈液态的盐类物质,某离子液体的结构如图。X、Y、Z、Q、W为原子序数依次增大的短周期主族元素,Q是地壳中含量最多的金属元素。
回答下列问题:
(1)该离子液体中存在的化学键类型有______。Y在元素周期表中的位置为______,Z的气态氢化物的电子式为______。
(2)Z、Q、W形成的简单离子半径由大到小的顺序为______(用离子符号表示)。Q的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为______。
(3)X和Z形成的18电子化合物甲是一种液态火箭燃料,已知甲的摩尔燃烧焓(298 K,101 kPa)为-622,写出甲在氧气中完全燃烧的热化学方程式______。
(4)Y、Z元素原子得电子能力的相对强弱:Y______Z(填“>”或“<”),写出能证明两者得电子能力强弱的离子方程式______。
17.(12分)实验室以一种尾矿(含、及铁元素的化合物)为原料提取锂的过程如下:
已知:
①TBP为萃取剂、为协萃剂,与结合成的形式被TBP萃取。
②浓盐酸与反应生成,易溶于有机溶剂。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,其目的是______。“滤渣1”的主要成分为______(填化学式),“氧化”温度不宜过高的原因是______。
(2)“萃取”、“反萃取”时需要使用分液漏斗,下列有关分液漏斗使用的说法错误的是______(填标号)。
A.使用前有两处需检查是否漏水
B.振荡萃取,操作如图
C.打开活塞分液,操作如图
D.分液时,下层液体从下口流出后,关闭活塞,上层液体从上口倒出
(3)“反萃取”的目的是将TBP中的转移到水层,加入的反萃取剂为______(填名称),为使尽多地发生上述转移,应采取的实验操作有______(写一条即可)。
(4)尾矿(含锂的质量分数为w%)的质量为m kg,“反萃取”后得到的V L水层中,该实验过程中锂的回收率为______%。(已知:,用含w、m、c、V的代数式表示)。
18.(12分)利用催化转化反应,可有效地将汽车尾气中的CO和NO同时除去。
(1)已知:
计算: ______。
(2)一定温度下,向某密闭容器中充入等物质的量的NO和CO,发生上述反应。测得NO浓度随时间t的变化曲线如图。
①0~2s内的平均反应速率______。
②下列有关该反应的说法正确的是______(填标号)。
A.体系中混合气体的平均摩尔质量不变时,该反应达到平衡状态
B.体系中保持不变时,该反应达到平衡状态
C.一定压强下充入惰性气体,、均不变
D.5s时,
(3)增大催化剂的比表面积可提高该反应速率,为了探究温度、催化剂的比表面积对该反应速率的影响规律,某同学设计了如下三组实验。
实验编号 T/℃ NO初始浓度 /() CO初始浓度 /() 催化剂的比表面积 /()
Ⅰ 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①______。
②探究温度对该反应速率影响规律的实验有______(填实验编号)。
③实验Ⅰ和实验Ⅱ中,随时间t的变化曲线如图,表示实验Ⅱ的是曲线______(填“甲”或“乙”)。
19.(12分)肉桂酸异丙酯(G)常用于饮料、冰制食品的调味与增香,合成路线如下:
已知:,R为烃基。
回答下列问题:
(1)工业上,以石油分馏产物为原料获得E的方法叫作______;写出E的化学名称______。
(2)B的结构简式为______;EF的反应类型为______;写出G中含氧官能团名称______。D+F→G化学方程式为______。
(3)D的同分异构体中,同时满足下列条件的有______种(不考虑立体异构)。
①能使溴的四氯化碳溶液褪色
②能与碳酸氢钠溶液反应生成
③含有苯环
(4)根据上述信息,设计以乙醇为主要原料制备的合成路线(无机试剂任选)。
合成路线表示方法:
20.(12分)乙烯的产量是衡量一个国家石油化工产业发展水平的重要标志之一。
(1)实验室制备乙烯的原理为,实验过程中会产生少量的。为验证反应所得混合气体中含有和,某同学设计实验装置如下。
①仪器A名称为______。在仪器A中加入乙醇和浓硫酸的混合物,再放入几块碎瓷片的目的是______。
②Ⅱ、Ⅲ、Ⅳ、Ⅴ装置中盛放的试剂依次是______(填标号,某些试剂可重复使用)。
a.品红溶液 b.NaOH溶液 c.酸性溶液
能说明混合气体中含有乙烯的现象是______。
(2)二氧化碳与氢气催化合成乙烯有助于研发“绿色”的塑料生产技术,反应如下:
一定条件下,向体积为V L的恒容密闭容器中通入1mol 和3mol 发生上述反应,达到平衡时,容器中为a mol,CO为6 mol,此时的浓度为______(用含a、b、V的代数式表示)。
(3)利用电解法可将转化为同时得到,装置如图。
①电解时,电极Ⅰ与电源的______极相连(填“正”或“负”),在电极Ⅱ上生成的电极反应为______。
②电解一段时间后,测得部分还原产物、的选择性(S)及电解效率()如下表所示。
2% 8%
15%
选择性(S)和电解效率()的定义(X代表或):
计算:______。
同课章节目录
