1.1.1反应热 课件(共29张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1反应热 课件(共29张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 06:50:31 | ||
图片预览





文档简介
(共29张PPT)
反应热
思考:化学反应带来了什么变化?
物质变化
能量变化
起飞重量约870吨
起飞推力超1000吨
液氢与液氧
煤油与液氧
火箭推进剂
一般选用化学推进剂它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
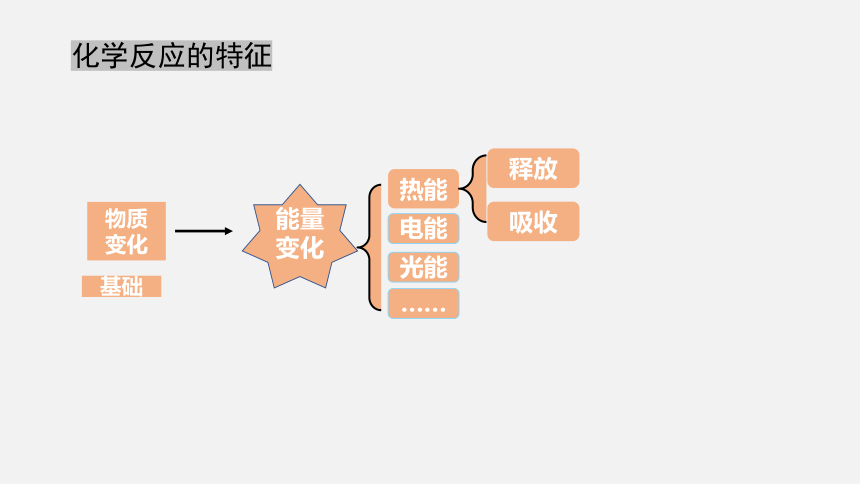
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
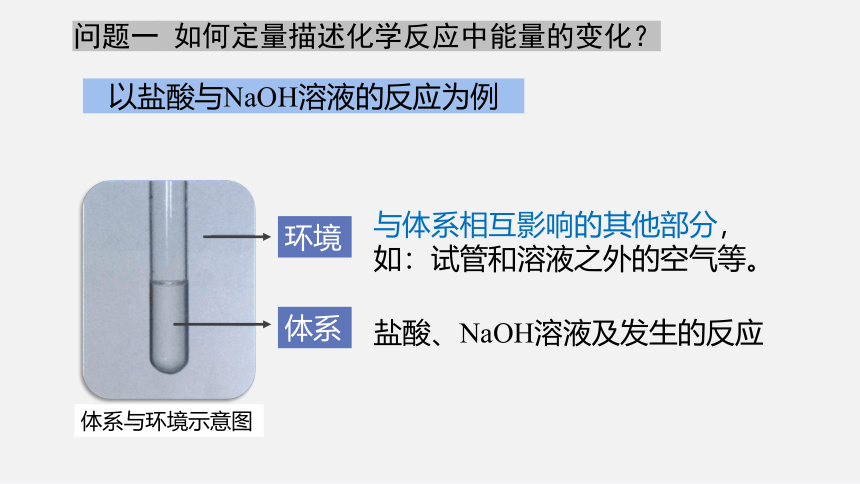
问题一 如何定量描述化学反应中能量的变化?
与体系相互影响的其他部分,
如:试管和溶液之外的空气等。
盐酸、NaOH溶液及发生的反应
以盐酸与NaOH溶液的反应为例
环境
体系
体系与环境示意图
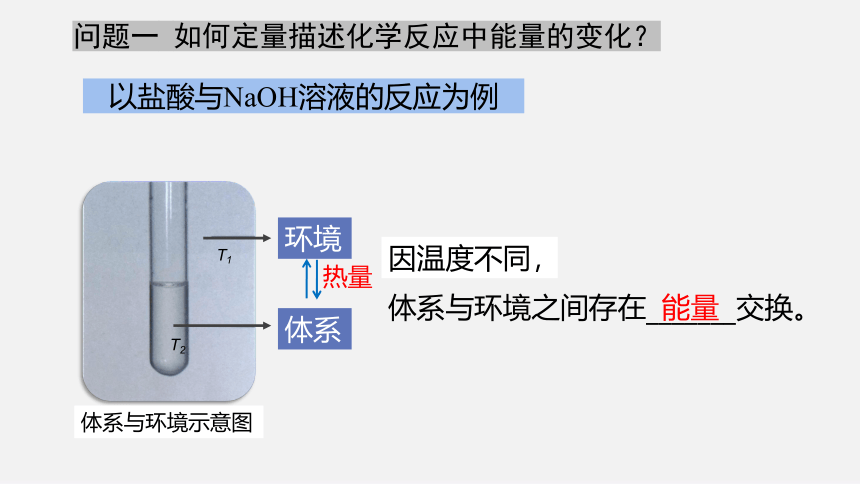
环境
体系
体系与环境示意图
T2
T1
体系与环境之间存在_______交换。
能量
因温度不同,
热量
问题一 如何定量描述化学反应中能量的变化?
以盐酸与NaOH溶液的反应为例
等温条件下,化学体系向环境释放或从环境吸收热量。
称为化学反应的热效应(简称反应热)
注意:
等温含义:反应前后体系的温度相等
反应热的定义
问题二 如何测量化学反应的热量?
现代量热计
保温杯式量热计
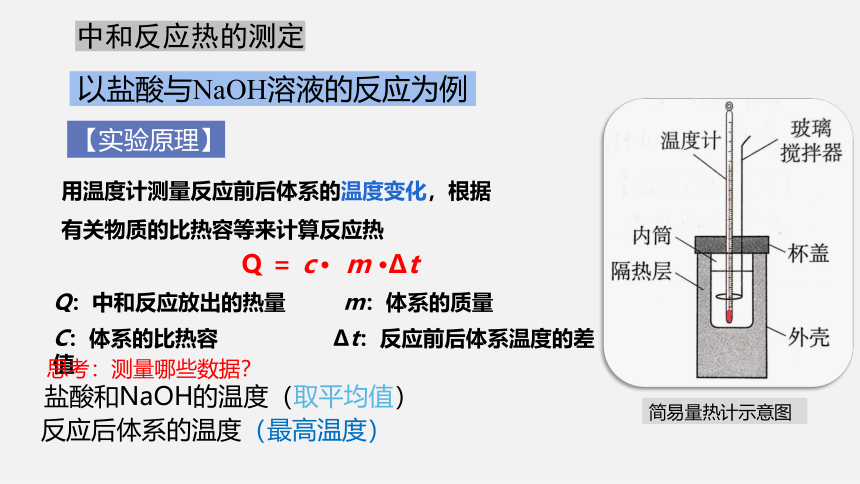
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
Q = c · m ·Δt
Q:中和反应放出的热量 m:体系的质量
C:体系的比热容 Δt:反应前后体系温度的差值
思考:测量哪些数据?
盐酸和NaOH的温度(取平均值)
反应后体系的温度(最高温度)
简易量热计示意图
【实验原理】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
简易量热计示意图
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
保温、隔热、减少热量损失
【实验试剂】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
【实验仪器】
a. 量取50 mL 0.5mol/L盐酸,用温度计测量盐酸的温度t1
用水冲洗干净温度计上的酸。
反应物温度的测量
b. 量取50 mL 0.55mol/L NaOH溶液,用温度计测量其温度t2
防止残留的酸与碱反应,
导致测量的t2数据不准。
NaOH稍过量,确保盐酸完全反应、提高实验准确度。
【实验测量】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(2)打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应体系的温度(t2)
反应后体系温度的测量
(3)重复上述步骤(1)至(2)两次。
【实验过程】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(1)取盐酸温度和NaOH溶液温度的__________记为反应前体系的温度(t1) 。计算温度差(t2 - t1),将数据填入下表。
平均值
(2)取三次测量所得温度差的平均值作为计算依据。
3.4
21.0
21.1
21.3
3.40
3.30
3.50
【数据处理】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
(4)实验数据处理
①为了计算简便,盐酸、氢氧化钠稀溶液的密度近似等于1 g·cm-3,故50ml盐酸的质量为____,50ml氢氧化钠溶液的质量为____,则溶液质量为___
②反应后生成的溶液的比热容c=4.18 J/(g·℃)。
该实验中盐酸和NaOH溶液反应放出的热量是_______________,
生成1mol H2O时放出的热量为 。
0.418(t2 - t1)kJ
0.418(t2 - t1)/ 0.025 kJ
计算: ( m1+m2 ) × c ×( t2 - t1 )/0.025
= 56.8 kJ
50g
50g
100g
中和反应热的测定
在25℃和101kPa下,
_________跟_______的______溶液发生中和反应生成_____________时所释放的热量为 57.3 kJ。
强酸
强碱
稀
1mol水
中和反应热
56.8
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么产生误差?
①装置本身缺陷:
②实验操作:
③数据处理:
1.量取溶液的体积有误差(俯视读数)
2.温度计的读数有误(不是最高点)
3.实验过程中有液体洒在外面
4.混合酸、碱溶液时,动作缓慢,导致实验误差
量热计的保温绝热效果不好
采用近似值计算
酸碱溶液的比热容和密度均大于水
中和反应热的测定
【误差分析】
化学反应前后体系的内能(符号为U)发生了变化。
体系内物质的各种能量的总和,受温度、压强和物质的凝聚状态等影响。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
问题三 化学反应过程中为什么会产生反应热?
1) 放热反应
当体系放热时其焓减小,ΔH 为________,即ΔH_______。
负值
<0
当体系吸热时其焓增大,ΔH 为________,即ΔH_______。
正值
>0
2) 吸热反应
反应物
反应物
生成物
生成物
吸热反应
放热反应
宏观分析
焓变
①符号:ΔH
②单位:kJ/mol或kJ·mol-1
③规定:放热反应,体系焓减小,ΔH<0
吸热反应,体系焓增大,ΔH>0
在等压条件下进行的化学反应,反应热等于反应的焓变。
△H=H(生成物)-H(反应物)
注意:①ΔH必须带有 + 或 - ②ΔH单位 kJ/mol 必须标出。
化学反应
物质变化
反应物
生成物
旧化学键断裂
新化学键形成
能量变化
吸收能量
放出能量
热效应
差值
微观分析
化学反应的本质:
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
能量
反应进程
反应物
生成物
E吸
E放
能量
反应进程
生成物
反应物
E放
E吸
放热反应 : ΔH<0
吸热反应 : ΔH>0
计算:ΔH =
反应物的总键能-生成物的总键能
键能:
一定条件下,1mol分子断键所吸收或者生成1mol物质所释放的能量
微观分析
25℃和101kPa下:
1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)分子的过程中:
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
问题四 研究化学反应的热效应有何意义?
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
常见放热反应
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
KMnO4
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟酸或水反应
⑤铝热反应
①大多数分解反应
②铵盐与碱的反应
③C与CO2或H2O的反应
④碳酸氢钠与盐酸的反应
吸热反应
放热反应
问题四 研究化学反应的热效应有何意义?
CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH>0
反应吸收大量的热
如果不及时供应所需的热量,反应就不能顺利进行,甚至停止。
问题四 研究化学反应的热效应有何意义?
ΔH<0
选择工艺操作条件 保证生产的正常进行
反应放热。如果不设法将这些热量移走,反应器内的温度就会过高,不仅会烧毁催化剂,使产量降低,还可能发生爆炸事故。
问题四 研究化学反应的热效应有何意义?
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
热能的综合利用
工艺条件优化
理论分析
小结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
应用
热能利用
工艺操作
反应的可行性
ΔH(估算) = ∑E(反应物键能) -∑E(生成物键能)
选择反应条件
反应热
思考:化学反应带来了什么变化?
物质变化
能量变化
起飞重量约870吨
起飞推力超1000吨
液氢与液氧
煤油与液氧
火箭推进剂
一般选用化学推进剂它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
问题一 如何定量描述化学反应中能量的变化?
与体系相互影响的其他部分,
如:试管和溶液之外的空气等。
盐酸、NaOH溶液及发生的反应
以盐酸与NaOH溶液的反应为例
环境
体系
体系与环境示意图
环境
体系
体系与环境示意图
T2
T1
体系与环境之间存在_______交换。
能量
因温度不同,
热量
问题一 如何定量描述化学反应中能量的变化?
以盐酸与NaOH溶液的反应为例
等温条件下,化学体系向环境释放或从环境吸收热量。
称为化学反应的热效应(简称反应热)
注意:
等温含义:反应前后体系的温度相等
反应热的定义
问题二 如何测量化学反应的热量?
现代量热计
保温杯式量热计
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
Q = c · m ·Δt
Q:中和反应放出的热量 m:体系的质量
C:体系的比热容 Δt:反应前后体系温度的差值
思考:测量哪些数据?
盐酸和NaOH的温度(取平均值)
反应后体系的温度(最高温度)
简易量热计示意图
【实验原理】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
简易量热计示意图
50 mL 0.50 mol/L的盐酸
50 mL 0.55 mol/L氢氧化钠溶液
简易量热计、量筒 (50 mL)两个、
温度计、玻璃搅拌器
保温、隔热、减少热量损失
【实验试剂】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
【实验仪器】
a. 量取50 mL 0.5mol/L盐酸,用温度计测量盐酸的温度t1
用水冲洗干净温度计上的酸。
反应物温度的测量
b. 量取50 mL 0.55mol/L NaOH溶液,用温度计测量其温度t2
防止残留的酸与碱反应,
导致测量的t2数据不准。
NaOH稍过量,确保盐酸完全反应、提高实验准确度。
【实验测量】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(2)打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应体系的温度(t2)
反应后体系温度的测量
(3)重复上述步骤(1)至(2)两次。
【实验过程】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(1)取盐酸温度和NaOH溶液温度的__________记为反应前体系的温度(t1) 。计算温度差(t2 - t1),将数据填入下表。
平均值
(2)取三次测量所得温度差的平均值作为计算依据。
3.4
21.0
21.1
21.3
3.40
3.30
3.50
【数据处理】
以盐酸与NaOH溶液的反应为例
中和反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
(4)实验数据处理
①为了计算简便,盐酸、氢氧化钠稀溶液的密度近似等于1 g·cm-3,故50ml盐酸的质量为____,50ml氢氧化钠溶液的质量为____,则溶液质量为___
②反应后生成的溶液的比热容c=4.18 J/(g·℃)。
该实验中盐酸和NaOH溶液反应放出的热量是_______________,
生成1mol H2O时放出的热量为 。
0.418(t2 - t1)kJ
0.418(t2 - t1)/ 0.025 kJ
计算: ( m1+m2 ) × c ×( t2 - t1 )/0.025
= 56.8 kJ
50g
50g
100g
中和反应热的测定
在25℃和101kPa下,
_________跟_______的______溶液发生中和反应生成_____________时所释放的热量为 57.3 kJ。
强酸
强碱
稀
1mol水
中和反应热
56.8
kJ
57.3
kJ
VS
你测的数据
资料上的数据
为什么产生误差?
①装置本身缺陷:
②实验操作:
③数据处理:
1.量取溶液的体积有误差(俯视读数)
2.温度计的读数有误(不是最高点)
3.实验过程中有液体洒在外面
4.混合酸、碱溶液时,动作缓慢,导致实验误差
量热计的保温绝热效果不好
采用近似值计算
酸碱溶液的比热容和密度均大于水
中和反应热的测定
【误差分析】
化学反应前后体系的内能(符号为U)发生了变化。
体系内物质的各种能量的总和,受温度、压强和物质的凝聚状态等影响。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
问题三 化学反应过程中为什么会产生反应热?
1) 放热反应
当体系放热时其焓减小,ΔH 为________,即ΔH_______。
负值
<0
当体系吸热时其焓增大,ΔH 为________,即ΔH_______。
正值
>0
2) 吸热反应
反应物
反应物
生成物
生成物
吸热反应
放热反应
宏观分析
焓变
①符号:ΔH
②单位:kJ/mol或kJ·mol-1
③规定:放热反应,体系焓减小,ΔH<0
吸热反应,体系焓增大,ΔH>0
在等压条件下进行的化学反应,反应热等于反应的焓变。
△H=H(生成物)-H(反应物)
注意:①ΔH必须带有 + 或 - ②ΔH单位 kJ/mol 必须标出。
化学反应
物质变化
反应物
生成物
旧化学键断裂
新化学键形成
能量变化
吸收能量
放出能量
热效应
差值
微观分析
化学反应的本质:
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
能量
反应进程
反应物
生成物
E吸
E放
能量
反应进程
生成物
反应物
E放
E吸
放热反应 : ΔH<0
吸热反应 : ΔH>0
计算:ΔH =
反应物的总键能-生成物的总键能
键能:
一定条件下,1mol分子断键所吸收或者生成1mol物质所释放的能量
微观分析
25℃和101kPa下:
1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)分子的过程中:
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
问题四 研究化学反应的热效应有何意义?
③ 酸碱
中和反应
①燃烧
④ 大部分
化合反应
②金属与水
/酸反应
⑤ 铝热
反应
常见放热反应
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
KMnO4
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟酸或水反应
⑤铝热反应
①大多数分解反应
②铵盐与碱的反应
③C与CO2或H2O的反应
④碳酸氢钠与盐酸的反应
吸热反应
放热反应
问题四 研究化学反应的热效应有何意义?
CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH>0
反应吸收大量的热
如果不及时供应所需的热量,反应就不能顺利进行,甚至停止。
问题四 研究化学反应的热效应有何意义?
ΔH<0
选择工艺操作条件 保证生产的正常进行
反应放热。如果不设法将这些热量移走,反应器内的温度就会过高,不仅会烧毁催化剂,使产量降低,还可能发生爆炸事故。
问题四 研究化学反应的热效应有何意义?
反应热估算
键能估算
能耗
……
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
热能的综合利用
工艺条件优化
理论分析
小结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
应用
热能利用
工艺操作
反应的可行性
ΔH(估算) = ∑E(反应物键能) -∑E(生成物键能)
选择反应条件
