化学人教版(2019)必修第二册7.3.2乙酸(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2乙酸(共42张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 77.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 18:06:22 | ||
图片预览











文档简介
(共42张PPT)
7.3 乙醇与乙酸
第2课时 乙酸
酒
米
醋
无色、有强烈刺激性气味的液体
易溶于乙醇和水
熔点 16.7℃
沸点 118℃
一、乙酸的物理性质
当温度低于 16.7℃时,乙酸会凝结成冰状晶体,故又称冰醋酸
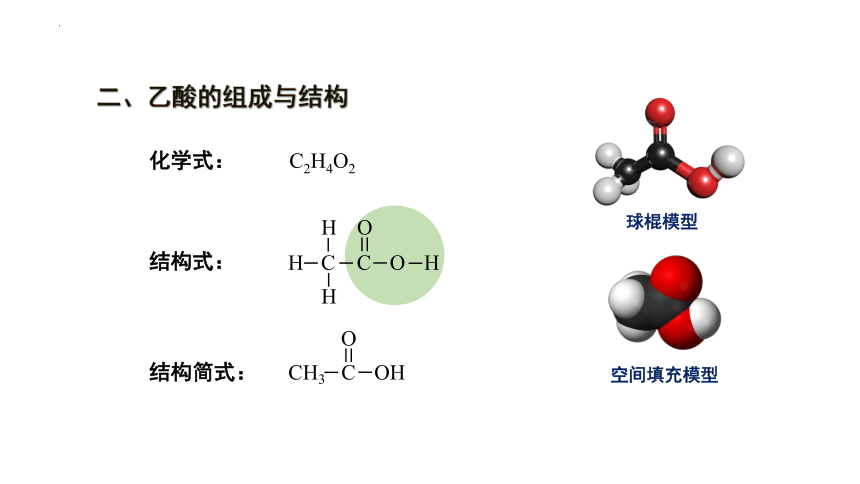
二、乙酸的组成与结构
化学式: C2H4O2
结构式:
结构简式:
CH3COOH
O
H C
H
H
C O H
O
CH3 C OH
羧基:-COOH
二、乙酸的组成与结构
化学式: C2H4O2
结构式:
O
H C
H
H
C O H
球棍模型
空间填充模型
结构简式:
O
CH3 C OH
1、酸性
CH3COOH CH3COO- + H+
三、乙酸的化学性质
④ 与碱反应
⑤ 与某些盐反应
③ 与碱性氧化物反应
① 使酸碱指示剂变色
② 与活泼金属反应
一元弱酸
三、乙酸的化学性质
1、酸性
CH3COOH CH3COO- + H+
三、乙酸的化学性质
④ 与碱反应
⑤ 与某些盐反应
③ 与碱性氧化物反应
2CH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O
2CH3COOH + CaO = (CH3COO)2Ca + H2O
① 使酸碱指示剂变色
② 与活泼金属反应
2CH3COOH + Mg = (CH3COO)2Mg + H2↑
2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑
一元弱酸
如何用实验证明乙酸是弱酸?
1、测定同浓度的盐酸和醋酸的pH值
2、比较同浓度的盐酸和醋酸与相同镁条反应的快慢
3、比较同浓度的盐酸和醋酸的导电性强弱
浓度均为 0.1mol/L
如何用实验证明乙酸是弱酸?
浓度均为 0.1mol/L
如何用实验证明乙酸是弱酸?
1、测定同浓度的盐酸和醋酸的pH值
2、比较同浓度的盐酸和醋酸与相同镁条反应的快慢
3、比较同浓度的盐酸和醋酸的导电性强弱
浓度均为 0.1mol/L
1
3
快
慢
强
弱
为什么可以用食醋去除水壶中的水垢?
CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑ + H2O
酸性:CH3COOH > H2CO3
烧鱼时放些醋再加点料酒,这样做出的鱼就没有腥味,味道更加鲜美,这是为什么呢
生活小窍门:
实验:在试管中加入3mL乙醇,边振荡边加入 2mL浓硫酸,待冷却后再加入 2mL乙酸,酒精灯加热。
乙醇
浓硫酸
乙酸
饱和
Na2CO3溶液
实验:在试管中加入3mL乙醇,边振荡边加入 2mL浓硫酸,待冷却后再加入 2mL乙酸,酒精灯加热。
乙醇
浓硫酸
乙酸
饱和
Na2CO3溶液
现象:溶液分层,上层有无色透明油状液体产生,并有香味。
2、酯化反应
三、乙酸的化学性质
乙酸 乙醇 乙酸乙酯 水
酸和醇反应生成酯和水的反应
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
酯化反应是可逆反应
某酸某(醇)酯
酯化反应原理:
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
可能1:
可能2:
酯化反应原理:
18
+ H O C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
18
酸脱羟基醇脱氢
同位素示踪法,是一种研究有机反应机理的常用方法
酯化反应原理:
+ H O C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
酸脱羟基醇脱氢
(取代反应)
2、酯化反应
酸和醇反应生成酯和水的反应
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
① 反应原理为:酸脱羟基醇脱氢
② 酯化反应是取代反应
③ 酯化反应是可逆反应
④ 酯基:
R
O
C O
练习:乙酸和甲醇酯化反应方程式:
乙酸甲酯
+ HO CH3
O
CH3 C OH
CH3 + H2O
O
CH3 C O
浓硫酸
△
饱和碳酸钠溶液的作用?
③ 降低乙酸乙酯的溶解度,有利分层
① 吸收乙酸
② 溶解乙醇
物质 沸点/℃ 密度/(g/mL) 溶解性
乙酸 117.9 1.05 易溶于水
乙醇 78.5 0.789 易溶于水
乙酸乙酯 77 0.90 微溶,难溶于盐溶液
1、试剂的添加顺序?
2、加碎瓷片的目的 ?
3、加热的目的?
4、浓H2SO4作用?
5、长导管的作用?
导管口为什么要置于 Na2CO3液面上方?
6、如何分离出乙酸乙酯?
乙酸和乙醇的酯化反应:
1. 先加乙醇,再加入浓硫酸,最后加入乙酸
2. 加碎瓷片,防止暴沸
5. 长导管作用:导气和冷凝
导管口置于 Na2CO3液面上方:防止倒吸
3. 加热的目的:
① 加快反应速率
② 将乙酸乙酯蒸出,有利于平衡正向移动
6. 分离方法:分液
4. 浓H2SO4作用:催化剂和吸水剂
乙酸的化学性质
结构决定性质
O
CH3—C—O—H
酸性
酯化反应
羧基
生活中无“醋”不在
食醋中一般含有3%~5%的乙酸
四、乙酸的用途
乙酸是重要的化工原料
聚乙酸乙烯酯
醋酸纤维广泛应用于纺织面料、过滤膜、光学胶片等领域
1、乙酸的物理性质
酸性
酯化反应
课堂小结
3、乙酸的化学性质
4、乙酸的用途
2、乙酸的分子结构
一元弱酸,酸性强于碳酸
O
H C
H
H
C O H
羧基:-COOH
酸脱羟基醇脱氢
(取代反应)
O
CH3 C OH
1、下列关于乙醇和醋酸的比较中,错误的是( )
A.分子内都含有羟基,都有酸性
B.都属于烃的含氧衍生物
C.都能发生酯化反应
D.都广泛应用于人们的生活中
A
课堂练习
2、酯化反应属于( )
A.中和反应 B.可逆反应
C.离子反应 D.取代反应
BD
C
3、除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液
4、下列关于官能团的判断中说法错误的是( )
A. 醇的官能团是羟基 -OH
B. 醛的官能团是醛基 -COH
C. 羧酸的官能团是羧基 -COOH
D. 酯的官能团是酯基
B
O
C O R
5、苹果酸是一种常见的有机酸,其结构简式为:
,苹果酸可能发生的反应是( )
① 与NaOH溶液反应 ② 与石蕊试液作用变红
③ 与金属钠反应放出气体 ④ 一定条件下与乙酸酯化
⑤ 一定条件下与乙醇酯化
A.①②③ B.①②③④
C.①②③⑤ D.①②③④⑤
D
CH2 COOH
HO
HOOC CH
6、巴豆酸的结构简式为 CH3-CH=CH-COOH。现有① 氯化氢、
② 溴水、③ 纯碱溶液、④ 丁醇、⑤ 酸性 KMnO4 溶液,判断
在一定条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤ B. 只有①③④
C. 只有①②③④ D. ①②③④⑤
D
乙酸(CH3COOH)
葡萄糖
(C6H12O6)
酒精(C2H5OH)
乙酸乙酯(CH3COOCH2CH3)
乙醛(CH3CHO)
陈醋酿造
曲酶
淀粉(C6H10O5)n
酵母菌
氧气
氧气
7.3 乙醇与乙酸
第2课时 乙酸
酒
米
醋
无色、有强烈刺激性气味的液体
易溶于乙醇和水
熔点 16.7℃
沸点 118℃
一、乙酸的物理性质
当温度低于 16.7℃时,乙酸会凝结成冰状晶体,故又称冰醋酸
二、乙酸的组成与结构
化学式: C2H4O2
结构式:
结构简式:
CH3COOH
O
H C
H
H
C O H
O
CH3 C OH
羧基:-COOH
二、乙酸的组成与结构
化学式: C2H4O2
结构式:
O
H C
H
H
C O H
球棍模型
空间填充模型
结构简式:
O
CH3 C OH
1、酸性
CH3COOH CH3COO- + H+
三、乙酸的化学性质
④ 与碱反应
⑤ 与某些盐反应
③ 与碱性氧化物反应
① 使酸碱指示剂变色
② 与活泼金属反应
一元弱酸
三、乙酸的化学性质
1、酸性
CH3COOH CH3COO- + H+
三、乙酸的化学性质
④ 与碱反应
⑤ 与某些盐反应
③ 与碱性氧化物反应
2CH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O
2CH3COOH + CaO = (CH3COO)2Ca + H2O
① 使酸碱指示剂变色
② 与活泼金属反应
2CH3COOH + Mg = (CH3COO)2Mg + H2↑
2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑
一元弱酸
如何用实验证明乙酸是弱酸?
1、测定同浓度的盐酸和醋酸的pH值
2、比较同浓度的盐酸和醋酸与相同镁条反应的快慢
3、比较同浓度的盐酸和醋酸的导电性强弱
浓度均为 0.1mol/L
如何用实验证明乙酸是弱酸?
浓度均为 0.1mol/L
如何用实验证明乙酸是弱酸?
1、测定同浓度的盐酸和醋酸的pH值
2、比较同浓度的盐酸和醋酸与相同镁条反应的快慢
3、比较同浓度的盐酸和醋酸的导电性强弱
浓度均为 0.1mol/L
1
3
快
慢
强
弱
为什么可以用食醋去除水壶中的水垢?
CaCO3 + 2CH3COOH = (CH3COO)2Ca + CO2↑ + H2O
酸性:CH3COOH > H2CO3
烧鱼时放些醋再加点料酒,这样做出的鱼就没有腥味,味道更加鲜美,这是为什么呢
生活小窍门:
实验:在试管中加入3mL乙醇,边振荡边加入 2mL浓硫酸,待冷却后再加入 2mL乙酸,酒精灯加热。
乙醇
浓硫酸
乙酸
饱和
Na2CO3溶液
实验:在试管中加入3mL乙醇,边振荡边加入 2mL浓硫酸,待冷却后再加入 2mL乙酸,酒精灯加热。
乙醇
浓硫酸
乙酸
饱和
Na2CO3溶液
现象:溶液分层,上层有无色透明油状液体产生,并有香味。
2、酯化反应
三、乙酸的化学性质
乙酸 乙醇 乙酸乙酯 水
酸和醇反应生成酯和水的反应
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
酯化反应是可逆反应
某酸某(醇)酯
酯化反应原理:
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
可能1:
可能2:
酯化反应原理:
18
+ H O C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
18
酸脱羟基醇脱氢
同位素示踪法,是一种研究有机反应机理的常用方法
酯化反应原理:
+ H O C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
酸脱羟基醇脱氢
(取代反应)
2、酯化反应
酸和醇反应生成酯和水的反应
+ HO C2H5
O
CH3 C OH
C2H5 + H2O
O
CH3 C O
浓硫酸
△
① 反应原理为:酸脱羟基醇脱氢
② 酯化反应是取代反应
③ 酯化反应是可逆反应
④ 酯基:
R
O
C O
练习:乙酸和甲醇酯化反应方程式:
乙酸甲酯
+ HO CH3
O
CH3 C OH
CH3 + H2O
O
CH3 C O
浓硫酸
△
饱和碳酸钠溶液的作用?
③ 降低乙酸乙酯的溶解度,有利分层
① 吸收乙酸
② 溶解乙醇
物质 沸点/℃ 密度/(g/mL) 溶解性
乙酸 117.9 1.05 易溶于水
乙醇 78.5 0.789 易溶于水
乙酸乙酯 77 0.90 微溶,难溶于盐溶液
1、试剂的添加顺序?
2、加碎瓷片的目的 ?
3、加热的目的?
4、浓H2SO4作用?
5、长导管的作用?
导管口为什么要置于 Na2CO3液面上方?
6、如何分离出乙酸乙酯?
乙酸和乙醇的酯化反应:
1. 先加乙醇,再加入浓硫酸,最后加入乙酸
2. 加碎瓷片,防止暴沸
5. 长导管作用:导气和冷凝
导管口置于 Na2CO3液面上方:防止倒吸
3. 加热的目的:
① 加快反应速率
② 将乙酸乙酯蒸出,有利于平衡正向移动
6. 分离方法:分液
4. 浓H2SO4作用:催化剂和吸水剂
乙酸的化学性质
结构决定性质
O
CH3—C—O—H
酸性
酯化反应
羧基
生活中无“醋”不在
食醋中一般含有3%~5%的乙酸
四、乙酸的用途
乙酸是重要的化工原料
聚乙酸乙烯酯
醋酸纤维广泛应用于纺织面料、过滤膜、光学胶片等领域
1、乙酸的物理性质
酸性
酯化反应
课堂小结
3、乙酸的化学性质
4、乙酸的用途
2、乙酸的分子结构
一元弱酸,酸性强于碳酸
O
H C
H
H
C O H
羧基:-COOH
酸脱羟基醇脱氢
(取代反应)
O
CH3 C OH
1、下列关于乙醇和醋酸的比较中,错误的是( )
A.分子内都含有羟基,都有酸性
B.都属于烃的含氧衍生物
C.都能发生酯化反应
D.都广泛应用于人们的生活中
A
课堂练习
2、酯化反应属于( )
A.中和反应 B.可逆反应
C.离子反应 D.取代反应
BD
C
3、除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液
4、下列关于官能团的判断中说法错误的是( )
A. 醇的官能团是羟基 -OH
B. 醛的官能团是醛基 -COH
C. 羧酸的官能团是羧基 -COOH
D. 酯的官能团是酯基
B
O
C O R
5、苹果酸是一种常见的有机酸,其结构简式为:
,苹果酸可能发生的反应是( )
① 与NaOH溶液反应 ② 与石蕊试液作用变红
③ 与金属钠反应放出气体 ④ 一定条件下与乙酸酯化
⑤ 一定条件下与乙醇酯化
A.①②③ B.①②③④
C.①②③⑤ D.①②③④⑤
D
CH2 COOH
HO
HOOC CH
6、巴豆酸的结构简式为 CH3-CH=CH-COOH。现有① 氯化氢、
② 溴水、③ 纯碱溶液、④ 丁醇、⑤ 酸性 KMnO4 溶液,判断
在一定条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤ B. 只有①③④
C. 只有①②③④ D. ①②③④⑤
D
乙酸(CH3COOH)
葡萄糖
(C6H12O6)
酒精(C2H5OH)
乙酸乙酯(CH3COOCH2CH3)
乙醛(CH3CHO)
陈醋酿造
曲酶
淀粉(C6H10O5)n
酵母菌
氧气
氧气
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
