化学人教版(2019)必修第二册7.3.1乙醇(共40张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共40张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 139.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-08 19:12:11 | ||
图片预览







文档简介
(共40张PPT)
7.3 乙醇与乙酸
第1课时 乙醇
明月几时有? _____________
_______________,人生几何
_______________,西出阳关无故人
_______________,青春作伴好还乡
把酒问青天
对酒当歌
劝君更尽一杯酒
白日放歌须纵酒
无色、有特殊香味的液体
易挥发
密度比水小
能溶解多种有机物和无机物
能与水以任意比互溶
沸点 78.3 ℃ ,熔点 -114℃
一、乙醇的物理性质
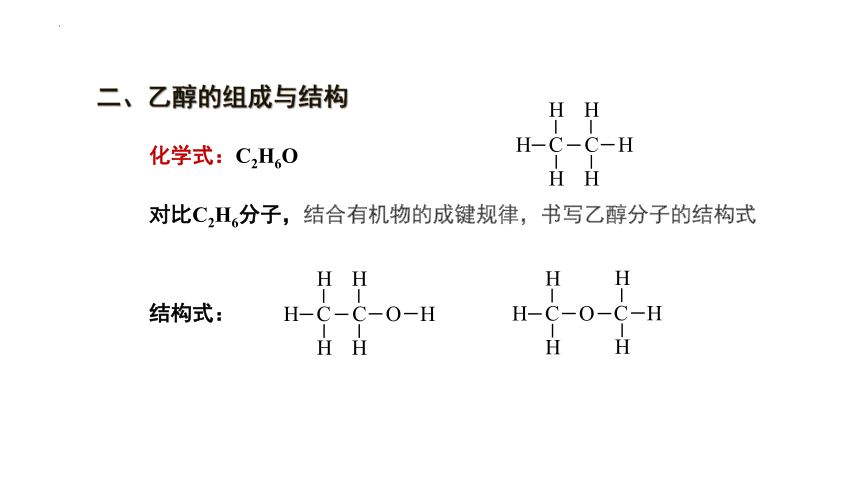
二、乙醇的组成与结构
化学式:C2H6O
结构式:
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
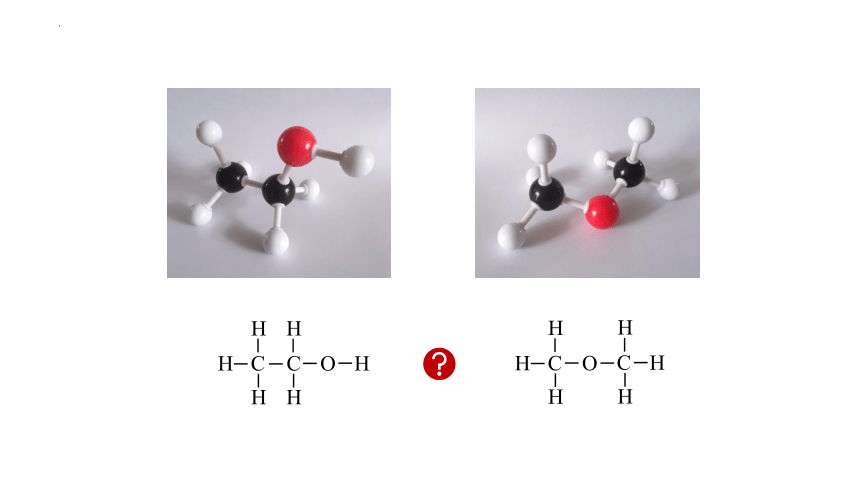
对比C2H6分子,结合有机物的成键规律,书写乙醇分子的结构式
H C
H
H
C H
H
H
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
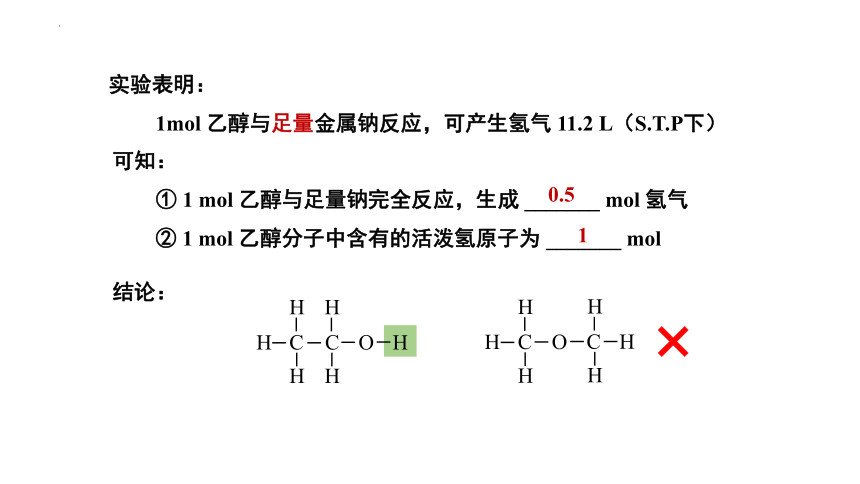
实验表明:
1mol 乙醇与足量金属钠反应,可产生氢气 11.2 L(S.T.P下)
可知:
① 1 mol 乙醇与足量钠完全反应,生成 _______ mol 氢气
结论:
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
0.5
1
② 1 mol 乙醇分子中含有的活泼氢原子为 _______ mol
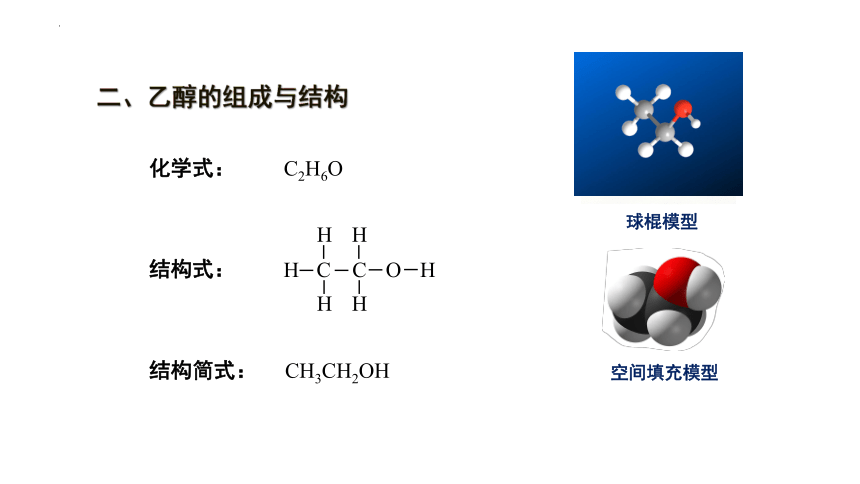
二、乙醇的组成与结构
化学式: C2H6O
结构式:
H C
H
H
C O H
H
H
结构简式:
CH3CH2OH
球棍模型
空间填充模型
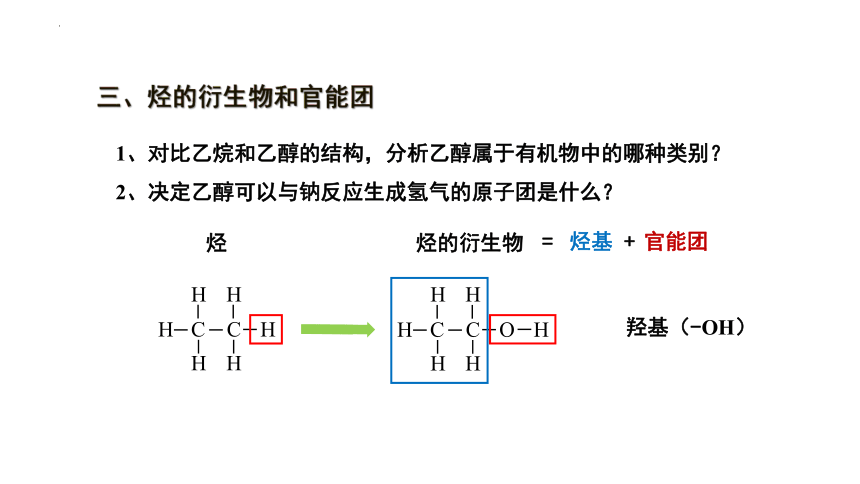
三、烃的衍生物和官能团
1、对比乙烷和乙醇的结构,分析乙醇属于有机物中的哪种类别?
2、决定乙醇可以与钠反应生成氢气的原子团是什么?
H C
H
H
C O H
H
H
H C
H
H
C H
H
H
烃
烃的衍生物
羟基(-OH)
官能团
烃基
= +
三、烃的衍生物和官能团
1、烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的有机物
如:CH3Cl、CH3CH2OH、
-NO2
2、官能团(functional group):
决定有机物化学特性的原子或原子团
官能团不显电性
如:-Cl、-OH、-NO2、 、
四、乙醇的化学性质
1、与钠反应
四、乙醇的化学性质
1、与钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
H C
H
H
C O H
H
H
活泼氢
四、乙醇的化学性质
1、与钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
①
②
③
④
①处 O-H键断开
比较钠分别与乙醇和水反应的剧烈程度,并分析原因:
钠与乙醇反应较为缓和,因为乙醇羟基中的氢原子不如水中的氢原子活泼
H C
H
H
C O H
H
H
H O H
弱电解质
非电解质
四、乙醇的化学性质
2、氧化反应
(1)燃烧
产生淡蓝色火焰,同时放出大量热
C2H5OH + 3O2 2CO2 + 3H2O
点燃
乙醇汽油
90%的普通汽油与10%的乙醇调和而成
点燃
CxHyOz +(x + - )O2 xCO2 + H2O
y
4
y
2
2
z
CxHyOz 燃烧通式:
C2H5OH + 3O2 2CO2 + 3H2O
点燃
(2)催化氧化
把铜丝在酒精灯上灼烧后浸入乙醇中,反复几次后,嗅闻溶液的气味
(2)催化氧化
现象:
2Cu + O2 = 2CuO
△
C2H5OH + CuO → CH3CHO + H2O + Cu
△
铜丝 变黑 又变红,并有刺激性气味的物质生成
灼烧
乙醇
总反应:
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
△
催化剂 Cu参与化学反应,但反应前后质量和化学性质不变。
(2)催化氧化
①
②
③
④
①③处 O-H键断开
(同碳有氢)
2C2H5OH + O2 2 + 2H2O
Cu
△
O
CH3 C H
(2)催化氧化
现象:
注:希夫试剂(Schiff)又称品红亚硫酸试剂。
希夫试剂可用来检验醛,乙醛可使无色的希夫试剂变紫红色。
浸有希夫试剂的滤纸变紫红色
2C2H5OH + O2 2 + 2H2O
Cu
△
O
CH3 C H
与酸性 KMnO4 溶液
(3)与强氧化剂反应
与酸性 KMnO4 溶液
(3)与强氧化剂反应
现象:乙醇使酸性高锰酸钾溶液褪色
C2H5OH CH3COOH
H+ / KMnO4
与酸性 K2Cr2O7溶液
与酸性 K2Cr2O7溶液
现象:乙醇使酸性重铬酸钾溶液变绿色
C2H5OH CH3COOH
H+ / K2Cr2O7
Cr3+
Cr2O72 -
3、消去反应
3、消去反应
C2H5OH CH2 = CH2↑ + H2O
浓硫酸
170℃
H C
H
H
C H
H
OH
CH2 = CH2↑ + H2O
浓硫酸
170℃
一定条件下,有机物分子内脱去小分子生成不饱和(双键或三键)化合物的反应称为消去反应
3、消去反应
H C
H
H
C H
H
OH
CH2 = CH2↑ + H2O
浓硫酸
170℃
①
②
③
④
②④处共价键断开
消去规则:
羟基所在的碳原子必须有相邻碳原子且该相邻碳原子上必须有氢原子。
邻碳有氢
1、CH3OH
2、CH3CH2CH2OH
下列醇可以发生消去反应吗?
CH3 C
CH3
CH3
CH2 OH
3、
五、乙醇的制法
1、发酵法
(C6H10O5)n + nH2O nC6H12O6
催化剂
淀 粉 葡萄糖
C6H12O6 2C2H5OH + 2CO2↑
催化剂
2、乙烯水化法
CH2 = CH2 + H2O CH3CH2OH
催化剂
加热、加压
制造饮料、香精
医疗上用75%的酒精作消毒剂
用作溶剂
用作燃料
化工原料,制乙酸、乙醚等
六、乙醇的用途
1、乙醇的物理性质
置换反应
氧化反应
消去反应
课堂小结
3、烃的衍生物和官能团
4、乙醇的化学性质
5、乙醇的制法
6、乙醇的用途
H C
H
H
C O H
H
H
2、乙醇的分子结构
活泼氢
燃烧、催化氧化、酸性高锰酸钾
邻碳有氢
-OH 羟基 OH - 氢氧根
电子式
电性
电子数
稳定性
概念辨析
原子团
离子
-OH 羟基 OH - 氢氧根
电子式
电性 电中性 带负电荷
电子数 9 10
稳定性 不稳定 较稳定
概念辨析
[ ] -
O H
··
··
··
··
O H
··
··
··
··
课堂练习
C
1、可以证明乙醇分子中羟基上的氢原子与其他氢原子不同的是( )
A.1 mol 乙醇完全燃烧生成 3mol水
B.乙醇可以制酒精饮料
C.1 mol 乙醇跟足量的 Na作用得 0.5mol H2
D.1 mol 乙醇可生成 1mol乙醛
2、决定乙醇主要化学性质的原子或原子团是( )
A.羟基 B.乙基( -CH2CH3 )
C.氢氧根离子 D.氢离子
A
D
3、如图所示装置,持续通入 X气体,可以看到 a处有红色物质生成,b处变成蓝色,c处得到液体,则 X气体是( )
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气)
C
4、交警检查司机是否酒驾的原理:橙色的酸性 K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变为绿色 (Cr3+)。下列对乙醇的描述与此原理有关的是( )
① 乙醇易挥发 ② 乙醇的密度比水的小
③ 乙醇具有还原性 ④ 乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
5、CH3CH2OH 的官能团是 -OH,含有 -OH的物质具有与乙醇相似的化学性质,在 Cu或 Ag的催化下,下列物质不能与 O2发生催化氧化反应的是( )
A.CH3CH2CH2OH B.CH3OH
C. D.
D
6、加热质量为 a g的铜丝至表面变黑,立即伸入下列物质中,能使铜丝变红,而且质量不再为 a g的是( )
A.稀硫酸 B.乙醇
C.水 D.氢氧化钠溶液
A
7、下列关于羟基和氢氧根离子的说法中,不正确的是( )
A.羟基比氢氧根离子少一个电子
B.两者的组成元素相同
C.羟基不带电,氢氧根离子带一个单位的负电荷
D.羟基比氢氧根离子性质稳定
D
8、乙醇在各反应中断裂化学键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.在空气中完全燃烧时断裂①②③④⑤
D.乙醇中羟基氢的活性比水中羟基氢的强
D
7.3 乙醇与乙酸
第1课时 乙醇
明月几时有? _____________
_______________,人生几何
_______________,西出阳关无故人
_______________,青春作伴好还乡
把酒问青天
对酒当歌
劝君更尽一杯酒
白日放歌须纵酒
无色、有特殊香味的液体
易挥发
密度比水小
能溶解多种有机物和无机物
能与水以任意比互溶
沸点 78.3 ℃ ,熔点 -114℃
一、乙醇的物理性质
二、乙醇的组成与结构
化学式:C2H6O
结构式:
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
对比C2H6分子,结合有机物的成键规律,书写乙醇分子的结构式
H C
H
H
C H
H
H
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
实验表明:
1mol 乙醇与足量金属钠反应,可产生氢气 11.2 L(S.T.P下)
可知:
① 1 mol 乙醇与足量钠完全反应,生成 _______ mol 氢气
结论:
H C
H
H
C O H
H
H
H C O
H
H
C H
H
H
0.5
1
② 1 mol 乙醇分子中含有的活泼氢原子为 _______ mol
二、乙醇的组成与结构
化学式: C2H6O
结构式:
H C
H
H
C O H
H
H
结构简式:
CH3CH2OH
球棍模型
空间填充模型
三、烃的衍生物和官能团
1、对比乙烷和乙醇的结构,分析乙醇属于有机物中的哪种类别?
2、决定乙醇可以与钠反应生成氢气的原子团是什么?
H C
H
H
C O H
H
H
H C
H
H
C H
H
H
烃
烃的衍生物
羟基(-OH)
官能团
烃基
= +
三、烃的衍生物和官能团
1、烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的有机物
如:CH3Cl、CH3CH2OH、
-NO2
2、官能团(functional group):
决定有机物化学特性的原子或原子团
官能团不显电性
如:-Cl、-OH、-NO2、 、
四、乙醇的化学性质
1、与钠反应
四、乙醇的化学性质
1、与钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
H C
H
H
C O H
H
H
活泼氢
四、乙醇的化学性质
1、与钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
①
②
③
④
①处 O-H键断开
比较钠分别与乙醇和水反应的剧烈程度,并分析原因:
钠与乙醇反应较为缓和,因为乙醇羟基中的氢原子不如水中的氢原子活泼
H C
H
H
C O H
H
H
H O H
弱电解质
非电解质
四、乙醇的化学性质
2、氧化反应
(1)燃烧
产生淡蓝色火焰,同时放出大量热
C2H5OH + 3O2 2CO2 + 3H2O
点燃
乙醇汽油
90%的普通汽油与10%的乙醇调和而成
点燃
CxHyOz +(x + - )O2 xCO2 + H2O
y
4
y
2
2
z
CxHyOz 燃烧通式:
C2H5OH + 3O2 2CO2 + 3H2O
点燃
(2)催化氧化
把铜丝在酒精灯上灼烧后浸入乙醇中,反复几次后,嗅闻溶液的气味
(2)催化氧化
现象:
2Cu + O2 = 2CuO
△
C2H5OH + CuO → CH3CHO + H2O + Cu
△
铜丝 变黑 又变红,并有刺激性气味的物质生成
灼烧
乙醇
总反应:
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
△
催化剂 Cu参与化学反应,但反应前后质量和化学性质不变。
(2)催化氧化
①
②
③
④
①③处 O-H键断开
(同碳有氢)
2C2H5OH + O2 2 + 2H2O
Cu
△
O
CH3 C H
(2)催化氧化
现象:
注:希夫试剂(Schiff)又称品红亚硫酸试剂。
希夫试剂可用来检验醛,乙醛可使无色的希夫试剂变紫红色。
浸有希夫试剂的滤纸变紫红色
2C2H5OH + O2 2 + 2H2O
Cu
△
O
CH3 C H
与酸性 KMnO4 溶液
(3)与强氧化剂反应
与酸性 KMnO4 溶液
(3)与强氧化剂反应
现象:乙醇使酸性高锰酸钾溶液褪色
C2H5OH CH3COOH
H+ / KMnO4
与酸性 K2Cr2O7溶液
与酸性 K2Cr2O7溶液
现象:乙醇使酸性重铬酸钾溶液变绿色
C2H5OH CH3COOH
H+ / K2Cr2O7
Cr3+
Cr2O72 -
3、消去反应
3、消去反应
C2H5OH CH2 = CH2↑ + H2O
浓硫酸
170℃
H C
H
H
C H
H
OH
CH2 = CH2↑ + H2O
浓硫酸
170℃
一定条件下,有机物分子内脱去小分子生成不饱和(双键或三键)化合物的反应称为消去反应
3、消去反应
H C
H
H
C H
H
OH
CH2 = CH2↑ + H2O
浓硫酸
170℃
①
②
③
④
②④处共价键断开
消去规则:
羟基所在的碳原子必须有相邻碳原子且该相邻碳原子上必须有氢原子。
邻碳有氢
1、CH3OH
2、CH3CH2CH2OH
下列醇可以发生消去反应吗?
CH3 C
CH3
CH3
CH2 OH
3、
五、乙醇的制法
1、发酵法
(C6H10O5)n + nH2O nC6H12O6
催化剂
淀 粉 葡萄糖
C6H12O6 2C2H5OH + 2CO2↑
催化剂
2、乙烯水化法
CH2 = CH2 + H2O CH3CH2OH
催化剂
加热、加压
制造饮料、香精
医疗上用75%的酒精作消毒剂
用作溶剂
用作燃料
化工原料,制乙酸、乙醚等
六、乙醇的用途
1、乙醇的物理性质
置换反应
氧化反应
消去反应
课堂小结
3、烃的衍生物和官能团
4、乙醇的化学性质
5、乙醇的制法
6、乙醇的用途
H C
H
H
C O H
H
H
2、乙醇的分子结构
活泼氢
燃烧、催化氧化、酸性高锰酸钾
邻碳有氢
-OH 羟基 OH - 氢氧根
电子式
电性
电子数
稳定性
概念辨析
原子团
离子
-OH 羟基 OH - 氢氧根
电子式
电性 电中性 带负电荷
电子数 9 10
稳定性 不稳定 较稳定
概念辨析
[ ] -
O H
··
··
··
··
O H
··
··
··
··
课堂练习
C
1、可以证明乙醇分子中羟基上的氢原子与其他氢原子不同的是( )
A.1 mol 乙醇完全燃烧生成 3mol水
B.乙醇可以制酒精饮料
C.1 mol 乙醇跟足量的 Na作用得 0.5mol H2
D.1 mol 乙醇可生成 1mol乙醛
2、决定乙醇主要化学性质的原子或原子团是( )
A.羟基 B.乙基( -CH2CH3 )
C.氢氧根离子 D.氢离子
A
D
3、如图所示装置,持续通入 X气体,可以看到 a处有红色物质生成,b处变成蓝色,c处得到液体,则 X气体是( )
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气)
C
4、交警检查司机是否酒驾的原理:橙色的酸性 K2Cr2O7溶液遇到呼出的乙醇蒸气时迅速变为绿色 (Cr3+)。下列对乙醇的描述与此原理有关的是( )
① 乙醇易挥发 ② 乙醇的密度比水的小
③ 乙醇具有还原性 ④ 乙醇是烃的含氧衍生物
A.②④ B.②③ C.①③ D.①④
5、CH3CH2OH 的官能团是 -OH,含有 -OH的物质具有与乙醇相似的化学性质,在 Cu或 Ag的催化下,下列物质不能与 O2发生催化氧化反应的是( )
A.CH3CH2CH2OH B.CH3OH
C. D.
D
6、加热质量为 a g的铜丝至表面变黑,立即伸入下列物质中,能使铜丝变红,而且质量不再为 a g的是( )
A.稀硫酸 B.乙醇
C.水 D.氢氧化钠溶液
A
7、下列关于羟基和氢氧根离子的说法中,不正确的是( )
A.羟基比氢氧根离子少一个电子
B.两者的组成元素相同
C.羟基不带电,氢氧根离子带一个单位的负电荷
D.羟基比氢氧根离子性质稳定
D
8、乙醇在各反应中断裂化学键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.在空气中完全燃烧时断裂①②③④⑤
D.乙醇中羟基氢的活性比水中羟基氢的强
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
