2023-2024学年北京市大兴区高二(下)期末化学(PDF版,无答案)
文档属性
| 名称 | 2023-2024学年北京市大兴区高二(下)期末化学(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 703.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-09 09:59:23 | ||
图片预览

文档简介
2024北京大兴高二(下)期末
化 学
2024.07
考 1.本试卷共 8 页,共 19 道小题,满分 100 分。考试时间 90 分钟。
生 2.在试卷和答题卡上准确填写学校、班级、姓名和准考证号。
须 3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
知 4.在答题卡上,选择题用 2B 铅笔作答,其他试题用黑色字迹签字笔作答。
可能用到的相对原子质量:C 12 Ca 40
第一部分 选择题(共 42 分)
本部分每小题只.有.一.个.选.项.符合题意,每小题 3 分
1.某烷烃的结构简式为 ,其系统命名是
A.2,4 -二甲基己烷 B.2-甲基-4-乙基戊烷
C.4-甲基-2-乙基戊烷 D.3,5-二甲基己烷
2.下列化学用语或模型表述不.正.确.的是
A.乙炔的空间填充模型:
B.羟基的电子式:
C.基态 Cr 原子的价层电子排布式:3d44s2
D.聚丙烯的结构简式:
3.下列有机化合物,不.属.于.醛类物质的是
A.HCHO B. C.CH2=CHCHO D.CH2=CHCHO
4.用下图装置探究 1-溴丁烷在氢氧化钠乙醇溶液中发生的反应,下列分析不.正.确.的是
A.用红外光谱可检验在该条件下生成有机物中的官能团
第1页/共7页
B.若酸性 KMnO4溶液褪色,推断反应一定生成了 1-丁烯
C.将试管中溶液改为溴水,若溴水褪色,则烧瓶中一定发生消去反应
D.
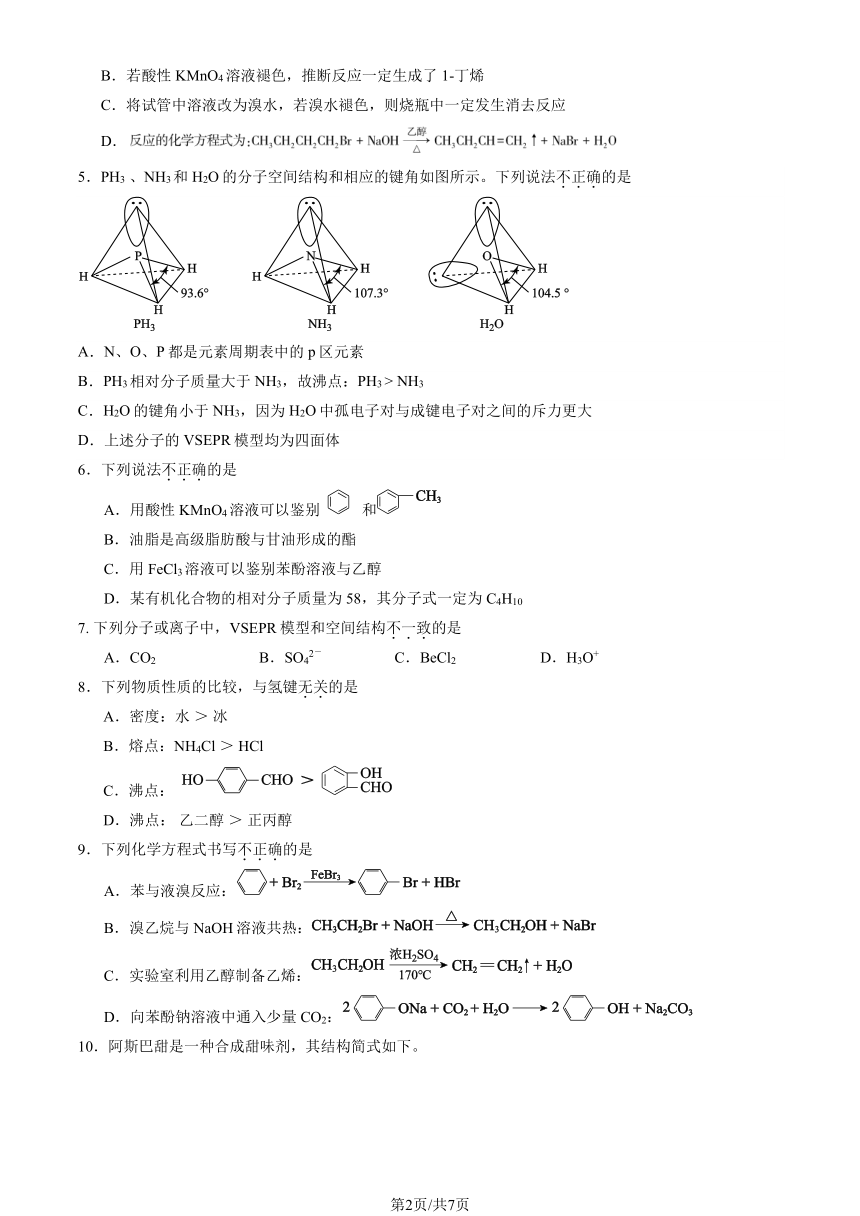
5.PH3 、NH3和 H2O 的分子空间结构和相应的键角如图所示。下列说法不.正.确.的是
A.N、O、P 都是元素周期表中的 p 区元素
B.PH3相对分子质量大于 NH3,故沸点:PH3 > NH3
C.H2O 的键角小于 NH3,因为 H2O 中孤电子对与成键电子对之间的斥力更大
D.上述分子的 VSEPR 模型均为四面体
6.下列说法不.正.确.的是
A.用酸性 KMnO4溶液可以鉴别 和
B.油脂是高级脂肪酸与甘油形成的酯
C.用 FeCl3溶液可以鉴别苯酚溶液与乙醇
D.某有机化合物的相对分子质量为 58,其分子式一定为 C4H10
7. 下列分子或离子中,VSEPR 模型和空间结构不.一.致.的是
-
A.CO 22 B.SO4 C.BeCl2 D.H O+3
8.下列物质性质的比较,与氢键无.关.的是
A.密度:水 > 冰
B.熔点:NH4Cl > HCl
C.沸点:
D.沸点: 乙二醇 > 正丙醇
9.下列化学方程式书写不.正.确.的是
A.苯与液溴反应:
B.溴乙烷与 NaOH 溶液共热:
C.实验室利用乙醇制备乙烯:
D.向苯酚钠溶液中通入少量 CO2:
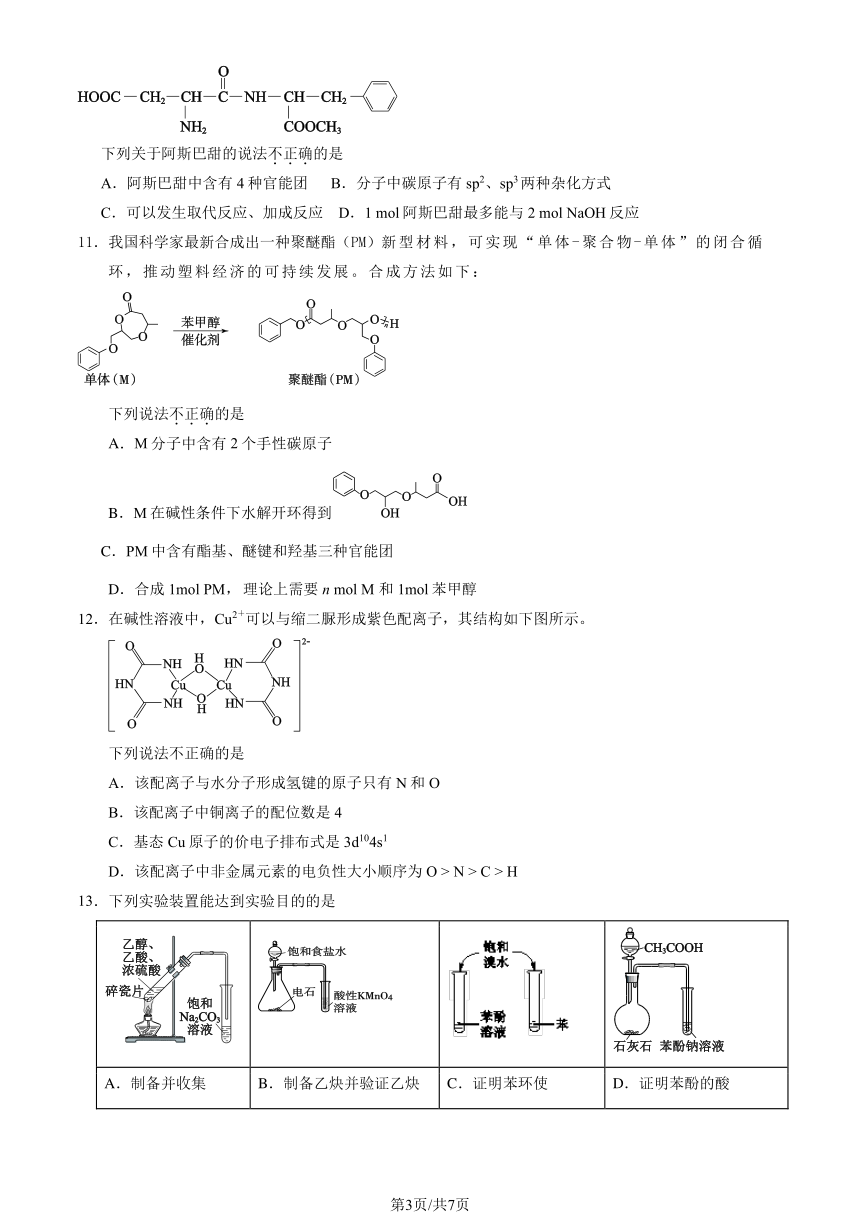
10.阿斯巴甜是一种合成甜味剂,其结构简式如下。
第2页/共7页
下列关于阿斯巴甜的说法不.正.确.的是
A.阿斯巴甜中含有 4 种官能团 B.分子中碳原子有 sp2、sp3两种杂化方式
C.可以发生取代反应、加成反应 D.1 mol 阿斯巴甜最多能与 2 mol NaOH 反应
11.我国科学家最新合成出一种聚醚酯(PM)新型材料,可实现“单体-聚合物-单体”的闭合循
环,推动塑料经济的可持续发展。合成方法如下:
下列说法不.正.确.的是
A.M 分子中含有 2 个手性碳原子
B.M 在碱性条件下水解开环得到
C.PM 中含有酯基、醚键和羟基三种官能团
D.合成 1mol PM,理论上需要 n mol M 和 1mol 苯甲醇
+
12.在碱性溶液中,Cu2 可以与缩二脲形成紫色配离子,其结构如下图所示。
下列说法不正确的是
A.该配离子与水分子形成氢键的原子只有 N 和 O
B.该配离子中铜离子的配位数是 4
C.基态 Cu 原子的价电子排布式是 3d104s1
D.该配离子中非金属元素的电负性大小顺序为 O > N > C > H
13.下列实验装置能达到实验目的的是
A.制备并收集 B.制备乙炔并验证乙炔 C.证明苯环使 D.证明苯酚的酸
第3页/共7页
乙酸乙酯 的还原性 羟基活化 性比碳酸的弱
14.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
向 CuSO4溶液中逐滴加入氨水至过 产生蓝色沉淀,后溶解,得到深蓝色的
①
量 溶液
② 再加入无水乙醇 得到深蓝色晶体
将深蓝色晶体洗净后溶于水配成溶
③ 无蓝色沉淀生成
液,再加入稀 NaOH 溶液
A.在深蓝色的配离子[Cu(NH 2+ 2+3)4] 中,Cu 提供空轨道,NH3给出孤电子对
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
2+ 2+ -C.该实验条件下,Cu 与 NH3的结合能力大于 Cu 与 OH 的结合能力
D.向③中深蓝色溶液中加入 BaCl2溶液,不会产生白色沉淀
第二部分 非选择题(共 58 分)
15.(11 分)有机化合物在人类生活和社会经济发展中具有重要的作用。
I. 维生素 C 是重要的营养素,其分子结构如图所示:
(1)维生素 C 分子中含有的官能团的名称是______。
(2)维生素 C 是水溶性维生素,其易溶于水的可能原因是______。
(3)维生素 C 具有较强的还原性,又被称为抗坏血酸。向 I2和淀粉溶液中加入维生素 C,可能观察
到的现象是______。
II. 乙酰水杨酸是使用广泛的解热镇痛剂,合成原理为:
(1)水杨酸的分子式为______。
(2)合成乙酰水杨酸的反应类型为______。
(3)写出一种符合下列条件的水杨酸的同分异构体的结构简式______。
①能发生银镜反应 ②遇 FeCl3溶液显紫色 ③苯环上的一溴取代物只有 2 种
(4)一定条件下,乙酰氯(CH3COCl )与水杨酸反应可以生成乙酰水杨酸,写出该反应的化学方程式
______。
(5)乙酰水杨酸与足量 NaOH 溶液反应的化学方程式为______。
16.(10 分)有机化合物 G 在工业上可用于制作印刷油墨、合成树脂等的溶剂。以 A 为原料合成 G 的转化
第4页/共7页
路线如下所示(部分反应条件已略去)。
(1)写出 A 的结构简式______,A→E 的反应类型为______。
(2)写出 B→C 的化学方程式______。
(3)用新制的 Cu(OH)2浊液可检验 C 中的官能团,实验现象是______,写出反应的化学方程式
______。
(4)试剂 a 是______。
(5)写出 D + F→G 的化学方程式______。
17.(11 分)工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔(俗称电石气),乙炔
是合成橡胶、合成纤维和塑料的单体。
(1)乙炔分子的空间构型为______形,乙炔分子中 σ 键和 π 键数目之比为______。
(2)乙炔与 HCN 通过______ (填反应类型)可制得丙烯腈(H2C=CH-C≡N),丙烯腈分子中碳原子轨道
杂化类型有______。
(3) 乙炔无明显酸性但氢氰酸(HCN)有酸性,解释 HCN 的酸性比乙炔强的原因____。
(4)乙炔和银氨溶液反应会生成乙炔银(AgC≡CAg),推测反应中生成的一种阳离子为______ (填化学
式)。
(5)CaC2晶体的晶胞结构与 NaCl 晶体相似,但 CaC 晶体中哑铃形 C 2-2 2 的存在,使晶胞沿一个方向拉
长,晶胞呈长.方.体.(如图)。
① 每个 Ca2+周围距离相等且最近的 C 2-2 有_____个。
② 已知:CaC2晶体密度为 ρ g·cm-3,晶胞中两个 C 2-2 的最.近.距.离.为 a cm,阿伏加德罗常数值为
NA,则 CaC2晶胞中棱长 h=______cm。
18.(13 分)治疗癌症的有机小分子酯类药物 X 被批准使用。以芳香族化合物 A 为主要原料合成 X 的路线
如下(部分反应条件已略去):
第5页/共7页
回答下列问题:
(1)写出 A 的结构简式______;D 的名称(系统命名法)是______。
(2)D 生成 E 的反应类型为______。
(3)写出 C 和 G 在一定条件下反应生成酯类药物 X 的化学方程式______。
(4)已知:
①下列有关 C 的说法正确的是______。
a.C 能与 Na2CO3反应
b.C 能与盐酸反应
c.C 和甘氨酸(H2N—CH2COOH)在一定条件下反应的产物一定为
② C 在一定条件下发生分子间脱水,生成含有三个六元环的化合物 Y,写出 Y 的结构简式
______。
③ C 在一定条件下发生分子间脱水,生成高分子化合物,写出该反应的化学方程式______。
(5)参照上述合成路线和信息,写出以乙烯、乙醚、环氧乙烷为原料(其他无机试剂任选)合成 1,6-己
二酸(HOOCCH2CH2CH2CH2COOH)的路线。
19.(13 分)某实验小组同学探究银氨溶液的性质进行如下实验。
Ⅰ. 制备银氨溶液(实验中所用氨水均为新制氨水)
实验装置 实验操作及现象
向试管中逐滴滴入 2%氨水,不断振荡,______,制得银氨溶液。
1mL 2% AgNO3 溶液
第6页/共7页
资料:ⅰ.AgOH 为白色沉淀且不稳定,极易分解生成棕褐色 Ag2O。
+
ⅱ.Ag2O 易溶于氨水生成[Ag(NH3)2] 。
ⅲ. Ag(NH ) + + 2H+ + Cl- 3 2 AgCl + 2NH +4
(1)银氨溶液制备中,小组同学预测实验Ⅰ中的现象应为______。
(2)实际操作中,同学发现滴加氨水后先出现棕褐色沉淀,后沉淀消失。写出棕褐色沉淀消失的化
学方程式______。
(3)在配合物[Ag(NH3)2]OH 中,提供空轨道用以形成配位键的微粒是______,1mol 该配合物中含
有的共价键数目为______NA。
Ⅱ. 实验小组同学在进行银镜反应时发现试管内有黑色物质产生,并对其成分展开探究。
【提出猜想】
猜想 a:黑色物质可能含有 Ag2O
猜想 b:黑色物质可能含有碳
猜想 c:黑色物质可能含有银
【验证猜想】设计如下实验:
序号 实验方案 实验现象 实验结论
① 取洗涤后的黑色物质于洁净试管中,加入试剂 振荡静置后发现固体明显减 猜想 a 成立
A,振荡静置,取上层清液与盐酸反应,观察现 少。上层清液加盐酸后出现
象。 沉淀。
② 将上述反应未溶解的固体洗净后,溶于稀硝酸, 固体完全溶解 猜想 b 不成立
一段时间后,观察现象。
③ 取②中所得溶液先滴加稀盐酸,再滴加过量氨 猜想 c 成立
水,观察现象。
(4)实验①中试剂 A 为______;实验③中现象为______。
(5)部分小组同学未观察到银镜出现,推测乙醛可能变质。
已知:乙醛在常温下会聚合生成三聚乙醛。
试从官能团或结构角度解释无银镜出现的可能原因是______。
Ⅲ. 小组同学向 2mL 银氨溶液中滴加 5 滴 10%NaOH 溶液,立即产生棕黑色浑浊;置于沸水浴中加热,
有气体产生;一段时间后溶液逐渐变黑,最终试管壁附着光亮银镜。
(6)经检验黑色物质中有 Ag2O,产生 Ag2O 的原因是______ (用离子方程式表示)。
第7页/共7页
化 学
2024.07
考 1.本试卷共 8 页,共 19 道小题,满分 100 分。考试时间 90 分钟。
生 2.在试卷和答题卡上准确填写学校、班级、姓名和准考证号。
须 3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
知 4.在答题卡上,选择题用 2B 铅笔作答,其他试题用黑色字迹签字笔作答。
可能用到的相对原子质量:C 12 Ca 40
第一部分 选择题(共 42 分)
本部分每小题只.有.一.个.选.项.符合题意,每小题 3 分
1.某烷烃的结构简式为 ,其系统命名是
A.2,4 -二甲基己烷 B.2-甲基-4-乙基戊烷
C.4-甲基-2-乙基戊烷 D.3,5-二甲基己烷
2.下列化学用语或模型表述不.正.确.的是
A.乙炔的空间填充模型:
B.羟基的电子式:
C.基态 Cr 原子的价层电子排布式:3d44s2
D.聚丙烯的结构简式:
3.下列有机化合物,不.属.于.醛类物质的是
A.HCHO B. C.CH2=CHCHO D.CH2=CHCHO
4.用下图装置探究 1-溴丁烷在氢氧化钠乙醇溶液中发生的反应,下列分析不.正.确.的是
A.用红外光谱可检验在该条件下生成有机物中的官能团
第1页/共7页
B.若酸性 KMnO4溶液褪色,推断反应一定生成了 1-丁烯
C.将试管中溶液改为溴水,若溴水褪色,则烧瓶中一定发生消去反应
D.
5.PH3 、NH3和 H2O 的分子空间结构和相应的键角如图所示。下列说法不.正.确.的是
A.N、O、P 都是元素周期表中的 p 区元素
B.PH3相对分子质量大于 NH3,故沸点:PH3 > NH3
C.H2O 的键角小于 NH3,因为 H2O 中孤电子对与成键电子对之间的斥力更大
D.上述分子的 VSEPR 模型均为四面体
6.下列说法不.正.确.的是
A.用酸性 KMnO4溶液可以鉴别 和
B.油脂是高级脂肪酸与甘油形成的酯
C.用 FeCl3溶液可以鉴别苯酚溶液与乙醇
D.某有机化合物的相对分子质量为 58,其分子式一定为 C4H10
7. 下列分子或离子中,VSEPR 模型和空间结构不.一.致.的是
-
A.CO 22 B.SO4 C.BeCl2 D.H O+3
8.下列物质性质的比较,与氢键无.关.的是
A.密度:水 > 冰
B.熔点:NH4Cl > HCl
C.沸点:
D.沸点: 乙二醇 > 正丙醇
9.下列化学方程式书写不.正.确.的是
A.苯与液溴反应:
B.溴乙烷与 NaOH 溶液共热:
C.实验室利用乙醇制备乙烯:
D.向苯酚钠溶液中通入少量 CO2:
10.阿斯巴甜是一种合成甜味剂,其结构简式如下。
第2页/共7页
下列关于阿斯巴甜的说法不.正.确.的是
A.阿斯巴甜中含有 4 种官能团 B.分子中碳原子有 sp2、sp3两种杂化方式
C.可以发生取代反应、加成反应 D.1 mol 阿斯巴甜最多能与 2 mol NaOH 反应
11.我国科学家最新合成出一种聚醚酯(PM)新型材料,可实现“单体-聚合物-单体”的闭合循
环,推动塑料经济的可持续发展。合成方法如下:
下列说法不.正.确.的是
A.M 分子中含有 2 个手性碳原子
B.M 在碱性条件下水解开环得到
C.PM 中含有酯基、醚键和羟基三种官能团
D.合成 1mol PM,理论上需要 n mol M 和 1mol 苯甲醇
+
12.在碱性溶液中,Cu2 可以与缩二脲形成紫色配离子,其结构如下图所示。
下列说法不正确的是
A.该配离子与水分子形成氢键的原子只有 N 和 O
B.该配离子中铜离子的配位数是 4
C.基态 Cu 原子的价电子排布式是 3d104s1
D.该配离子中非金属元素的电负性大小顺序为 O > N > C > H
13.下列实验装置能达到实验目的的是
A.制备并收集 B.制备乙炔并验证乙炔 C.证明苯环使 D.证明苯酚的酸
第3页/共7页
乙酸乙酯 的还原性 羟基活化 性比碳酸的弱
14.为研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
向 CuSO4溶液中逐滴加入氨水至过 产生蓝色沉淀,后溶解,得到深蓝色的
①
量 溶液
② 再加入无水乙醇 得到深蓝色晶体
将深蓝色晶体洗净后溶于水配成溶
③ 无蓝色沉淀生成
液,再加入稀 NaOH 溶液
A.在深蓝色的配离子[Cu(NH 2+ 2+3)4] 中,Cu 提供空轨道,NH3给出孤电子对
B.加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
2+ 2+ -C.该实验条件下,Cu 与 NH3的结合能力大于 Cu 与 OH 的结合能力
D.向③中深蓝色溶液中加入 BaCl2溶液,不会产生白色沉淀
第二部分 非选择题(共 58 分)
15.(11 分)有机化合物在人类生活和社会经济发展中具有重要的作用。
I. 维生素 C 是重要的营养素,其分子结构如图所示:
(1)维生素 C 分子中含有的官能团的名称是______。
(2)维生素 C 是水溶性维生素,其易溶于水的可能原因是______。
(3)维生素 C 具有较强的还原性,又被称为抗坏血酸。向 I2和淀粉溶液中加入维生素 C,可能观察
到的现象是______。
II. 乙酰水杨酸是使用广泛的解热镇痛剂,合成原理为:
(1)水杨酸的分子式为______。
(2)合成乙酰水杨酸的反应类型为______。
(3)写出一种符合下列条件的水杨酸的同分异构体的结构简式______。
①能发生银镜反应 ②遇 FeCl3溶液显紫色 ③苯环上的一溴取代物只有 2 种
(4)一定条件下,乙酰氯(CH3COCl )与水杨酸反应可以生成乙酰水杨酸,写出该反应的化学方程式
______。
(5)乙酰水杨酸与足量 NaOH 溶液反应的化学方程式为______。
16.(10 分)有机化合物 G 在工业上可用于制作印刷油墨、合成树脂等的溶剂。以 A 为原料合成 G 的转化
第4页/共7页
路线如下所示(部分反应条件已略去)。
(1)写出 A 的结构简式______,A→E 的反应类型为______。
(2)写出 B→C 的化学方程式______。
(3)用新制的 Cu(OH)2浊液可检验 C 中的官能团,实验现象是______,写出反应的化学方程式
______。
(4)试剂 a 是______。
(5)写出 D + F→G 的化学方程式______。
17.(11 分)工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔(俗称电石气),乙炔
是合成橡胶、合成纤维和塑料的单体。
(1)乙炔分子的空间构型为______形,乙炔分子中 σ 键和 π 键数目之比为______。
(2)乙炔与 HCN 通过______ (填反应类型)可制得丙烯腈(H2C=CH-C≡N),丙烯腈分子中碳原子轨道
杂化类型有______。
(3) 乙炔无明显酸性但氢氰酸(HCN)有酸性,解释 HCN 的酸性比乙炔强的原因____。
(4)乙炔和银氨溶液反应会生成乙炔银(AgC≡CAg),推测反应中生成的一种阳离子为______ (填化学
式)。
(5)CaC2晶体的晶胞结构与 NaCl 晶体相似,但 CaC 晶体中哑铃形 C 2-2 2 的存在,使晶胞沿一个方向拉
长,晶胞呈长.方.体.(如图)。
① 每个 Ca2+周围距离相等且最近的 C 2-2 有_____个。
② 已知:CaC2晶体密度为 ρ g·cm-3,晶胞中两个 C 2-2 的最.近.距.离.为 a cm,阿伏加德罗常数值为
NA,则 CaC2晶胞中棱长 h=______cm。
18.(13 分)治疗癌症的有机小分子酯类药物 X 被批准使用。以芳香族化合物 A 为主要原料合成 X 的路线
如下(部分反应条件已略去):
第5页/共7页
回答下列问题:
(1)写出 A 的结构简式______;D 的名称(系统命名法)是______。
(2)D 生成 E 的反应类型为______。
(3)写出 C 和 G 在一定条件下反应生成酯类药物 X 的化学方程式______。
(4)已知:
①下列有关 C 的说法正确的是______。
a.C 能与 Na2CO3反应
b.C 能与盐酸反应
c.C 和甘氨酸(H2N—CH2COOH)在一定条件下反应的产物一定为
② C 在一定条件下发生分子间脱水,生成含有三个六元环的化合物 Y,写出 Y 的结构简式
______。
③ C 在一定条件下发生分子间脱水,生成高分子化合物,写出该反应的化学方程式______。
(5)参照上述合成路线和信息,写出以乙烯、乙醚、环氧乙烷为原料(其他无机试剂任选)合成 1,6-己
二酸(HOOCCH2CH2CH2CH2COOH)的路线。
19.(13 分)某实验小组同学探究银氨溶液的性质进行如下实验。
Ⅰ. 制备银氨溶液(实验中所用氨水均为新制氨水)
实验装置 实验操作及现象
向试管中逐滴滴入 2%氨水,不断振荡,______,制得银氨溶液。
1mL 2% AgNO3 溶液
第6页/共7页
资料:ⅰ.AgOH 为白色沉淀且不稳定,极易分解生成棕褐色 Ag2O。
+
ⅱ.Ag2O 易溶于氨水生成[Ag(NH3)2] 。
ⅲ. Ag(NH ) + + 2H+ + Cl- 3 2 AgCl + 2NH +4
(1)银氨溶液制备中,小组同学预测实验Ⅰ中的现象应为______。
(2)实际操作中,同学发现滴加氨水后先出现棕褐色沉淀,后沉淀消失。写出棕褐色沉淀消失的化
学方程式______。
(3)在配合物[Ag(NH3)2]OH 中,提供空轨道用以形成配位键的微粒是______,1mol 该配合物中含
有的共价键数目为______NA。
Ⅱ. 实验小组同学在进行银镜反应时发现试管内有黑色物质产生,并对其成分展开探究。
【提出猜想】
猜想 a:黑色物质可能含有 Ag2O
猜想 b:黑色物质可能含有碳
猜想 c:黑色物质可能含有银
【验证猜想】设计如下实验:
序号 实验方案 实验现象 实验结论
① 取洗涤后的黑色物质于洁净试管中,加入试剂 振荡静置后发现固体明显减 猜想 a 成立
A,振荡静置,取上层清液与盐酸反应,观察现 少。上层清液加盐酸后出现
象。 沉淀。
② 将上述反应未溶解的固体洗净后,溶于稀硝酸, 固体完全溶解 猜想 b 不成立
一段时间后,观察现象。
③ 取②中所得溶液先滴加稀盐酸,再滴加过量氨 猜想 c 成立
水,观察现象。
(4)实验①中试剂 A 为______;实验③中现象为______。
(5)部分小组同学未观察到银镜出现,推测乙醛可能变质。
已知:乙醛在常温下会聚合生成三聚乙醛。
试从官能团或结构角度解释无银镜出现的可能原因是______。
Ⅲ. 小组同学向 2mL 银氨溶液中滴加 5 滴 10%NaOH 溶液,立即产生棕黑色浑浊;置于沸水浴中加热,
有气体产生;一段时间后溶液逐渐变黑,最终试管壁附着光亮银镜。
(6)经检验黑色物质中有 Ag2O,产生 Ag2O 的原因是______ (用离子方程式表示)。
第7页/共7页
同课章节目录
