1.2.1研究有机物的一般方法第一课时课件(共20张ppt)高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1研究有机物的一般方法第一课时课件(共20张ppt)高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-09 15:15:21 | ||
图片预览






文档简介
(共20张PPT)
研究有机物的一般步骤:
分离、提纯
元素定量分析
确定实验式
测定相对分子质量
确定分子式
现代仪器分析确定结构式
分离
提纯
蒸馏
重结晶
萃取
一、物质分离和提纯
物质提纯的原则:
不增、不减、易分、易还原
分离是把混合物分成几种纯净物;提纯是除去杂质。
蒸馏
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(2)蒸馏提纯的条件
被提纯有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
常用于分离、提纯液态有机物
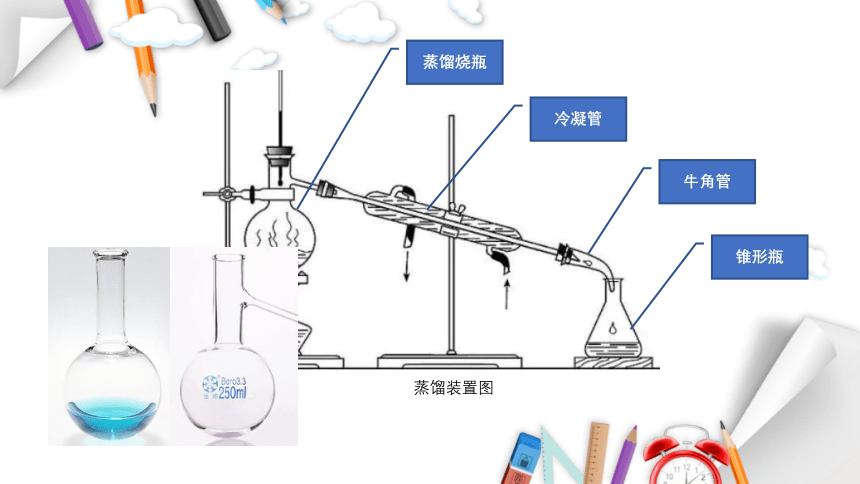
蒸馏装置图
蒸馏烧瓶
冷凝管
牛角管
锥形瓶
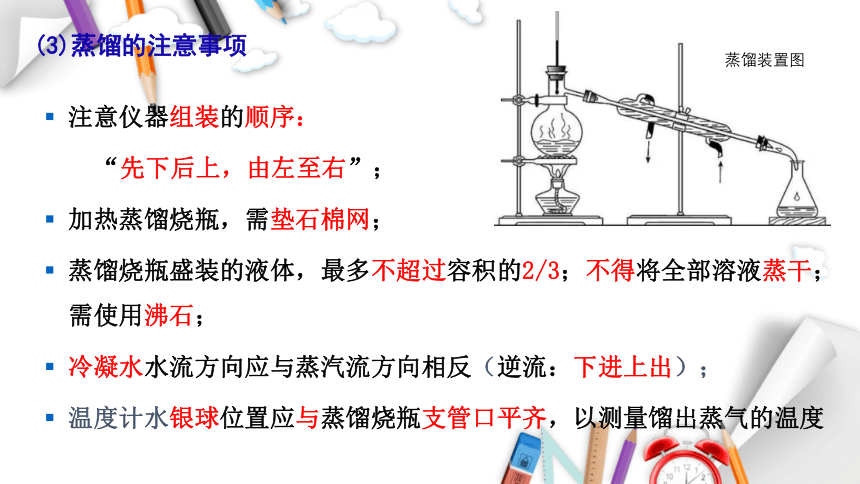
(3)蒸馏的注意事项
注意仪器组装的顺序:
“先下后上,由左至右”;
加热蒸馏烧瓶,需垫石棉网;
蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;需使用沸石;
冷凝水水流方向应与蒸汽流方向相反(逆流:下进上出);
温度计水银球位置应与蒸馏烧瓶支管口平齐,以测量馏出蒸气的温度
蒸馏装置图
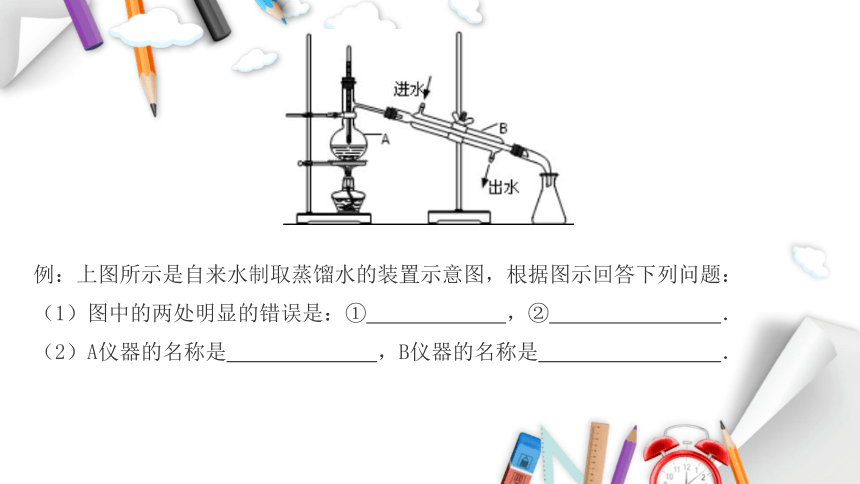
例:上图所示是自来水制取蒸馏水的装置示意图,根据图示回答下列问题:
(1)图中的两处明显的错误是:① ,② .
(2)A仪器的名称是 ,B仪器的名称是 .
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇(99.5%以上)
蒸馏
加CaO
蒸馏
通过第一次蒸馏得到的酒精仍然含有少量水,要得到无水酒精需要加入CaO等吸水剂再蒸馏
练习
欲用96%的工业酒精制取无水乙醇时,可
选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏
√
萃取
(1)蒸馏的原理
利用待分离组分在两种互不相溶的溶剂里的溶解度的不同
(2)萃取剂的选择
萃取剂和原溶剂不相溶、不反应;
待分离组分在萃取剂中的溶解度大于在原溶剂中的溶解度
用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法
萃取
固—液萃取
液—液萃取
液-液萃取的步骤
振荡
萃取
分液
洗涤、检漏
分液
将萃取后的两层液体分开的操作。
分液时注意下层液体从下口放出,上层液体从上口倒出。
萃取使用的仪器——分液漏斗
活塞
瓶塞(玻璃塞)
凹槽、小孔
1.分液时,要将漏斗上口的玻璃塞打开或使塞
上的凹槽对准漏斗口上的小孔,使空气进入分
液漏斗,让分液漏斗内外压力相等,确保液体顺利流下。
2.分液时,漏斗下端管口紧靠烧杯内壁
3.分液时下层液体从下口流出,上层液体从上口倒出
分液的操作要点:
[练习]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和甲苯
C 汽油和苯 D 硝基苯和水
B D
D
资料:大多数有机物与水不互溶,烃的密度小于水。
固-液萃取:色谱法
吸附剂:碳酸钙、硅胶、氧化铝、活性炭
分类:
1、柱色谱法
2、纸上色谱法
3、薄层色谱法
4、气相色谱法
5、液相色谱法
重结晶
选取合适的溶剂,满足以下要求:
⑴杂质在该溶剂中溶解度很大或很小,易除去;
⑵被提纯的有机物在该溶剂中溶解度受温度影响比较大。方便进行冷却结晶。
重结晶是将晶体溶于溶剂以后,又重新从溶液中结晶的过程。
它是利用被提纯物质与杂质在同一溶剂中的溶解度不同而除去
杂质的一种提纯固体有机物的常用方法。
苯甲酸的重结晶实验
步骤:
将粗苯甲酸溶于热水,制成热的饱和溶液。
过滤除去不溶性杂质。(包括脱色)
冷却结晶、过滤(抽滤),除去可溶性杂质。
洗涤干燥晶体,除去附着的溶剂。
不纯固体物质
滤渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成热饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
研究有机物的一般步骤:
分离、提纯
元素定量分析
确定实验式
测定相对分子质量
确定分子式
现代仪器分析确定结构式
分离
提纯
蒸馏
重结晶
萃取
一、物质分离和提纯
物质提纯的原则:
不增、不减、易分、易还原
分离是把混合物分成几种纯净物;提纯是除去杂质。
蒸馏
(1)蒸馏的原理
利用混合物的沸点不同,除去难挥发或不挥发的杂质
(2)蒸馏提纯的条件
被提纯有机物热稳定性较强;
与杂质的沸点相差较大(一般约大于30℃)
常用于分离、提纯液态有机物
蒸馏装置图
蒸馏烧瓶
冷凝管
牛角管
锥形瓶
(3)蒸馏的注意事项
注意仪器组装的顺序:
“先下后上,由左至右”;
加热蒸馏烧瓶,需垫石棉网;
蒸馏烧瓶盛装的液体,最多不超过容积的2/3;不得将全部溶液蒸干;需使用沸石;
冷凝水水流方向应与蒸汽流方向相反(逆流:下进上出);
温度计水银球位置应与蒸馏烧瓶支管口平齐,以测量馏出蒸气的温度
蒸馏装置图
例:上图所示是自来水制取蒸馏水的装置示意图,根据图示回答下列问题:
(1)图中的两处明显的错误是:① ,② .
(2)A仪器的名称是 ,B仪器的名称是 .
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇(99.5%以上)
蒸馏
加CaO
蒸馏
通过第一次蒸馏得到的酒精仍然含有少量水,要得到无水酒精需要加入CaO等吸水剂再蒸馏
练习
欲用96%的工业酒精制取无水乙醇时,可
选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏
√
萃取
(1)蒸馏的原理
利用待分离组分在两种互不相溶的溶剂里的溶解度的不同
(2)萃取剂的选择
萃取剂和原溶剂不相溶、不反应;
待分离组分在萃取剂中的溶解度大于在原溶剂中的溶解度
用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的方法
萃取
固—液萃取
液—液萃取
液-液萃取的步骤
振荡
萃取
分液
洗涤、检漏
分液
将萃取后的两层液体分开的操作。
分液时注意下层液体从下口放出,上层液体从上口倒出。
萃取使用的仪器——分液漏斗
活塞
瓶塞(玻璃塞)
凹槽、小孔
1.分液时,要将漏斗上口的玻璃塞打开或使塞
上的凹槽对准漏斗口上的小孔,使空气进入分
液漏斗,让分液漏斗内外压力相等,确保液体顺利流下。
2.分液时,漏斗下端管口紧靠烧杯内壁
3.分液时下层液体从下口流出,上层液体从上口倒出
分液的操作要点:
[练习]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和甲苯
C 汽油和苯 D 硝基苯和水
B D
D
资料:大多数有机物与水不互溶,烃的密度小于水。
固-液萃取:色谱法
吸附剂:碳酸钙、硅胶、氧化铝、活性炭
分类:
1、柱色谱法
2、纸上色谱法
3、薄层色谱法
4、气相色谱法
5、液相色谱法
重结晶
选取合适的溶剂,满足以下要求:
⑴杂质在该溶剂中溶解度很大或很小,易除去;
⑵被提纯的有机物在该溶剂中溶解度受温度影响比较大。方便进行冷却结晶。
重结晶是将晶体溶于溶剂以后,又重新从溶液中结晶的过程。
它是利用被提纯物质与杂质在同一溶剂中的溶解度不同而除去
杂质的一种提纯固体有机物的常用方法。
苯甲酸的重结晶实验
步骤:
将粗苯甲酸溶于热水,制成热的饱和溶液。
过滤除去不溶性杂质。(包括脱色)
冷却结晶、过滤(抽滤),除去可溶性杂质。
洗涤干燥晶体,除去附着的溶剂。
不纯固体物质
滤渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成热饱和溶液,趁热过滤
冷却,结晶,
过滤,洗涤
