【任务驱动式】3.1.1铁的性质(共27张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 【任务驱动式】3.1.1铁的性质(共27张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-09 18:57:57 | ||
图片预览






文档简介
(共27张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第1课时 铁的单质
目 录
CONTENTS
1
2
铁的存在
铁的性质
新课导入
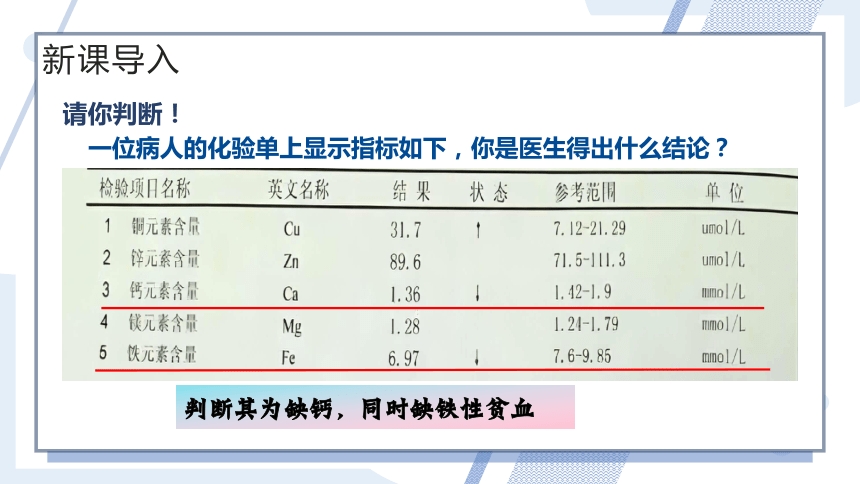
请你判断!
一位病人的化验单上显示指标如下,你是医生得出什么结论?
判断其为缺钙,同时缺铁性贫血
铁是人体必需的微量元素中含量最多的一种,人体含铁量是多少呢?
【资料卡片】P70 人体中的铁元素
铁在成人体中的含量为4~5g,是人体必需微量元素中含量最多的一种。主要分为功能性铁和储存铁。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。
为了满足生理需要,成人每天铁的适宜摄入量为15~20mg。动物内脏、肉类、鱼类、蛋类等动物性食物中的铁容易被吸收。一般蔬菜中铁的含量较少,吸收率也低,但我国膳食中一般食用蔬菜量很大,仍为铁的重要来源。我国已经实施在某些酱油中加入铁强化剂的措施,以减少缺铁性贫血问题的发生。
【思考】如何合理补铁?
新课导入
生活中的富铁食品
必要时,我们可以根据医生建议补充一些补铁口服液。
铁从哪儿来呢?
任务一 铁的存在与发现
丹霞地貌因岩层含Fe2O3而呈红色
菱铁矿(主要成分是FeCO3)
磁铁矿(主要成分是Fe3O4)
赤铁矿(主要成分是Fe2O3)
+3
Fe
+2
Fe
0
Fe
来自太空的陨铁
任务一 铁的存在与发现
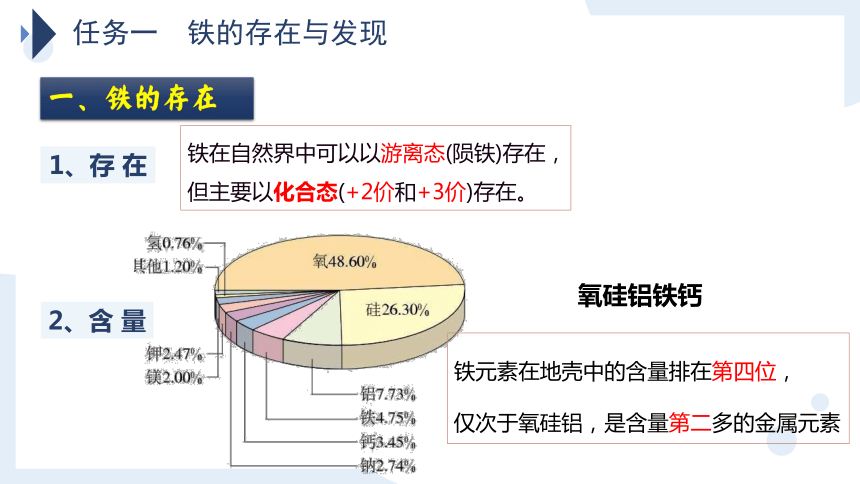
铁在自然界中可以以游离态(陨铁)存在,
但主要以化合态(+2价和+3价)存在。
1、存 在
2、含 量
铁元素在地壳中的含量排在第四位,
仅次于氧硅铝,是含量第二多的金属元素
氧硅铝铁钙
一、铁的存在
任务一 铁的存在与发现
二、铁的发现
1、最早人工冶铁制品:春秋初年秦国的铜柄铁剑。
2、战国中期以后,铁制工具在社会生产中发挥了巨大作用。
春秋战国时期最大的铁器—铁火盆
任务一 铁的存在与发现
三、铁的冶炼
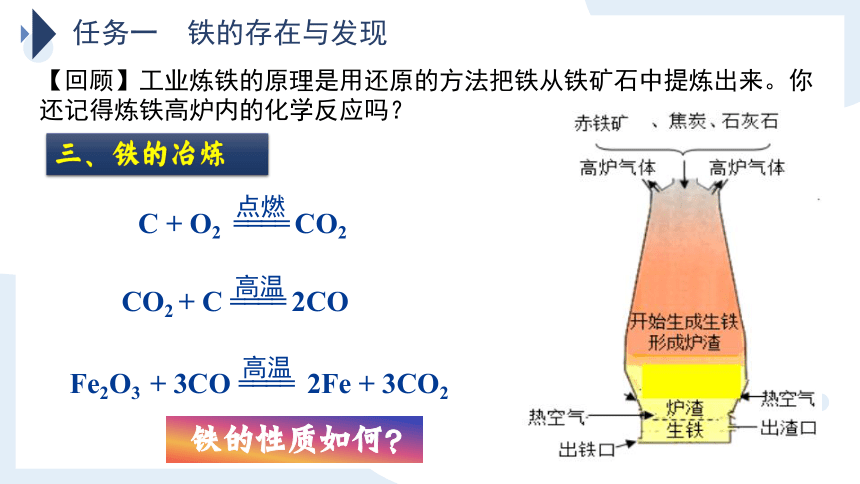
【回顾】工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来。你还记得炼铁高炉内的化学反应吗?
点燃
C + O2 ==== CO2
CO2 + C ==== 2CO
高温
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
铁的性质如何?
任务一 铁的存在与发现
2018年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
“燕麦片中是否真的含有铁粉”
【思考】配料表中的还原铁是不是铁的单质呢?该如何验证?
任务二 铁的性质
颜色 熔点/℃ 沸点/℃ 密度/ (g·cm-3) 延展性 导热性 导电性 导磁性
银白色,有金属光泽
1535
2750
7.86
良好
良好
良好
良好
铁粉
金属导电性顺序:铅<铁<铝<金<铜<银
四、铁的物理性质
任务二 铁的性质
五、铁的化学性质
经查证,部分营养麦片中的确添加了铁粉。营养麦片中添加铁粉的目的是什么呢?
Fe
物质类型角度
元素价态角度
金属单质
强还原性
非金属单质
酸溶液
某些盐溶液
Fe3+
强氧化剂
Fe2+
弱氧化剂
S、H+、Cu2+等
Cl2等
任务二 铁的性质
五、铁的化学性质
1.铁与非金属单质反应
O2
S
Cl2
2Fe+3Cl2 2FeCl3
△
现象:剧烈燃烧、火星四射、放出大量的热、生成黑色固体
现象:剧烈燃烧、产生棕褐色的烟
现象:生成黑色物质
+2、+3
+3
+2
氧化性强弱:
Cl2>O2>S
任务二 铁的性质
五、铁的化学性质
2.铁与酸反应
非强氧化性酸
硝酸、浓硫酸为强氧化性酸,后续再进行学习
微提醒
注意:铁遇到冷的浓硫酸、浓硝酸时,产生钝化现象
任务二 铁的性质
五、铁的化学性质
3. 铁与盐反应
Fe+CuSO4 = FeSO4+Cu
(1)与硫酸铜溶液反应
曾青得铁则化为铜
Fe+Cu2+ = Fe2++Cu
Fe+2Fe3+ = 3Fe2+
(2)与FeCl3溶液反应
Fe+2FeCl3= 3FeCl2
任务二 铁的性质
为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-2e-→Fe2+
Fe-3e-→Fe3+
Fe
Fe2+
Fe3+
强氧化剂
弱氧化剂
Cl2、HNO3等
S、H+、Cu2+等
课堂小结
元素
价态
0
+2
+3
Fe3+
Fe2+
Fe
Fe3O4
HCl、S、I2、Cu2+、
加弱氧化剂
Cl2、Br2、
加强氧化剂
O2
物质类别
单质
氧化物
碱
盐
铁的化学性质
学习评价
1.判断正误,正确的画“√”,错误的画“×”。
(1)铁具有导电、导热、延展性及被磁体吸引的特性 ( )
(2)Fe分别与氯气和盐酸反应所得氯化物相同 ( )
(3) 已知铁和S反应得到FeS,根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性弱 ( )
2.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液 B.氯气 C.硫酸铜溶液 D.稀盐酸
B
√
×
√
任务二 铁的性质
【问题解决】
性质决定用途,你认为营养麦片中添加铁粉的目的是什么呢?
1. 抗氧化,保持麦片新鲜。(利用铁粉与氧气的反应)
2. 补铁。 (铁粉和胃酸发生反应,生成亚铁离子,被人体吸收)
【专家建议】
1. 因为添加铁粉的含量极少,所以抗氧化效果并不佳。
2. 通过吃铁粉补充铁元素的做法并不科学,因为胃酸浓度不高,铁粉并不能完全被溶解,吸收率很低。
结论,营养麦片中添加适量铁粉不存在危害。但益处不大。这是商家的营销手段而已。
任务二 铁的性质
【思考与讨论】
通过钠和水的反应,可知水是一种较弱的氧化剂。结合生活常识以及以下材料,预测水能氧化铁吗?
材料:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
生活经验告诉我们,在常温下,铁与水是不发生反应的。根据材料,在高温下,铁可能与水发生反应。
钢水注入干燥的模具
类比钠的性质,
Fe是氢之前的金属,与水反应能不能置换出氢气?
任务二 铁的性质
【思考】 若铁在高温下能与水反应,根据所学知识预测产物。
2Na+2H2O = 2NaOH+H2↑
Fe+H2O Fe(OH)3+H2↑
铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色粉末 红棕色粉末 黑色晶体 白色 红褐色
受热 不分解 不稳定,在高温下可被水蒸气或者O2氧化 6Fe2O3=4Fe3O4+O2↑ 高温下比Fe2O3稳定 受热易分解 500 ℃
分解为Fe2O3
Fe(OH)3 Fe2O3 (500℃以上分解)
Fe+H2O Fe3O4+H2↑
?
任务二 铁的性质
研究物质性质的一般程序
性质预测
设计方案
得出结论
实验探究
观察并通过实验验证你的预测的准确性(铁能与水及产物)
课本P70
任务二 铁的性质
五、铁的化学性质
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后, 再点燃酒精灯加热还原铁粉;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
【实验注意事项】
任务二 铁的性质
五、铁的化学性质
如何验证生成的固体是四氧化三铁?
试管冷却后,利用磁铁在试管外侧吸一吸,若固体被吸引,证明固体是四氧化三铁。
【实验现象】
铁粉逐渐红热,
烧杯中产生大量的肥皂泡,
点燃气泡会发出爆鸣声,
反应后试管内固体为黑色。
4.铁与水蒸汽反应
学习评价
3、下列有关铁及其化合物的说法中不正确的是 ( ) A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸 D.氯化铁溶液有较强氧化性,故可用作净水剂
D
4、铁在一定条件下与Cl2、O2、S反应的产物分别为FeCl3、Fe3O4、FeS,
下列有关说法正确的是( )
A.三种非金属单质中,S的氧化性最弱
B.等量的铁分别与Cl2、O2、S反应,转移的电子数相等
C.反应生成的三种产物都只具有氧化性
D.反应生成的三种产物都是易溶于水的固体
A
学习评价
5、用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g) Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
B
课堂小结
物质类别角度
二、铁的化学性质
一、铁的物理性质
氧化还原
反应角度
1. 与非金属单质反应
2. 与某些盐反应
3. 与酸反应
4. 与水反应 活泼金属与水的反应
铁是银白色具有金属光泽的固体,具有延展性、导电性、 导热性,具有磁性。熔点:1535℃,沸点:2750℃ ,密度:7.86 g/cm3 。
与Cl2等强氧化剂反应Fe-3e- → Fe3+
与盐酸、硫酸铜等弱氧化剂反应Fe-2e- → Fe2+
第三章 铁 金属材料
第一节 铁及其化合物
第1课时 铁的单质
目 录
CONTENTS
1
2
铁的存在
铁的性质
新课导入
请你判断!
一位病人的化验单上显示指标如下,你是医生得出什么结论?
判断其为缺钙,同时缺铁性贫血
铁是人体必需的微量元素中含量最多的一种,人体含铁量是多少呢?
【资料卡片】P70 人体中的铁元素
铁在成人体中的含量为4~5g,是人体必需微量元素中含量最多的一种。主要分为功能性铁和储存铁。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。
为了满足生理需要,成人每天铁的适宜摄入量为15~20mg。动物内脏、肉类、鱼类、蛋类等动物性食物中的铁容易被吸收。一般蔬菜中铁的含量较少,吸收率也低,但我国膳食中一般食用蔬菜量很大,仍为铁的重要来源。我国已经实施在某些酱油中加入铁强化剂的措施,以减少缺铁性贫血问题的发生。
【思考】如何合理补铁?
新课导入
生活中的富铁食品
必要时,我们可以根据医生建议补充一些补铁口服液。
铁从哪儿来呢?
任务一 铁的存在与发现
丹霞地貌因岩层含Fe2O3而呈红色
菱铁矿(主要成分是FeCO3)
磁铁矿(主要成分是Fe3O4)
赤铁矿(主要成分是Fe2O3)
+3
Fe
+2
Fe
0
Fe
来自太空的陨铁
任务一 铁的存在与发现
铁在自然界中可以以游离态(陨铁)存在,
但主要以化合态(+2价和+3价)存在。
1、存 在
2、含 量
铁元素在地壳中的含量排在第四位,
仅次于氧硅铝,是含量第二多的金属元素
氧硅铝铁钙
一、铁的存在
任务一 铁的存在与发现
二、铁的发现
1、最早人工冶铁制品:春秋初年秦国的铜柄铁剑。
2、战国中期以后,铁制工具在社会生产中发挥了巨大作用。
春秋战国时期最大的铁器—铁火盆
任务一 铁的存在与发现
三、铁的冶炼
【回顾】工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来。你还记得炼铁高炉内的化学反应吗?
点燃
C + O2 ==== CO2
CO2 + C ==== 2CO
高温
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
铁的性质如何?
任务一 铁的存在与发现
2018年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
“燕麦片中是否真的含有铁粉”
【思考】配料表中的还原铁是不是铁的单质呢?该如何验证?
任务二 铁的性质
颜色 熔点/℃ 沸点/℃ 密度/ (g·cm-3) 延展性 导热性 导电性 导磁性
银白色,有金属光泽
1535
2750
7.86
良好
良好
良好
良好
铁粉
金属导电性顺序:铅<铁<铝<金<铜<银
四、铁的物理性质
任务二 铁的性质
五、铁的化学性质
经查证,部分营养麦片中的确添加了铁粉。营养麦片中添加铁粉的目的是什么呢?
Fe
物质类型角度
元素价态角度
金属单质
强还原性
非金属单质
酸溶液
某些盐溶液
Fe3+
强氧化剂
Fe2+
弱氧化剂
S、H+、Cu2+等
Cl2等
任务二 铁的性质
五、铁的化学性质
1.铁与非金属单质反应
O2
S
Cl2
2Fe+3Cl2 2FeCl3
△
现象:剧烈燃烧、火星四射、放出大量的热、生成黑色固体
现象:剧烈燃烧、产生棕褐色的烟
现象:生成黑色物质
+2、+3
+3
+2
氧化性强弱:
Cl2>O2>S
任务二 铁的性质
五、铁的化学性质
2.铁与酸反应
非强氧化性酸
硝酸、浓硫酸为强氧化性酸,后续再进行学习
微提醒
注意:铁遇到冷的浓硫酸、浓硝酸时,产生钝化现象
任务二 铁的性质
五、铁的化学性质
3. 铁与盐反应
Fe+CuSO4 = FeSO4+Cu
(1)与硫酸铜溶液反应
曾青得铁则化为铜
Fe+Cu2+ = Fe2++Cu
Fe+2Fe3+ = 3Fe2+
(2)与FeCl3溶液反应
Fe+2FeCl3= 3FeCl2
任务二 铁的性质
为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-2e-→Fe2+
Fe-3e-→Fe3+
Fe
Fe2+
Fe3+
强氧化剂
弱氧化剂
Cl2、HNO3等
S、H+、Cu2+等
课堂小结
元素
价态
0
+2
+3
Fe3+
Fe2+
Fe
Fe3O4
HCl、S、I2、Cu2+、
加弱氧化剂
Cl2、Br2、
加强氧化剂
O2
物质类别
单质
氧化物
碱
盐
铁的化学性质
学习评价
1.判断正误,正确的画“√”,错误的画“×”。
(1)铁具有导电、导热、延展性及被磁体吸引的特性 ( )
(2)Fe分别与氯气和盐酸反应所得氯化物相同 ( )
(3) 已知铁和S反应得到FeS,根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性弱 ( )
2.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( )
A.氯化铁溶液 B.氯气 C.硫酸铜溶液 D.稀盐酸
B
√
×
√
任务二 铁的性质
【问题解决】
性质决定用途,你认为营养麦片中添加铁粉的目的是什么呢?
1. 抗氧化,保持麦片新鲜。(利用铁粉与氧气的反应)
2. 补铁。 (铁粉和胃酸发生反应,生成亚铁离子,被人体吸收)
【专家建议】
1. 因为添加铁粉的含量极少,所以抗氧化效果并不佳。
2. 通过吃铁粉补充铁元素的做法并不科学,因为胃酸浓度不高,铁粉并不能完全被溶解,吸收率很低。
结论,营养麦片中添加适量铁粉不存在危害。但益处不大。这是商家的营销手段而已。
任务二 铁的性质
【思考与讨论】
通过钠和水的反应,可知水是一种较弱的氧化剂。结合生活常识以及以下材料,预测水能氧化铁吗?
材料:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
生活经验告诉我们,在常温下,铁与水是不发生反应的。根据材料,在高温下,铁可能与水发生反应。
钢水注入干燥的模具
类比钠的性质,
Fe是氢之前的金属,与水反应能不能置换出氢气?
任务二 铁的性质
【思考】 若铁在高温下能与水反应,根据所学知识预测产物。
2Na+2H2O = 2NaOH+H2↑
Fe+H2O Fe(OH)3+H2↑
铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色粉末 红棕色粉末 黑色晶体 白色 红褐色
受热 不分解 不稳定,在高温下可被水蒸气或者O2氧化 6Fe2O3=4Fe3O4+O2↑ 高温下比Fe2O3稳定 受热易分解 500 ℃
分解为Fe2O3
Fe(OH)3 Fe2O3 (500℃以上分解)
Fe+H2O Fe3O4+H2↑
?
任务二 铁的性质
研究物质性质的一般程序
性质预测
设计方案
得出结论
实验探究
观察并通过实验验证你的预测的准确性(铁能与水及产物)
课本P70
任务二 铁的性质
五、铁的化学性质
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后, 再点燃酒精灯加热还原铁粉;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
【实验注意事项】
任务二 铁的性质
五、铁的化学性质
如何验证生成的固体是四氧化三铁?
试管冷却后,利用磁铁在试管外侧吸一吸,若固体被吸引,证明固体是四氧化三铁。
【实验现象】
铁粉逐渐红热,
烧杯中产生大量的肥皂泡,
点燃气泡会发出爆鸣声,
反应后试管内固体为黑色。
4.铁与水蒸汽反应
学习评价
3、下列有关铁及其化合物的说法中不正确的是 ( ) A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸 D.氯化铁溶液有较强氧化性,故可用作净水剂
D
4、铁在一定条件下与Cl2、O2、S反应的产物分别为FeCl3、Fe3O4、FeS,
下列有关说法正确的是( )
A.三种非金属单质中,S的氧化性最弱
B.等量的铁分别与Cl2、O2、S反应,转移的电子数相等
C.反应生成的三种产物都只具有氧化性
D.反应生成的三种产物都是易溶于水的固体
A
学习评价
5、用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g) Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
B
课堂小结
物质类别角度
二、铁的化学性质
一、铁的物理性质
氧化还原
反应角度
1. 与非金属单质反应
2. 与某些盐反应
3. 与酸反应
4. 与水反应 活泼金属与水的反应
铁是银白色具有金属光泽的固体,具有延展性、导电性、 导热性,具有磁性。熔点:1535℃,沸点:2750℃ ,密度:7.86 g/cm3 。
与Cl2等强氧化剂反应Fe-3e- → Fe3+
与盐酸、硫酸铜等弱氧化剂反应Fe-2e- → Fe2+
