1.1.2热化学方程式的书写(共17张ppt)人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2热化学方程式的书写(共17张ppt)人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-10 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
第一章 化学反应的热效应
第一节 反应热
第2课时 热化学方程式
两个方程式有什么不同?所表达的意义是怎样的?
2H2 +Cl2 2HCl
2H2(g) +Cl2(g) 2HCl (g) ΔH= - 184.6kJ/mol
101 kPa
25 ℃
一、热化学方程式
1.概念
表示参加反应的物质的量与反应热的关系的化学方程式
2.意义
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
物质变化
能量变化
表示1mol气态H2与1mol气态Cl2完全反应,生成2mol气态HCl时,放出 184.6kJ的热量。
H2(g) +Cl2(g) 2HCl (g) ΔH= - 184.6kJ/mol
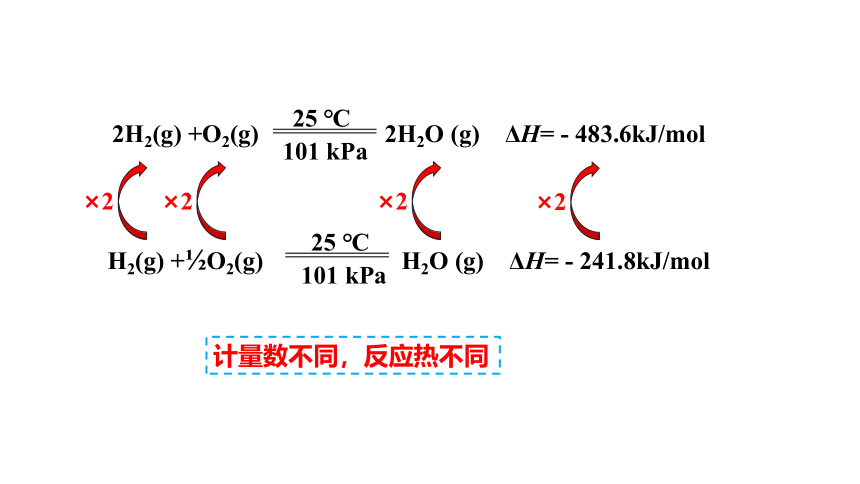
2H2(g) +O2(g) 2H2O (g) ΔH= - 483.6kJ/mol
101 kPa
25 ℃
H2(g) + O2(g) H2O (g) ΔH= - 241.8kJ/mol
101 kPa
25 ℃
×2
×2
×2
×2
计量数不同,反应热不同
2H2(g) +O2(g) 2H2O (g) ΔH= - 483.6 kJ/mol
101 kPa
25 ℃
2H2(g) +O2(g) 2H2O (l) ΔH= - 571.6 kJ/mol
101 kPa
25 ℃
物质状态不同,反应热不同
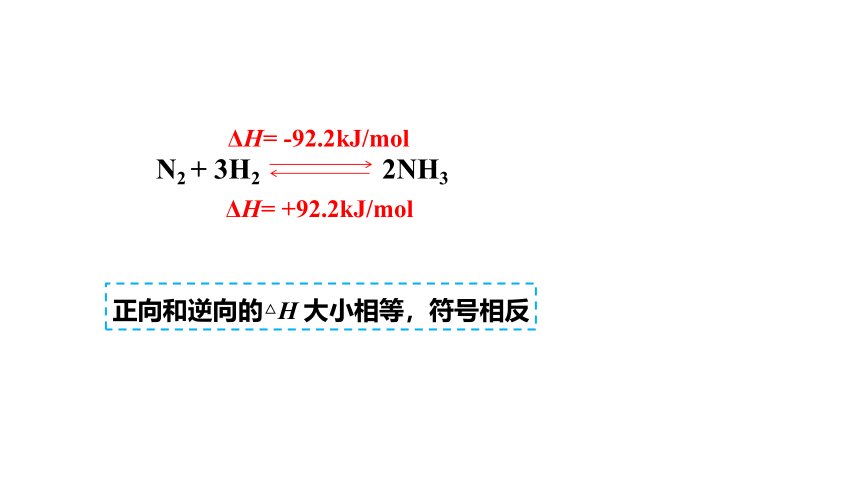
N2 + 3H2 2NH3
ΔH= -92.2kJ/mol
ΔH= +92.2kJ/mol
正向和逆向的△H 大小相等,符号相反
3.书写热化学方程式的注意事项 教材P9
(1)需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa
(2)各物质需标聚集状态(s、l、g、aq)反应条件如:高温、加热、催化剂及“↑和↓”不用注明
(3)化学方程式的右边必须写上△H,并用“空格”隔开, △H吸热用“+”,放热用“-”,单位是kJ/mol
(4)热化学方程式中各物质化学计量数表示各物质的物质的量,可以为整数、分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。
(5)对可逆反应,正向和逆向的△H 大小相等,符号相反
(6)可逆反应中的△H 是指正反应完全进行时的反应热
反应X aA + bB === cC + dD
mol-1 ( aA + bB === cC + dD )
二、热化学方程式的书写 系统集成P8
【课堂练习】
1.写出下列反应的热化学方程式:(1)1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8 kJ热量。
(2)1mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量。
(3)3mol NO2(g)与1 mol H2O(l)反应生成HNO3(aq)和NO(g),放出138 kJ热量。
C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=-1366.8 kJ·mol-1
C(石墨,s)+H2O(g) = CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
3NO2(g)+H2O(l) = 2HNO3(aq)+NO(g) ΔH=-138 kJ·mol-1
2.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )A.碳和水反应吸收131.3 kJ的热量B.1mol碳和1mol水反应生成1mol一氧化碳和1mol氢气,并吸收131.3kJ热量C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收131.3 kJ的热量D.1个固态碳原子和1分子水蒸气反应吸收131.3 kJ的热量
C
方法指导
三、热化学方程式正误判断的方法
1.判断下列热化学方程式书写是否正确,正确的画“√”,错误的画“×”
(注:焓变数据均正确)。 (1)CaCO3(s) = CaO(s)+CO2(g) ΔH=+177.7 kJ ( ) (2)C(s)+H2O(s) = CO(g)+H2(g) ΔH=-131.3 kJ·mol-1 ( ) (3)C(s)+1/2O2(g) = CO(g) ΔH=-110.5 kJ·mol-1 ( )
(4)CO(g)+1/2O2(g) = CO2(g) ΔH=-283 kJ·mol-1 ( )
(5)2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1 ( )
【课堂练习】
×
×
√
√
√
2.(双选)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.4 kJ的热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(g) ΔH=-48.4 kJ·mol-1
B.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(l) ΔH=+5 517.6 kJ·mol-1
D.2C8H18(l)+25O2(g) = 16CO2(g)+18H2O(l) ΔH=-11035.2 kJ·mol-1
【课堂练习】
BD
2H2(g)+O2(g) = 2H2O(g) △H1= -Q1kJ/mol
2H2(g)+O2(g) = 2H2O(l) △H2= -Q2kJ/mol
请比较Q1和 Q2, △H1和△H2的大小。
注意:热量Q比较比数值,
△H 的比较要带符号
在同温同压下,下列各组热化学方程式中Q2 > Q1的是 ( ) A. H2(g) + Cl2(g) = 2HCl(g) △H1 =-Q1 1/2H2(g) + 1/2 Cl2(g) = HCl(g) △H2 =-Q2 B. C(s) + 1/2O2(g) = CO(g) △H1 =-Q1 C(s) + O2 (g) = CO2(g) △H2 =-Q2 C. 2H2(g) + O2 (g) = 2H2O(l) △H1 =-Q1 2H2(g) + O2 (g) = 2H2O(g) △H2 =-Q2 D. S(g) + O2(g) = SO2(g) △H1 =-Q1 S(s) + O2(g) = SO2(g) △H2 =-Q2
【课堂练习】
B
普通化学方程式 热化学方程式
化学计量数
聚集状态
ΔH
表达式
意义
整数,既表示微粒个数
又表示物质的量
整数或分数,只表示物质的量
不要求注明
必须注明
无
必须注明
化学计量数唯一
化学计量数不唯一
表明了物质变化
不仅表明了物质变化,也表明了能量变化
第一章 化学反应的热效应
第一节 反应热
第2课时 热化学方程式
两个方程式有什么不同?所表达的意义是怎样的?
2H2 +Cl2 2HCl
2H2(g) +Cl2(g) 2HCl (g) ΔH= - 184.6kJ/mol
101 kPa
25 ℃
一、热化学方程式
1.概念
表示参加反应的物质的量与反应热的关系的化学方程式
2.意义
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
物质变化
能量变化
表示1mol气态H2与1mol气态Cl2完全反应,生成2mol气态HCl时,放出 184.6kJ的热量。
H2(g) +Cl2(g) 2HCl (g) ΔH= - 184.6kJ/mol
2H2(g) +O2(g) 2H2O (g) ΔH= - 483.6kJ/mol
101 kPa
25 ℃
H2(g) + O2(g) H2O (g) ΔH= - 241.8kJ/mol
101 kPa
25 ℃
×2
×2
×2
×2
计量数不同,反应热不同
2H2(g) +O2(g) 2H2O (g) ΔH= - 483.6 kJ/mol
101 kPa
25 ℃
2H2(g) +O2(g) 2H2O (l) ΔH= - 571.6 kJ/mol
101 kPa
25 ℃
物质状态不同,反应热不同
N2 + 3H2 2NH3
ΔH= -92.2kJ/mol
ΔH= +92.2kJ/mol
正向和逆向的△H 大小相等,符号相反
3.书写热化学方程式的注意事项 教材P9
(1)需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa
(2)各物质需标聚集状态(s、l、g、aq)反应条件如:高温、加热、催化剂及“↑和↓”不用注明
(3)化学方程式的右边必须写上△H,并用“空格”隔开, △H吸热用“+”,放热用“-”,单位是kJ/mol
(4)热化学方程式中各物质化学计量数表示各物质的物质的量,可以为整数、分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。
(5)对可逆反应,正向和逆向的△H 大小相等,符号相反
(6)可逆反应中的△H 是指正反应完全进行时的反应热
反应X aA + bB === cC + dD
mol-1 ( aA + bB === cC + dD )
二、热化学方程式的书写 系统集成P8
【课堂练习】
1.写出下列反应的热化学方程式:(1)1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8 kJ热量。
(2)1mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量。
(3)3mol NO2(g)与1 mol H2O(l)反应生成HNO3(aq)和NO(g),放出138 kJ热量。
C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) ΔH=-1366.8 kJ·mol-1
C(石墨,s)+H2O(g) = CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
3NO2(g)+H2O(l) = 2HNO3(aq)+NO(g) ΔH=-138 kJ·mol-1
2.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )A.碳和水反应吸收131.3 kJ的热量B.1mol碳和1mol水反应生成1mol一氧化碳和1mol氢气,并吸收131.3kJ热量C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收131.3 kJ的热量D.1个固态碳原子和1分子水蒸气反应吸收131.3 kJ的热量
C
方法指导
三、热化学方程式正误判断的方法
1.判断下列热化学方程式书写是否正确,正确的画“√”,错误的画“×”
(注:焓变数据均正确)。 (1)CaCO3(s) = CaO(s)+CO2(g) ΔH=+177.7 kJ ( ) (2)C(s)+H2O(s) = CO(g)+H2(g) ΔH=-131.3 kJ·mol-1 ( ) (3)C(s)+1/2O2(g) = CO(g) ΔH=-110.5 kJ·mol-1 ( )
(4)CO(g)+1/2O2(g) = CO2(g) ΔH=-283 kJ·mol-1 ( )
(5)2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1 ( )
【课堂练习】
×
×
√
√
√
2.(双选)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.4 kJ的热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(g) ΔH=-48.4 kJ·mol-1
B.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(l) ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(l) ΔH=+5 517.6 kJ·mol-1
D.2C8H18(l)+25O2(g) = 16CO2(g)+18H2O(l) ΔH=-11035.2 kJ·mol-1
【课堂练习】
BD
2H2(g)+O2(g) = 2H2O(g) △H1= -Q1kJ/mol
2H2(g)+O2(g) = 2H2O(l) △H2= -Q2kJ/mol
请比较Q1和 Q2, △H1和△H2的大小。
注意:热量Q比较比数值,
△H 的比较要带符号
在同温同压下,下列各组热化学方程式中Q2 > Q1的是 ( ) A. H2(g) + Cl2(g) = 2HCl(g) △H1 =-Q1 1/2H2(g) + 1/2 Cl2(g) = HCl(g) △H2 =-Q2 B. C(s) + 1/2O2(g) = CO(g) △H1 =-Q1 C(s) + O2 (g) = CO2(g) △H2 =-Q2 C. 2H2(g) + O2 (g) = 2H2O(l) △H1 =-Q1 2H2(g) + O2 (g) = 2H2O(g) △H2 =-Q2 D. S(g) + O2(g) = SO2(g) △H1 =-Q1 S(s) + O2(g) = SO2(g) △H2 =-Q2
【课堂练习】
B
普通化学方程式 热化学方程式
化学计量数
聚集状态
ΔH
表达式
意义
整数,既表示微粒个数
又表示物质的量
整数或分数,只表示物质的量
不要求注明
必须注明
无
必须注明
化学计量数唯一
化学计量数不唯一
表明了物质变化
不仅表明了物质变化,也表明了能量变化
