3.4.2简单配合物的形成与超分子 课件(共27张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.4.2简单配合物的形成与超分子 课件(共27张ppt)化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 36.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-11 07:04:09 | ||
图片预览







文档简介
(共27张PPT)
3.4配合物与超分子
第2课时
简单配合物的形成和超分子
硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇
【实验仪器】
试管、胶头滴管
【实验药品】
一、简单配合物的形成
【实验原理】
配合物:由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。
中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
配合物
【实验3-3】
实验步骤 实验现象 解释
向盛有4mL 0.1mol/L CuSO4溶液的试管中滴加几滴1mol/L氨水
继续添加氨水,并振荡试管
再向试管中加入6mL 95%乙醇,并用玻璃棒摩擦试管壁
蓝色沉淀
深蓝色溶液
深蓝色晶体
生成Cu(OH)2
生成[Cu(NH3)4]2+
生成[Cu(NH3)4]SO4·H2O
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
一、简单配合物的形成
在试管内壁产生微小的玻璃微晶充当晶核,加速结晶。
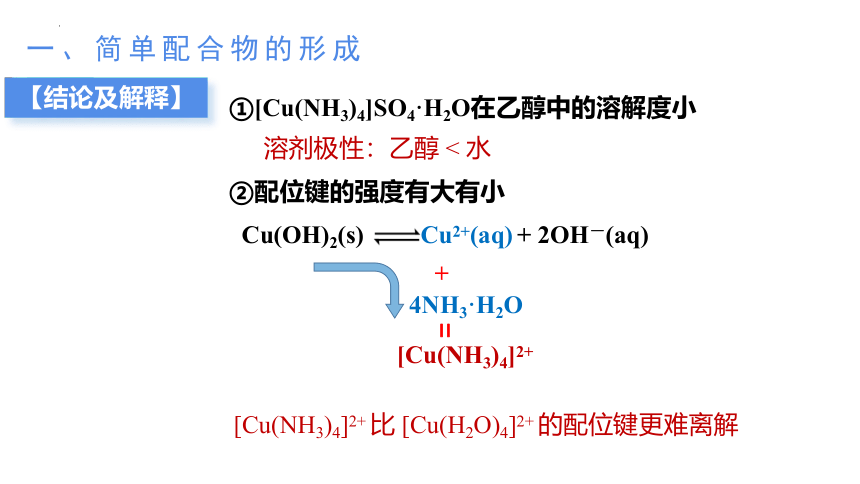
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3·H2O
[Cu(NH3)4]2+
=
一、简单配合物的形成
②配位键的强度有大有小
[Cu(NH3)4]2+ 比 [Cu(H2O)4]2+ 的配位键更难离解
①[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
溶剂极性:乙醇 < 水
【结论及解释】
实验步骤 实验现象 解释
向盛有少量0.1mol/L NaCl溶液的试管中滴加几滴0.1mol/L AgNO3溶液
再滴入1 mol/L氨水,振荡
【实验3-5】
白色沉淀
沉淀消失,澄清
Ag+ + Cl- = AgCl↓
AgCl + 2NH3 =
[Ag(NH3)2]+ + Cl-
一、简单配合物的形成
【实验解释】
一、简单配合物的形成
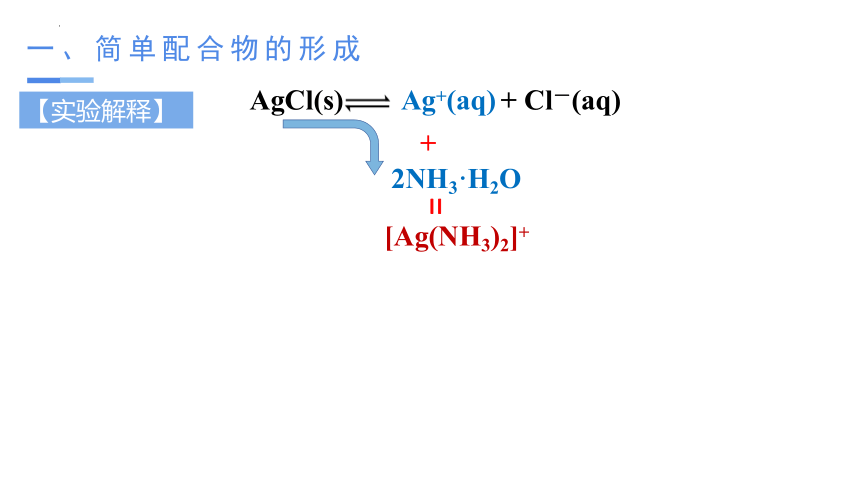
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3·H2O
[Ag(NH3)2]+
=
二、简单离子与配离子的区别
实验步骤 实验现象 解释
(1)向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液
(2)向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液
溶液呈红色
FeCl3
KSCN
溶液
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
无明显变化
CN-的配位能力强于SCN-,[Fe(CN)6]3-很稳定,转化为硫氰化铁的平衡正向移动的趋势很小
【实验3-4】
电影特技和魔术表演
【问题和讨论】
K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?
中心离子:Fe3+,
配体:CN-,
配位数:6。
[Fe(CN)6]3-和Fe3+的性质不一样。
①对溶解性的影响:一些难溶于水的金属氢氧化物、卤化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O
CuCl难溶于水,可溶于浓盐酸和氨水
三、配合物的形成对性质的影响
②颜色改变:某些简单离子形成配离子时,颜色会发生变化,据此可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
③稳定性增强:
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心原子(离子)相同时,配合物的稳定性与配体的性质有关。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
三、配合物的形成对性质的影响
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
1. 概 念
由两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
超分子
3.结构特点:
4.范围:
超分子是组成复杂的,有组织的分子聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,杯吡咯,杯咔唑,瓜环胡葫芦脲,柱芳烃等。
超分子
5. 大小
有的是有限的 有的是无限伸展的
超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
超分子
认识“杯酚”
超分子
重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
超分子
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
b. 冠醚识别碱金属离子
重要特征及其应用——分子识别:
超分子
碱金属离子或大或小,猜想冠醚是如何识别它们的?
冠醚环的大小与金属离子匹配,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
思考: K+ 直径为276 pm,应该选择哪种冠醚呢?
【思考与讨论】
冠醚环的大小与金属离子匹配,才能识别
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) KMnO4水溶液对烯烃氧化效果差,在烯烃中加入冠醚时,
冠醚通过与K+结合而将高锰酸根也带入烯烃中;而冠醚不与
高锰酸根结合,使游离的高锰酸根反应活性很高,从而快速
发生反应。
实例分析:高锰酸钾氧化烯烃
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子方面的诺贝尔奖
重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
超分子
细胞和细胞器的双分子膜
细胞膜两侧为水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。头基为亲水基团,头部会朝向水溶液一侧,从而实现自组装。
配合物
和 超分子
应 用
生产生活
生命体
可促进某些沉淀的溶解
概 念
作用力
特征
医药
离子检验
[Cu(NH3)4]2+制备
Fe(SCN)3制备
[Ag(NH3)2]+制备
分子
识别
自组装
冠醚识别碱
金属离子
“杯酚”分离
C60 和 C70
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(3)超分子内部分子可以通过非共价键结合 ( )
√
(1)超分子的性质与组成超分子的单个分子的性质相同。 ( )
×
(2)超分子是相对分子质量很大的有机化合物。( )
×
课堂练习
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加入氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加入氨水至沉淀消失
A
课堂练习
3.某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A.该物质分子中不存在σ键
B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质是一种配合物,其中Ni为中心原子
D.该物质的分子中C、N、O均存在孤电子对
D
课堂练习
4.下列关于超分子的说法不正确的是( )
A.超分子是两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装性质
B
课堂练习
3.4配合物与超分子
第2课时
简单配合物的形成和超分子
硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇
【实验仪器】
试管、胶头滴管
【实验药品】
一、简单配合物的形成
【实验原理】
配合物:由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。
中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
配合物
【实验3-3】
实验步骤 实验现象 解释
向盛有4mL 0.1mol/L CuSO4溶液的试管中滴加几滴1mol/L氨水
继续添加氨水,并振荡试管
再向试管中加入6mL 95%乙醇,并用玻璃棒摩擦试管壁
蓝色沉淀
深蓝色溶液
深蓝色晶体
生成Cu(OH)2
生成[Cu(NH3)4]2+
生成[Cu(NH3)4]SO4·H2O
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
一、简单配合物的形成
在试管内壁产生微小的玻璃微晶充当晶核,加速结晶。
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3·H2O
[Cu(NH3)4]2+
=
一、简单配合物的形成
②配位键的强度有大有小
[Cu(NH3)4]2+ 比 [Cu(H2O)4]2+ 的配位键更难离解
①[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小
溶剂极性:乙醇 < 水
【结论及解释】
实验步骤 实验现象 解释
向盛有少量0.1mol/L NaCl溶液的试管中滴加几滴0.1mol/L AgNO3溶液
再滴入1 mol/L氨水,振荡
【实验3-5】
白色沉淀
沉淀消失,澄清
Ag+ + Cl- = AgCl↓
AgCl + 2NH3 =
[Ag(NH3)2]+ + Cl-
一、简单配合物的形成
【实验解释】
一、简单配合物的形成
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3·H2O
[Ag(NH3)2]+
=
二、简单离子与配离子的区别
实验步骤 实验现象 解释
(1)向盛有0.1mol/L FeCl3溶液的试管中滴加2滴硫氰化钾溶液
(2)向盛有0.1mol/L K3[Fe(CN)6]溶液的试管中滴加2滴硫氰化钾溶液
溶液呈红色
FeCl3
KSCN
溶液
Fe3+ + n SCN- [Fe(SCN)n]3-n
(n=1~6,随 c(SCN-) 大小而异)
无明显变化
CN-的配位能力强于SCN-,[Fe(CN)6]3-很稳定,转化为硫氰化铁的平衡正向移动的趋势很小
【实验3-4】
电影特技和魔术表演
【问题和讨论】
K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么?配位数是多少?[Fe(CN)6]3-和Fe3+的性质一样吗?
中心离子:Fe3+,
配体:CN-,
配位数:6。
[Fe(CN)6]3-和Fe3+的性质不一样。
①对溶解性的影响:一些难溶于水的金属氢氧化物、卤化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O
CuCl难溶于水,可溶于浓盐酸和氨水
三、配合物的形成对性质的影响
②颜色改变:某些简单离子形成配离子时,颜色会发生变化,据此可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
③稳定性增强:
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心原子(离子)相同时,配合物的稳定性与配体的性质有关。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
三、配合物的形成对性质的影响
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
1. 概 念
由两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
2. 微粒间作用力—非共价键
主要是静电作用、范德华力和氢键等
超分子
3.结构特点:
4.范围:
超分子是组成复杂的,有组织的分子聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。
已报道的超分子大环主体有:DNA,冠醚,环糊精,杯芳烃,杯吡咯,杯咔唑,瓜环胡葫芦脲,柱芳烃等。
超分子
5. 大小
有的是有限的 有的是无限伸展的
超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
超分子
认识“杯酚”
超分子
重要特征及其应用——分子识别:
a. 分离 C60 和 C70
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
超分子
15-冠-5 12-冠-4
C 原子:2×5 = 10 O 原子:5
10 + 5 = 15
b. 冠醚识别碱金属离子
重要特征及其应用——分子识别:
超分子
碱金属离子或大或小,猜想冠醚是如何识别它们的?
冠醚环的大小与金属离子匹配,将阳离子以及对应的阴离子都带入有机溶剂,因而成为有机反应中很好的催化剂。
思考: K+ 直径为276 pm,应该选择哪种冠醚呢?
【思考与讨论】
冠醚环的大小与金属离子匹配,才能识别
冠醚 冠醚空腔直径/pm 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 120~150 170~220 260~320 340~430 Li+(152) Na+(204) K+(276) Rb+(304) Cs+(334) KMnO4水溶液对烯烃氧化效果差,在烯烃中加入冠醚时,
冠醚通过与K+结合而将高锰酸根也带入烯烃中;而冠醚不与
高锰酸根结合,使游离的高锰酸根反应活性很高,从而快速
发生反应。
实例分析:高锰酸钾氧化烯烃
“杯酚”与冠醚形成的超分子,虽然识别的分子、离子不同,但环状结构异曲同工,且尺寸可控。1987 年,诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作,这是人类在操控分子方面迈出的重要一步。
超分子方面的诺贝尔奖
重要特征及其应用——超分子组装:
自组装
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
超分子
细胞和细胞器的双分子膜
细胞膜两侧为水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。头基为亲水基团,头部会朝向水溶液一侧,从而实现自组装。
配合物
和 超分子
应 用
生产生活
生命体
可促进某些沉淀的溶解
概 念
作用力
特征
医药
离子检验
[Cu(NH3)4]2+制备
Fe(SCN)3制备
[Ag(NH3)2]+制备
分子
识别
自组装
冠醚识别碱
金属离子
“杯酚”分离
C60 和 C70
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(3)超分子内部分子可以通过非共价键结合 ( )
√
(1)超分子的性质与组成超分子的单个分子的性质相同。 ( )
×
(2)超分子是相对分子质量很大的有机化合物。( )
×
课堂练习
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加入氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加入氨水至沉淀消失
A
课堂练习
3.某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A.该物质分子中不存在σ键
B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质是一种配合物,其中Ni为中心原子
D.该物质的分子中C、N、O均存在孤电子对
D
课堂练习
4.下列关于超分子的说法不正确的是( )
A.超分子是两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.超分子都是无限伸展的
C.冠醚是一种超分子,可以识别碱金属离子
D.细胞和细胞器的双分子膜具有自组装性质
B
课堂练习
