北京市2023-2024学年北京牛栏山一中高一(下)期末化学试卷(PDF版,无答案)
文档属性
| 名称 | 北京市2023-2024学年北京牛栏山一中高一(下)期末化学试卷(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 586.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-11 08:26:27 | ||
图片预览

文档简介
2024北京牛栏山一中高一(下)期末
化 学
2024.7
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分。
所有答案必须填涂或作答在答题卡上,否则不得分。
可能用到的相对原子质量: H:1 C:12 O:16 N:14 Cl:35.5
第 Ⅰ 卷(选择题共 42 分)
(共 21 小题,每小题 2 分。在每小题列出的四个选项中,选出符合题目答案的一项)
1. 神舟十八号载人飞船成功发射,展现了中国航天事业的强大实力和技术水平。下列叙述不.正.确.的是
( )
A. 飞船使用的 Si3N4隔热层属于新型无机非金属材料
B. 为空间站提供能量的砷化镓太阳能电池材料也可用 SiO2代替
C. 电解熔融状态的氧化铝制得单质铝时,可加入些冰晶石来缩短加热时间
D. 火箭壳体采用的碳纤维缠绕复合材料强度高、密度小,可提高火箭的射程及运载能力
2.下列金属中,通常用热还原法冶炼的是( )
A.钠 B.铁 C.铂 D.汞
3.下列对有机物说法正确的是( )
A.乙醇的分子式为 C2H5OH B.一氯甲烷的电子式:
C. 与 互为同分异构体 D.C2H6和 C8H18一定为同系物
4. 下列说法正确的是( )
A.聚氯乙烯是合成高分子,可用作食品包装
B.多糖、油脂和蛋白质均属于天然高分子
C.蜜蜂蜇人将蚁酸(甲酸)注入人体可涂抹肥皂缓解
D.人造纤维、合成纤维和光导纤维都是合成高分子
5. 下列说法正确的是( )
A.鸡蛋清溶液中滴入浓硝酸微热后生成黄色沉淀
B.油脂的水解反应称为皂化反应,可利用该反应制备肥皂
C.葡萄糖通过水解反应产生乙醇,利用该反应可进行酿酒
D.蛋白质遇饱和硫酸钠溶液变性
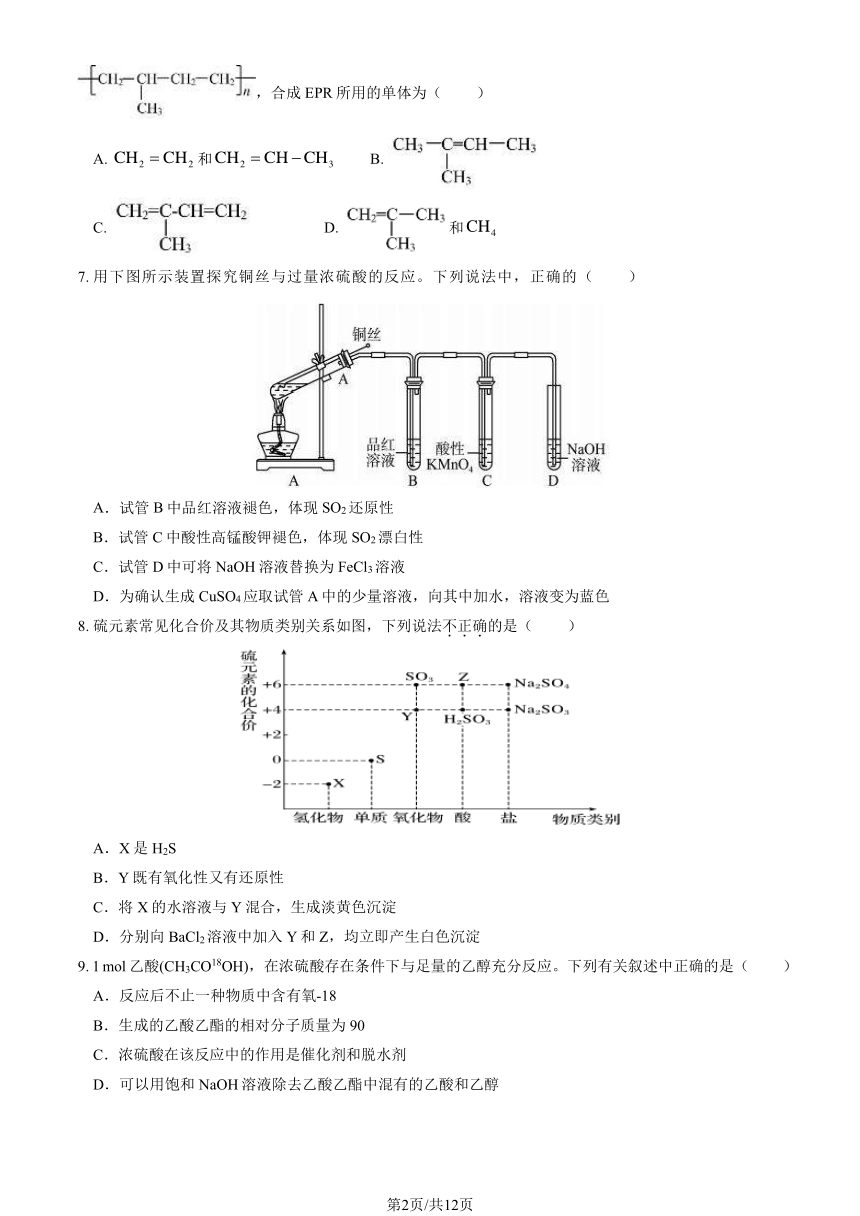
6. EPR 是一种对氧化剂具有较好抗耐性的合成材料,应用极为广泛,其结构简式可以表示
第1页/共12页
,合成 EPR 所用的单体为( )
A. CH2 = CH2 和CH2 = CH CH3 B.
C. D. 和CH4
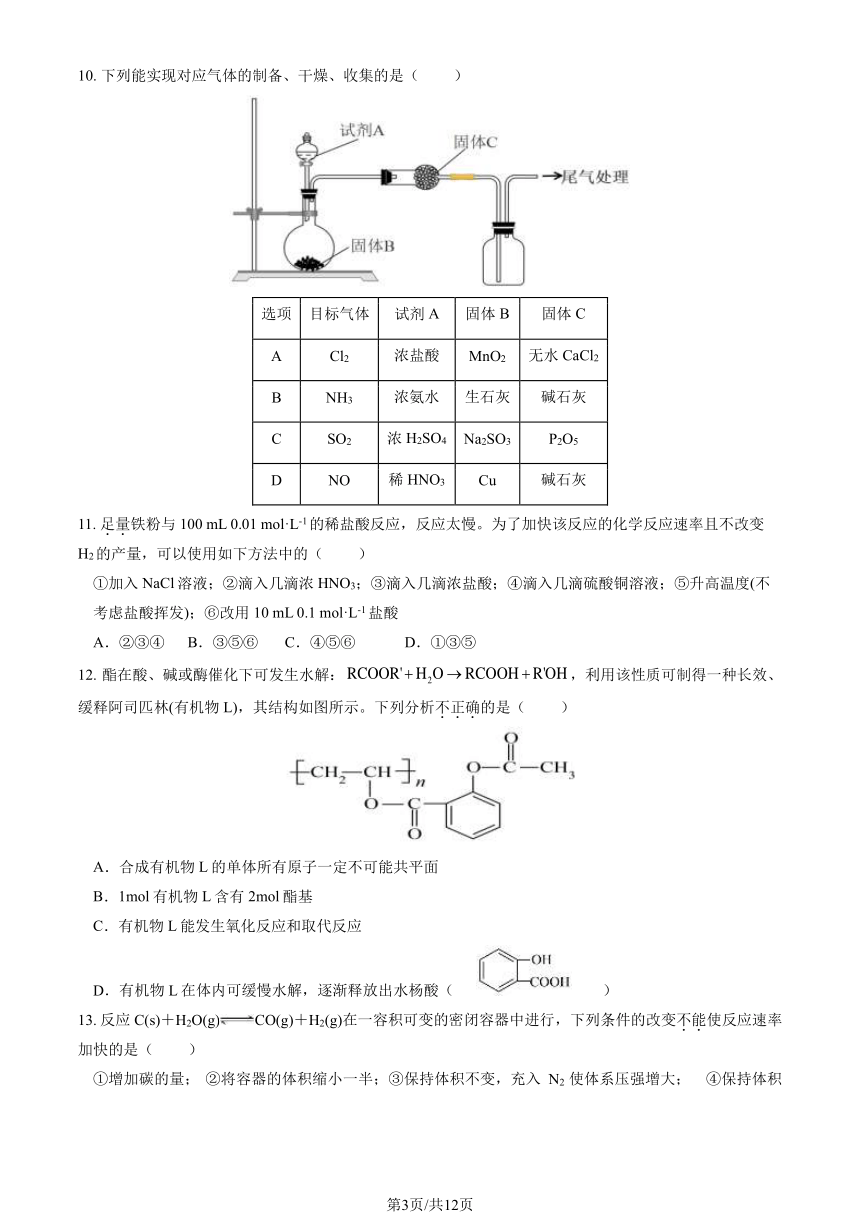
7. 用下图所示装置探究铜丝与过量浓硫酸的反应。下列说法中,正确的( )
A.试管 B 中品红溶液褪色,体现 SO2还原性
B.试管 C 中酸性高锰酸钾褪色,体现 SO2漂白性
C.试管 D 中可将 NaOH 溶液替换为 FeCl3溶液
D.为确认生成 CuSO4应取试管 A 中的少量溶液,向其中加水,溶液变为蓝色
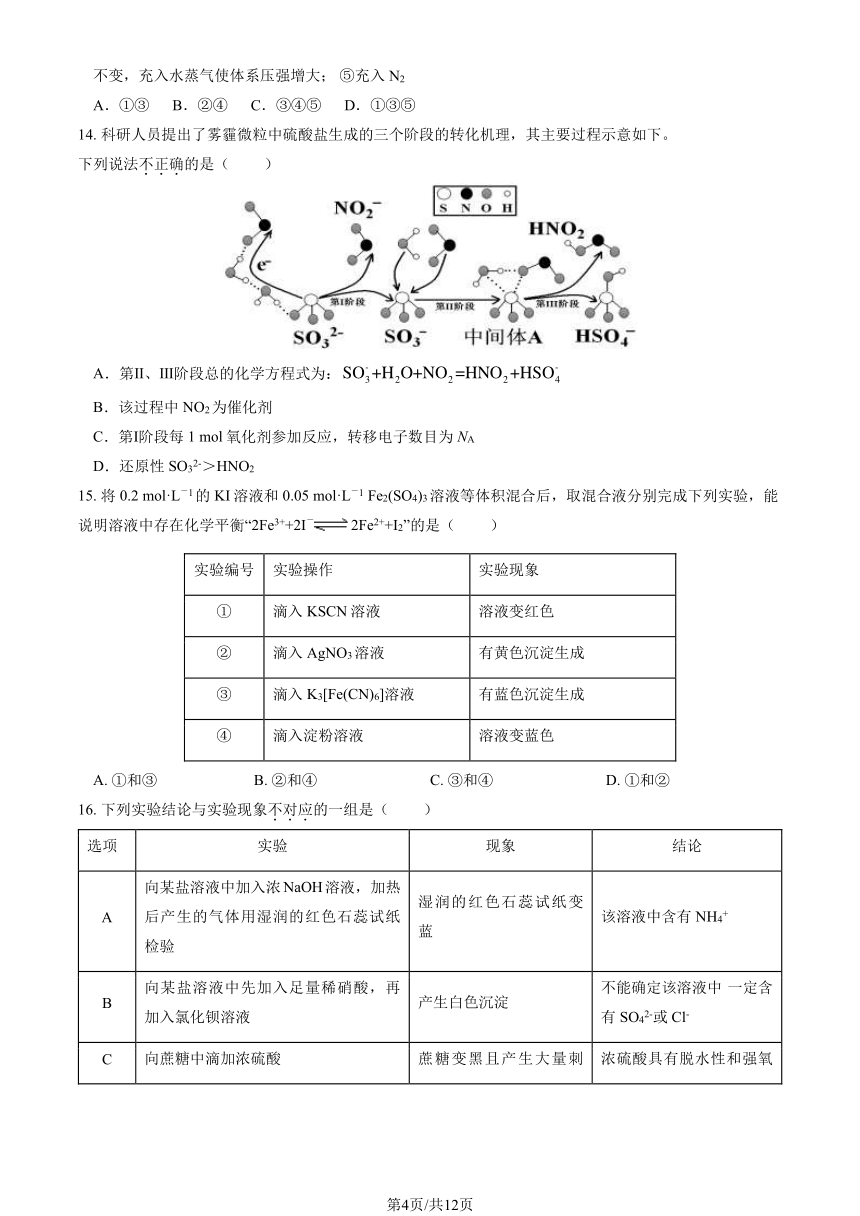
8. 硫元素常见化合价及其物质类别关系如图,下列说法不.正.确.的是( )
A.X 是 H2S
B.Y 既有氧化性又有还原性
C.将 X 的水溶液与 Y 混合,生成淡黄色沉淀
D.分别向 BaCl2溶液中加入 Y 和 Z,均立即产生白色沉淀
9. 1 mol乙酸(CH 183CO OH),在浓硫酸存在条件下与足量的乙醇充分反应。下列有关叙述中正确的是( )
A.反应后不止一种物质中含有氧-18
B.生成的乙酸乙酯的相对分子质量为 90
C.浓硫酸在该反应中的作用是催化剂和脱水剂
D.可以用饱和 NaOH 溶液除去乙酸乙酯中混有的乙酸和乙醇
第2页/共12页
10. 下列能实现对应气体的制备、干燥、收集的是( )
选项 目标气体 试剂 A 固体 B 固体 C
A Cl2 浓盐酸 MnO2 无水 CaCl2
B NH3 浓氨水 生石灰 碱石灰
C SO2 浓 H2SO4 Na2SO3 P2O5
D NO 稀 HNO3 Cu 碱石灰
11. 足.量.铁粉与 100 mL 0.01 mol·L
-1的稀盐酸反应,反应太慢。为了加快该反应的化学反应速率且不改变
H2的产量,可以使用如下方法中的( )
①加入 NaCl 溶液;②滴入几滴浓 HNO3;③滴入几滴浓盐酸;④滴入几滴硫酸铜溶液;⑤升高温度(不
考虑盐酸挥发);⑥改用 10 mL 0.1 mol·L-1盐酸
A.②③④ B.③⑤⑥ C.④⑤⑥ D.①③⑤
12. 酯在酸、碱或酶催化下可发生水解:RCOOR'+H2O → RCOOH +R'OH,利用该性质可制得一种长效、
缓释阿司匹林(有机物 L),其结构如图所示。下列分析不.正.确.的是( )
A.合成有机物 L 的单体所有原子一定不可能共平面
B.1mol 有机物 L 含有 2mol 酯基
C.有机物 L 能发生氧化反应和取代反应
D.有机物 L 在体内可缓慢水解,逐渐释放出水杨酸( )
13. 反应 C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变不.能.使反应速率
加快的是( )
①增加碳的量; ②将容器的体积缩小一半;③保持体积不变,充入 N2 使体系压强增大; ④保持体积
第3页/共12页
不变,充入水蒸气使体系压强增大; ⑤充入 N2
A.①③ B.②④ C.③④⑤ D.①③⑤
14. 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意如下。
下列说法不.正.确.的是( )
A.第Ⅱ、Ⅲ阶段总的化学方程式为:SO
- -
3 +H2O+NO2 =HNO2 +HSO4
B.该过程中 NO2为催化剂
C.第Ⅰ阶段每 1 mol 氧化剂参加反应,转移电子数目为 NA
D.还原性 SO 2-3 >HNO2
- -
15. 将 0.2 mol·L 1的 KI 溶液和 0.05 mol·L 1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能
-
说明溶液中存在化学平衡“2Fe3++2I 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入 KSCN 溶液 溶液变红色
② 滴入 AgNO3溶液 有黄色沉淀生成
③ 滴入 K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
A. ①和③ B. ②和④ C. ③和④ D. ①和②
16. 下列实验结论与实验现象不.对.应.的一组是( )
选项 实验 现象 结论
向某盐溶液中加入浓NaOH溶液,加热
湿润的红色石蕊试纸变
A 后产生的气体用湿润的红色石蕊试纸 该溶液中含有 NH +4
蓝
检验
向某盐溶液中先加入足量稀硝酸,再 不能确定该溶液中 一定含
B 产生白色沉淀
加入氯化钡溶液 有 SO 2-或 Cl-4
C 向蔗糖中滴加浓硫酸 蔗糖变黑且产生大量刺 浓硫酸具有脱水性和强氧
第4页/共12页
激性味气体 化性
向淀粉溶液中加入少量 稀 H2SO4,
D 加热一段时间,冷却后再加少量银氨 未产生银镜 淀粉没有发生水解
溶液,水浴加热
17. 某温度下,向 10mL 0.40mol L-1H2O2溶液中加入适量 FeCl3溶液,不同时刻测得生成 O2的体积(已折算
标况)如表所示。
t/min 0 2 4 6
V(O2)/mL 0 9.9 17.2 22.4
资料显示,反应分两步进行:
①2Fe3++H2O2=2Fe2++O2↑+2H+
②H O +2Fe2+2 2 +2H+=2H O+2Fe3+2
反应过程中能量变化如图所示:
下列说法不.正.确.的是( )
A. Fe3+的作用是增大过氧化氢的分解速率
B. 0~6min 的平均反应速率;v(H2O2)=3.33×10-2mol L-1 min-1
C. 反应 2H2O2(aq) = 2H2O(l) + O2(g)的△H = E1-E2<0
D. 反应①是吸热反应、反应②是放热反应
18. 某温度下 N2O5 按下式分解:2N2O5(g) 4NO2(g)+O2(g)。测得 2L 恒容密闭容器内,N2O5 的浓度随时
间的变化如下表:
t/min 0 1 2 3 4 5 6 7 ……
c(N2O5)/(mol/L) 1.00 0.71 0.50 0.35 0.25 0.17 0.10 0.10 ……
下列说法正确的是( )
A.4min 时,c(NO2)=0.75mol/L
B.5min 时,N2O5的转化率为 17%
C.6min 时反应已到达化学平衡状态,0-6min 内 v(O2)=0.0375mol/(L min)
第5页/共12页
D.其他条件不变,若起始 c(N2O5)=0.50mol/L,则 2min 时 c(N2O5)>0.25mol/L
19. 由软锰矿(主要成分 MnO2,及少量 CaO、MgO)制备 MnO2的工艺流程如下:
已知:① 常温下 CaF2、MgF2均难溶于水;
② “沉锰”所得 MnCO3在空气中“焙烧”时完全转化为 MnO2、Mn2O3的混合物。
下列说法正确的是( )
A. “浸取”时向软锰矿中先加入足量稀硫酸,再滴加 Na2SO3溶液
+ + +
B. “除杂”后的溶液中主要存在的阳离子有 Na 、H 、Mn2
+
C. “沉锰”时反应的离子方程式为 Mn2 + CO 2- 3 === MnCO3↓
D. “酸浸”时每反应 1 mol Mn2O3转移电子的物质的量为 2 mol
20. 生产钛的方法之一是将金红石(TiO2)转化为 TiCl4,再进一步还原得到钛。TiO2 转化为 TiCl4 有直接氯化
法和碳氯化法,相关能量示意图如下所示。下列说法不.正.确.的是( )
A.将反应物固体粉碎可以加快直接氯化、碳氯化的反应速率
B.可推知2C(s) +O2 (g)=2CO(g) H= +121kJ/mol
C.以上两种方法生产钛,从原子经济性角度看都不是 100%原子利用率
D.以上两种反应中,生成等量 TiCl4电子转移数相等
21. 某同学进行如下兴趣实验:
IO +3HSO = I +3SO2 +3H+反应原理:① 3 3 4
② IO
+
3 + 5I + 6H = 3I2 + 3H2O
2+③Hg + 2I
= HgI2 (橙红)
现象:立即产生橙红色沉淀,几秒钟后溶液颜色变为蓝色
下列说法不.正.确.的是( )
第6页/共12页
A.反应①中 IO -3 表现氧化性
B.反应后混合液的 pH 减小
C.该实验条件下,反应速率:③>②
D.若用 Na2SO3溶液代替 NaHSO3溶液进行上述实验,现象相同
第 Ⅱ 卷(非选择题共 58 分)
22.(12 分)
Ⅰ. 某研究小组欲制备少量纯净氨气并探究氨气的性质,进行了如下实验:
(1) 图 1 所示装置中,可做氨气制备装置的是 (填序号)。反应的化学方程式是 。
(2)图 2 中方框内为气体收集装置,请将方框内装置补充完整。
(3)小陈同学设计了如图 3 所示装置进行尾气处理,小申同学认为该装置设计不合理,理由是 。
(4)相同条件下,相对分子质量小的气体,运动速率较快。图 4 中,玻璃管内可观察到的现象是 。
II. 氮的循环和转化对生产、生活有重要的价值。该研究小组查阅相关资料,了解到某工厂制硝酸的流
程如下图所示:
(5)上述转化中,属于氮的固定的是 (填“i”、“ii”或“iii”)。
(6)“氧化炉”中发生反应的化学方程式为 。
(7)吸收塔中,发生的反应为 4NO + 3O2 +2H2O ==== 4HNO3,若用 Va mL x mol·L-1的稀硝酸作为吸收液,
反应后得到 Vb mL y mol·L-1的浓硝酸,则理论上吸收装置中需消耗的 O2的物质的量为 mol(写出计算
式)。
(8)“吸收塔”排出的尾气中仍会含有少量的 NO、NO2 等氮氧化物,为消除它们对环境的影响,通常用纯
碱(Na2CO3)溶液吸收 NO2 气体,亚硝酸钠(NaNO2)为产物之一,反应无 O2 生成,其相应的离子方程式
第7页/共12页
为 。
23.(10 分)
A~I 是常见有机物,它们之间的转化关系如图所示。A 是一种烃,其产量通常可衡量一个国家的石油
化工水平;E 和 H 为有香味的油状物质。
已知:CH3CH2Br N aOH溶 液 → CH3CH2OH
(1) ①的反应类型为 ,B 中含有官能团的名称是 。
(2) ②和④的化学方程式分别为 、 。
(3) G 可能具有的性质为 (填字母序号)。
a. 与金属钠反应 b. 与 NaOH 溶液反应 c. 使高锰酸钾溶液褪色
(4) M 为 I 的同系物,分子中有 5 个碳原子,写出有 3 个-CH3的异构体的结构简式 。
(5) H 的结构简式为 。
24.(10 分)
碳中和作为一种新型环保形式可推动全社会绿色发展。下图为科学家正在研究建立的一种二氧化碳新
循环体系。
TiO2
(1)过程 Ⅰ 的原理: 2H2O 2H2 +O2 ,根据下表数据回答:
太阳能
化学键 H-H O=O H-O
键能 / (kJ mol 1 ) 436 496 463
水蒸气分解为氢气和氧气的热化学方程式为 。
(2) 200℃时,在 2L 密闭恒容容器中充入 CO2和 H2发生过程 Ⅱ 中的反应,CH3OH 和 CO2的物质的量随时间
变化如图所示。
第8页/共12页
①反应的化学方程式是 。
②下列能说明该反应一定达到化学平衡状态的是 。
A.混合气体的平均相对分子质量不再改变
B.容器内的压强不再改变
C.四种气体的物质的量浓度相等
D.混合气体的密度不再改变
E. 单位时间内断裂 3mol H-H 键,同时断裂 2mol H-O 键
F. 3v 逆(CH3OH)=v 正(H2)
G. 容器中 n(CH3OH):n(H2O)不再变化
(3)过程 Ⅲ 中,甲醇在空气中完全燃烧,利用产生的热量可进行发电。
Ⅰ. 已知 H2O(g) = H2O(l) H=-44kJ/mol
1
CH3OH(l) + O2(g) = CO2(g) + 2H2(g) H=-154.5kJ/mol
2
则 25℃时甲醇的燃烧热 H= kJ/mol。
Ⅱ. 利用过程 Ⅲ 的反应设计的一种原电池,工作原理如图所示。
① d 是 (填“正”或“负”)极,c 的电极反应式为 。
②若线路中转移 0.5mol 电子,则该电池理论上消耗的 O2在标准状况下的体积 约为 L。
25.(8 分)
溴及其化合物应用广泛,Br2的沸点为 58.8℃,以下两种方法均可从海水中提取溴。
(1)吹出法(主要流程如下):
第9页/共12页
①写出吸收塔中发生反应的化学方程式 。
②吹出塔和吸收塔要达到的目的是 。
③蒸馏塔中控制温度在 59℃左右,原因是 。
④理论上制得 0.25mol Br2,至少需要消耗氯气 g。
⑤经该方法处理后,0.1m3海水最终得到 3.84g Br2,若总提取率为 80%,则原海水中溴的浓度是 mg/L。
(2)聚四氟乙烯气态膜法(基本原理如图所示):
①经处理后的含 Br2海水透过膜孔与 NaOH 吸收液发生反应,离子方程式是 ,得到富集液后再加
酸、蒸馏可得 Br2。
②聚四氟乙烯气态膜法与吹出法相比,除绿色环保外,优点还有 (写出一条)。
26.(9 分)
某钴矿石的主要成分有 CoO、Co2O3、MnO、Fe2O3、MgO 和 SiO2等。由该矿石粉制备 CoC2O4固体的
方法如下(部分催化剂已略)。
已知:金属离子沉淀的 pH:
第10页/共12页
Fe3+ Fe2+ Mg2+ Mn2+ Co2+
开始沉淀时 1.5 6.3 8.9 8.2 7.4
完全沉淀时 2.8 8.3 10.9 10.2 9.4
(1) Co O 溶于浓硫酸,生成 Co2+2 3 和一种气体,该气体是___________(写化学式)。
(2)向溶液 1 中加入 NaOH 溶液,将 Fe3+转化为 Fe(OH)3沉淀,应调节 pH 的范围是_______。
(3)向溶液 2 中加入 NaF 溶液,发生反应的离子方程式为___________。
(4)向溶液 3 中加入氨水和过氧化氢溶液,将 Co2+转化为[Co(NH3) 3+6] 。其离子方程式
为 。
(5)向溶液 3 中加入氨水和过氧化氢溶液后,产生 MnO2的离子方程式为 。
(6)溶液 4 中,若将 1 mol [Co(NH ) ]3+3 6 全部转化为 CoC2O4沉淀,需要消耗(NH4)2C2O4
________g。[(NH4)2C2O4 的相对分子质量为 124]
(7)关于上述流程,下列说法不.正.确.的是___________(填序号)。
a. 若矿石粉中存在少量 FeO,经上述流程也可制得纯度相同的 CoC2O4
b. 向溶液 3 中加入氨水,作用仅是调节溶液的 pH
c. 流程中,仅通过调节溶液的 pH 无法将金属元素完全分离
27.(9 分)
某小组欲探究反应 2Fe2+ + I 2Fe3+ 2 + 2I ,完成如下实验:
资料:AgI 是黄色固体,难溶于稀硝酸。新制的 AgI 见光会少量分解。
(1) 检验 Ⅰ 或 Ⅱ 中有无 Fe3+的实验操作及现象是:取少量 Ⅰ 或 Ⅱ中溶液, 。经检验,Ⅰ、Ⅱ中均未检验出
Fe3+。
(2) Ⅲ中的黄色浑浊是 (写化学式)。
(3) 经检验,Ⅱ→Ⅲ的过程中产生了 Fe3+。
① 对 Fe3+产生的原因做出如下假设:
假设 a:空气中存在 O2,由于 (用离子方程式表示),可产生 Fe3+;
假设 b:溶液中 Ag+具有氧化性,可产生 Fe3+;
假设 c: ;
假设 d:该条件下,I2溶液可将 Fe2+氧化为 Fe3+。
② 通过实验进一步证实 a、b、c 不是产生 Fe3+的主要原因,假设 d 成立。
(4)经检验,Ⅳ中灰黑色浑浊中含有 AgI 和 Ag。
第11页/共12页
① 验证灰黑色浑浊含有 Ag 的实验操作及现象是:取洗净后的灰黑色固体, 。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验 1 和实验 2。
实验 1:向 1 mL 0.1 mol·L 1 FeSO4溶液中加入 1 mL0.1 mol·L 1 AgNO3溶液,开始时,溶液无明显变化。
几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中 Ag+浓度随反应时间的变化如
下图。
实验 2:实验开始时,先向试管中加入几滴 Fe2(SO4)3溶液,重复实验 1,实验结果与实验 1 相同。
ⅰ.实验 1 中发生反应的离子方程式是 。
ⅱ.Ⅳ中迅.速.出现灰黑色浑浊的可能的原因是 。
第12页/共12页
化 学
2024.7
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分。
所有答案必须填涂或作答在答题卡上,否则不得分。
可能用到的相对原子质量: H:1 C:12 O:16 N:14 Cl:35.5
第 Ⅰ 卷(选择题共 42 分)
(共 21 小题,每小题 2 分。在每小题列出的四个选项中,选出符合题目答案的一项)
1. 神舟十八号载人飞船成功发射,展现了中国航天事业的强大实力和技术水平。下列叙述不.正.确.的是
( )
A. 飞船使用的 Si3N4隔热层属于新型无机非金属材料
B. 为空间站提供能量的砷化镓太阳能电池材料也可用 SiO2代替
C. 电解熔融状态的氧化铝制得单质铝时,可加入些冰晶石来缩短加热时间
D. 火箭壳体采用的碳纤维缠绕复合材料强度高、密度小,可提高火箭的射程及运载能力
2.下列金属中,通常用热还原法冶炼的是( )
A.钠 B.铁 C.铂 D.汞
3.下列对有机物说法正确的是( )
A.乙醇的分子式为 C2H5OH B.一氯甲烷的电子式:
C. 与 互为同分异构体 D.C2H6和 C8H18一定为同系物
4. 下列说法正确的是( )
A.聚氯乙烯是合成高分子,可用作食品包装
B.多糖、油脂和蛋白质均属于天然高分子
C.蜜蜂蜇人将蚁酸(甲酸)注入人体可涂抹肥皂缓解
D.人造纤维、合成纤维和光导纤维都是合成高分子
5. 下列说法正确的是( )
A.鸡蛋清溶液中滴入浓硝酸微热后生成黄色沉淀
B.油脂的水解反应称为皂化反应,可利用该反应制备肥皂
C.葡萄糖通过水解反应产生乙醇,利用该反应可进行酿酒
D.蛋白质遇饱和硫酸钠溶液变性
6. EPR 是一种对氧化剂具有较好抗耐性的合成材料,应用极为广泛,其结构简式可以表示
第1页/共12页
,合成 EPR 所用的单体为( )
A. CH2 = CH2 和CH2 = CH CH3 B.
C. D. 和CH4
7. 用下图所示装置探究铜丝与过量浓硫酸的反应。下列说法中,正确的( )
A.试管 B 中品红溶液褪色,体现 SO2还原性
B.试管 C 中酸性高锰酸钾褪色,体现 SO2漂白性
C.试管 D 中可将 NaOH 溶液替换为 FeCl3溶液
D.为确认生成 CuSO4应取试管 A 中的少量溶液,向其中加水,溶液变为蓝色
8. 硫元素常见化合价及其物质类别关系如图,下列说法不.正.确.的是( )
A.X 是 H2S
B.Y 既有氧化性又有还原性
C.将 X 的水溶液与 Y 混合,生成淡黄色沉淀
D.分别向 BaCl2溶液中加入 Y 和 Z,均立即产生白色沉淀
9. 1 mol乙酸(CH 183CO OH),在浓硫酸存在条件下与足量的乙醇充分反应。下列有关叙述中正确的是( )
A.反应后不止一种物质中含有氧-18
B.生成的乙酸乙酯的相对分子质量为 90
C.浓硫酸在该反应中的作用是催化剂和脱水剂
D.可以用饱和 NaOH 溶液除去乙酸乙酯中混有的乙酸和乙醇
第2页/共12页
10. 下列能实现对应气体的制备、干燥、收集的是( )
选项 目标气体 试剂 A 固体 B 固体 C
A Cl2 浓盐酸 MnO2 无水 CaCl2
B NH3 浓氨水 生石灰 碱石灰
C SO2 浓 H2SO4 Na2SO3 P2O5
D NO 稀 HNO3 Cu 碱石灰
11. 足.量.铁粉与 100 mL 0.01 mol·L
-1的稀盐酸反应,反应太慢。为了加快该反应的化学反应速率且不改变
H2的产量,可以使用如下方法中的( )
①加入 NaCl 溶液;②滴入几滴浓 HNO3;③滴入几滴浓盐酸;④滴入几滴硫酸铜溶液;⑤升高温度(不
考虑盐酸挥发);⑥改用 10 mL 0.1 mol·L-1盐酸
A.②③④ B.③⑤⑥ C.④⑤⑥ D.①③⑤
12. 酯在酸、碱或酶催化下可发生水解:RCOOR'+H2O → RCOOH +R'OH,利用该性质可制得一种长效、
缓释阿司匹林(有机物 L),其结构如图所示。下列分析不.正.确.的是( )
A.合成有机物 L 的单体所有原子一定不可能共平面
B.1mol 有机物 L 含有 2mol 酯基
C.有机物 L 能发生氧化反应和取代反应
D.有机物 L 在体内可缓慢水解,逐渐释放出水杨酸( )
13. 反应 C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变不.能.使反应速率
加快的是( )
①增加碳的量; ②将容器的体积缩小一半;③保持体积不变,充入 N2 使体系压强增大; ④保持体积
第3页/共12页
不变,充入水蒸气使体系压强增大; ⑤充入 N2
A.①③ B.②④ C.③④⑤ D.①③⑤
14. 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意如下。
下列说法不.正.确.的是( )
A.第Ⅱ、Ⅲ阶段总的化学方程式为:SO
- -
3 +H2O+NO2 =HNO2 +HSO4
B.该过程中 NO2为催化剂
C.第Ⅰ阶段每 1 mol 氧化剂参加反应,转移电子数目为 NA
D.还原性 SO 2-3 >HNO2
- -
15. 将 0.2 mol·L 1的 KI 溶液和 0.05 mol·L 1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能
-
说明溶液中存在化学平衡“2Fe3++2I 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入 KSCN 溶液 溶液变红色
② 滴入 AgNO3溶液 有黄色沉淀生成
③ 滴入 K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
A. ①和③ B. ②和④ C. ③和④ D. ①和②
16. 下列实验结论与实验现象不.对.应.的一组是( )
选项 实验 现象 结论
向某盐溶液中加入浓NaOH溶液,加热
湿润的红色石蕊试纸变
A 后产生的气体用湿润的红色石蕊试纸 该溶液中含有 NH +4
蓝
检验
向某盐溶液中先加入足量稀硝酸,再 不能确定该溶液中 一定含
B 产生白色沉淀
加入氯化钡溶液 有 SO 2-或 Cl-4
C 向蔗糖中滴加浓硫酸 蔗糖变黑且产生大量刺 浓硫酸具有脱水性和强氧
第4页/共12页
激性味气体 化性
向淀粉溶液中加入少量 稀 H2SO4,
D 加热一段时间,冷却后再加少量银氨 未产生银镜 淀粉没有发生水解
溶液,水浴加热
17. 某温度下,向 10mL 0.40mol L-1H2O2溶液中加入适量 FeCl3溶液,不同时刻测得生成 O2的体积(已折算
标况)如表所示。
t/min 0 2 4 6
V(O2)/mL 0 9.9 17.2 22.4
资料显示,反应分两步进行:
①2Fe3++H2O2=2Fe2++O2↑+2H+
②H O +2Fe2+2 2 +2H+=2H O+2Fe3+2
反应过程中能量变化如图所示:
下列说法不.正.确.的是( )
A. Fe3+的作用是增大过氧化氢的分解速率
B. 0~6min 的平均反应速率;v(H2O2)=3.33×10-2mol L-1 min-1
C. 反应 2H2O2(aq) = 2H2O(l) + O2(g)的△H = E1-E2<0
D. 反应①是吸热反应、反应②是放热反应
18. 某温度下 N2O5 按下式分解:2N2O5(g) 4NO2(g)+O2(g)。测得 2L 恒容密闭容器内,N2O5 的浓度随时
间的变化如下表:
t/min 0 1 2 3 4 5 6 7 ……
c(N2O5)/(mol/L) 1.00 0.71 0.50 0.35 0.25 0.17 0.10 0.10 ……
下列说法正确的是( )
A.4min 时,c(NO2)=0.75mol/L
B.5min 时,N2O5的转化率为 17%
C.6min 时反应已到达化学平衡状态,0-6min 内 v(O2)=0.0375mol/(L min)
第5页/共12页
D.其他条件不变,若起始 c(N2O5)=0.50mol/L,则 2min 时 c(N2O5)>0.25mol/L
19. 由软锰矿(主要成分 MnO2,及少量 CaO、MgO)制备 MnO2的工艺流程如下:
已知:① 常温下 CaF2、MgF2均难溶于水;
② “沉锰”所得 MnCO3在空气中“焙烧”时完全转化为 MnO2、Mn2O3的混合物。
下列说法正确的是( )
A. “浸取”时向软锰矿中先加入足量稀硫酸,再滴加 Na2SO3溶液
+ + +
B. “除杂”后的溶液中主要存在的阳离子有 Na 、H 、Mn2
+
C. “沉锰”时反应的离子方程式为 Mn2 + CO 2- 3 === MnCO3↓
D. “酸浸”时每反应 1 mol Mn2O3转移电子的物质的量为 2 mol
20. 生产钛的方法之一是将金红石(TiO2)转化为 TiCl4,再进一步还原得到钛。TiO2 转化为 TiCl4 有直接氯化
法和碳氯化法,相关能量示意图如下所示。下列说法不.正.确.的是( )
A.将反应物固体粉碎可以加快直接氯化、碳氯化的反应速率
B.可推知2C(s) +O2 (g)=2CO(g) H= +121kJ/mol
C.以上两种方法生产钛,从原子经济性角度看都不是 100%原子利用率
D.以上两种反应中,生成等量 TiCl4电子转移数相等
21. 某同学进行如下兴趣实验:
IO +3HSO = I +3SO2 +3H+反应原理:① 3 3 4
② IO
+
3 + 5I + 6H = 3I2 + 3H2O
2+③Hg + 2I
= HgI2 (橙红)
现象:立即产生橙红色沉淀,几秒钟后溶液颜色变为蓝色
下列说法不.正.确.的是( )
第6页/共12页
A.反应①中 IO -3 表现氧化性
B.反应后混合液的 pH 减小
C.该实验条件下,反应速率:③>②
D.若用 Na2SO3溶液代替 NaHSO3溶液进行上述实验,现象相同
第 Ⅱ 卷(非选择题共 58 分)
22.(12 分)
Ⅰ. 某研究小组欲制备少量纯净氨气并探究氨气的性质,进行了如下实验:
(1) 图 1 所示装置中,可做氨气制备装置的是 (填序号)。反应的化学方程式是 。
(2)图 2 中方框内为气体收集装置,请将方框内装置补充完整。
(3)小陈同学设计了如图 3 所示装置进行尾气处理,小申同学认为该装置设计不合理,理由是 。
(4)相同条件下,相对分子质量小的气体,运动速率较快。图 4 中,玻璃管内可观察到的现象是 。
II. 氮的循环和转化对生产、生活有重要的价值。该研究小组查阅相关资料,了解到某工厂制硝酸的流
程如下图所示:
(5)上述转化中,属于氮的固定的是 (填“i”、“ii”或“iii”)。
(6)“氧化炉”中发生反应的化学方程式为 。
(7)吸收塔中,发生的反应为 4NO + 3O2 +2H2O ==== 4HNO3,若用 Va mL x mol·L-1的稀硝酸作为吸收液,
反应后得到 Vb mL y mol·L-1的浓硝酸,则理论上吸收装置中需消耗的 O2的物质的量为 mol(写出计算
式)。
(8)“吸收塔”排出的尾气中仍会含有少量的 NO、NO2 等氮氧化物,为消除它们对环境的影响,通常用纯
碱(Na2CO3)溶液吸收 NO2 气体,亚硝酸钠(NaNO2)为产物之一,反应无 O2 生成,其相应的离子方程式
第7页/共12页
为 。
23.(10 分)
A~I 是常见有机物,它们之间的转化关系如图所示。A 是一种烃,其产量通常可衡量一个国家的石油
化工水平;E 和 H 为有香味的油状物质。
已知:CH3CH2Br N aOH溶 液 → CH3CH2OH
(1) ①的反应类型为 ,B 中含有官能团的名称是 。
(2) ②和④的化学方程式分别为 、 。
(3) G 可能具有的性质为 (填字母序号)。
a. 与金属钠反应 b. 与 NaOH 溶液反应 c. 使高锰酸钾溶液褪色
(4) M 为 I 的同系物,分子中有 5 个碳原子,写出有 3 个-CH3的异构体的结构简式 。
(5) H 的结构简式为 。
24.(10 分)
碳中和作为一种新型环保形式可推动全社会绿色发展。下图为科学家正在研究建立的一种二氧化碳新
循环体系。
TiO2
(1)过程 Ⅰ 的原理: 2H2O 2H2 +O2 ,根据下表数据回答:
太阳能
化学键 H-H O=O H-O
键能 / (kJ mol 1 ) 436 496 463
水蒸气分解为氢气和氧气的热化学方程式为 。
(2) 200℃时,在 2L 密闭恒容容器中充入 CO2和 H2发生过程 Ⅱ 中的反应,CH3OH 和 CO2的物质的量随时间
变化如图所示。
第8页/共12页
①反应的化学方程式是 。
②下列能说明该反应一定达到化学平衡状态的是 。
A.混合气体的平均相对分子质量不再改变
B.容器内的压强不再改变
C.四种气体的物质的量浓度相等
D.混合气体的密度不再改变
E. 单位时间内断裂 3mol H-H 键,同时断裂 2mol H-O 键
F. 3v 逆(CH3OH)=v 正(H2)
G. 容器中 n(CH3OH):n(H2O)不再变化
(3)过程 Ⅲ 中,甲醇在空气中完全燃烧,利用产生的热量可进行发电。
Ⅰ. 已知 H2O(g) = H2O(l) H=-44kJ/mol
1
CH3OH(l) + O2(g) = CO2(g) + 2H2(g) H=-154.5kJ/mol
2
则 25℃时甲醇的燃烧热 H= kJ/mol。
Ⅱ. 利用过程 Ⅲ 的反应设计的一种原电池,工作原理如图所示。
① d 是 (填“正”或“负”)极,c 的电极反应式为 。
②若线路中转移 0.5mol 电子,则该电池理论上消耗的 O2在标准状况下的体积 约为 L。
25.(8 分)
溴及其化合物应用广泛,Br2的沸点为 58.8℃,以下两种方法均可从海水中提取溴。
(1)吹出法(主要流程如下):
第9页/共12页
①写出吸收塔中发生反应的化学方程式 。
②吹出塔和吸收塔要达到的目的是 。
③蒸馏塔中控制温度在 59℃左右,原因是 。
④理论上制得 0.25mol Br2,至少需要消耗氯气 g。
⑤经该方法处理后,0.1m3海水最终得到 3.84g Br2,若总提取率为 80%,则原海水中溴的浓度是 mg/L。
(2)聚四氟乙烯气态膜法(基本原理如图所示):
①经处理后的含 Br2海水透过膜孔与 NaOH 吸收液发生反应,离子方程式是 ,得到富集液后再加
酸、蒸馏可得 Br2。
②聚四氟乙烯气态膜法与吹出法相比,除绿色环保外,优点还有 (写出一条)。
26.(9 分)
某钴矿石的主要成分有 CoO、Co2O3、MnO、Fe2O3、MgO 和 SiO2等。由该矿石粉制备 CoC2O4固体的
方法如下(部分催化剂已略)。
已知:金属离子沉淀的 pH:
第10页/共12页
Fe3+ Fe2+ Mg2+ Mn2+ Co2+
开始沉淀时 1.5 6.3 8.9 8.2 7.4
完全沉淀时 2.8 8.3 10.9 10.2 9.4
(1) Co O 溶于浓硫酸,生成 Co2+2 3 和一种气体,该气体是___________(写化学式)。
(2)向溶液 1 中加入 NaOH 溶液,将 Fe3+转化为 Fe(OH)3沉淀,应调节 pH 的范围是_______。
(3)向溶液 2 中加入 NaF 溶液,发生反应的离子方程式为___________。
(4)向溶液 3 中加入氨水和过氧化氢溶液,将 Co2+转化为[Co(NH3) 3+6] 。其离子方程式
为 。
(5)向溶液 3 中加入氨水和过氧化氢溶液后,产生 MnO2的离子方程式为 。
(6)溶液 4 中,若将 1 mol [Co(NH ) ]3+3 6 全部转化为 CoC2O4沉淀,需要消耗(NH4)2C2O4
________g。[(NH4)2C2O4 的相对分子质量为 124]
(7)关于上述流程,下列说法不.正.确.的是___________(填序号)。
a. 若矿石粉中存在少量 FeO,经上述流程也可制得纯度相同的 CoC2O4
b. 向溶液 3 中加入氨水,作用仅是调节溶液的 pH
c. 流程中,仅通过调节溶液的 pH 无法将金属元素完全分离
27.(9 分)
某小组欲探究反应 2Fe2+ + I 2Fe3+ 2 + 2I ,完成如下实验:
资料:AgI 是黄色固体,难溶于稀硝酸。新制的 AgI 见光会少量分解。
(1) 检验 Ⅰ 或 Ⅱ 中有无 Fe3+的实验操作及现象是:取少量 Ⅰ 或 Ⅱ中溶液, 。经检验,Ⅰ、Ⅱ中均未检验出
Fe3+。
(2) Ⅲ中的黄色浑浊是 (写化学式)。
(3) 经检验,Ⅱ→Ⅲ的过程中产生了 Fe3+。
① 对 Fe3+产生的原因做出如下假设:
假设 a:空气中存在 O2,由于 (用离子方程式表示),可产生 Fe3+;
假设 b:溶液中 Ag+具有氧化性,可产生 Fe3+;
假设 c: ;
假设 d:该条件下,I2溶液可将 Fe2+氧化为 Fe3+。
② 通过实验进一步证实 a、b、c 不是产生 Fe3+的主要原因,假设 d 成立。
(4)经检验,Ⅳ中灰黑色浑浊中含有 AgI 和 Ag。
第11页/共12页
① 验证灰黑色浑浊含有 Ag 的实验操作及现象是:取洗净后的灰黑色固体, 。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验 1 和实验 2。
实验 1:向 1 mL 0.1 mol·L 1 FeSO4溶液中加入 1 mL0.1 mol·L 1 AgNO3溶液,开始时,溶液无明显变化。
几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中 Ag+浓度随反应时间的变化如
下图。
实验 2:实验开始时,先向试管中加入几滴 Fe2(SO4)3溶液,重复实验 1,实验结果与实验 1 相同。
ⅰ.实验 1 中发生反应的离子方程式是 。
ⅱ.Ⅳ中迅.速.出现灰黑色浑浊的可能的原因是 。
第12页/共12页
同课章节目录
