【弯道超车】浙教版科学新初三新课预习十(物质的转化)
文档属性
| 名称 | 【弯道超车】浙教版科学新初三新课预习十(物质的转化) |  | |
| 格式 | doc | ||
| 文件大小 | 865.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-07-12 08:48:05 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
新初三科学新课预习十(物质的转化)
一、单选题
1.下列转化不能通过一步反应实现的是( )
A.Fe2O3→Fe B.CO2→CO C.NaNO3→NaCl D.CO2→CaCO3
2.钢铁是应用最广泛的金属,冶金工业中常采用高炉法炼铁,主要存在着如下化学反应:Fe2O3+3COFe+3CO2,该反应利用了CO的( )
A.可燃性 B.有毒性 C.还原性 D.密度小
3.鉴别是重要的实验技能。分别鉴别两组物质:①C、CuO②稀H2SO4、Na2CO3溶液,都能选用的试剂是( )
A.O2 B.NaOH溶液 C.铁片 D.稀H2SO4
4.下列物质的转化中,只有加入酸才能一步实现的是( )
A.CaCO3→CaCl2 B.Fe→FeSO4
C.NaOH→NaCl D.Ba(NO3)2→BaSO4
5.某无色无味的干燥气体通过甲装置后使红棕色的氧化铁粉末变黑。小明猜测该气体可能是氢气、一氧化碳中的一种或两种。为验证猜测,小明从图乙中选择装置和对应药品,并按一定次序连接在甲装置的后面,其中装置和药品选择及装置连接次序最好的是( )
A.①②③⑤ B.①③②⑤ C.①④②⑤ D.③①②⑤
6.不用其他试剂,仅利用组内各溶液之间的相互反应,就能将它们区别出来的是( )
A.H SO 、CuSO 、BaCl 、Na SO
B.FeCl 、Ca(OH) 、NaCl、NaOH
C.Na CO 、BaCl 、HCl、H SO
D.AgNO 、Na CO 、NaCl、Na SO
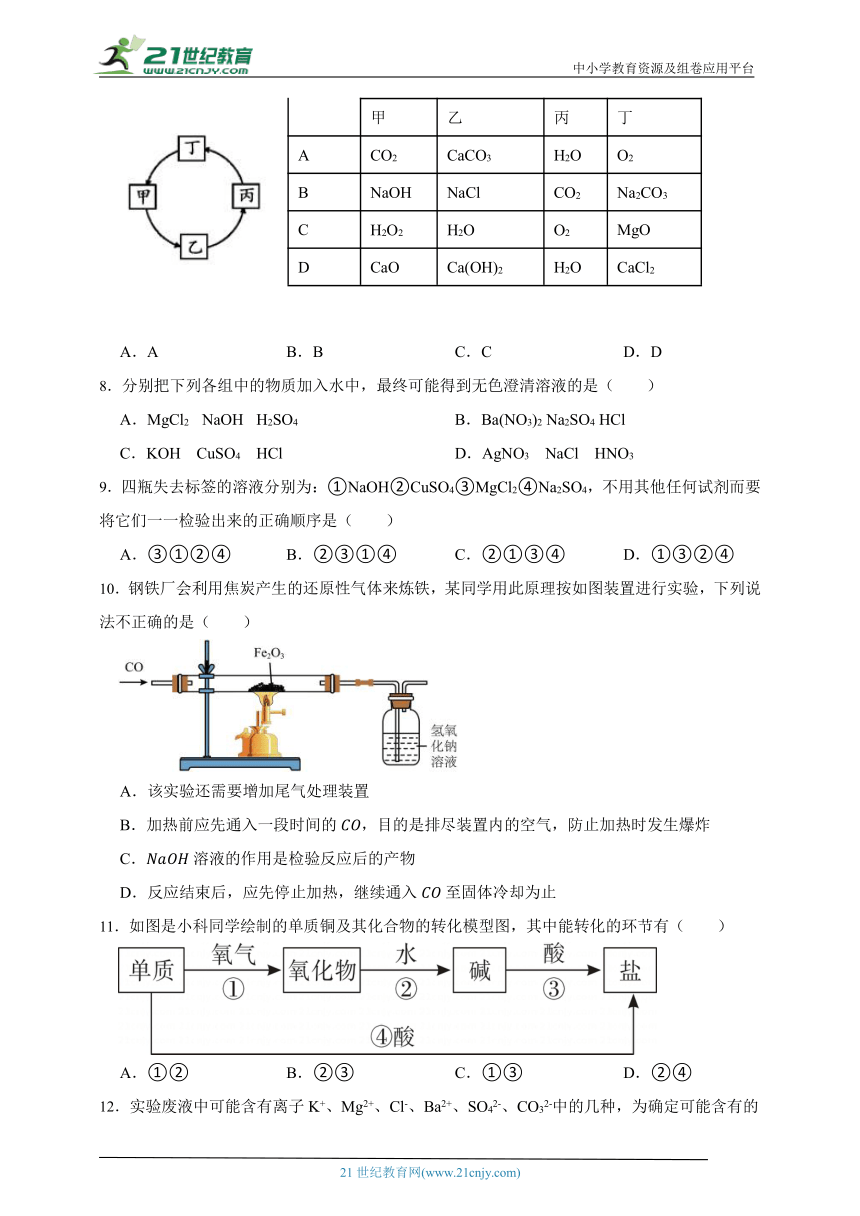
7.下表所列各组物质中,物质之间按箭头所示方向的转化通过一步反应就能实现的是( )
选项 物质
甲 乙 丙 丁
A CO2 CaCO3 H2O O2
B NaOH NaCl CO2 Na2CO3
C H2O2 H2O O2 MgO
D CaO Ca(OH)2 H2O CaCl2
A.A B.B C.C D.D
8.分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是( )
A.MgCl2 NaOH H2SO4 B.Ba(NO3)2 Na2SO4 HCl
C.KOH CuSO4 HCl D.AgNO3 NaCl HNO3
9.四瓶失去标签的溶液分别为:①NaOH②CuSO4③MgCl2④Na2SO4,不用其他任何试剂而要将它们一一检验出来的正确顺序是( )
A.③①②④ B.②③①④ C.②①③④ D.①③②④
10.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的,目的是排尽装置内的空气,防止加热时发生爆炸
C.溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入至固体冷却为止
11.如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( )
A.①② B.②③ C.①③ D.②④
12.实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:
①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解,
分析上面实验得出的结论中,正确的是( )
A.只含有Mg2+、SO42-
B.一定含有K+、Mg2+、Cl-、SO42-
C.一定含有Mg2+、SO42-,可能含有Cl-、K+
D.一定含有Cl-、K+,可能含有Mg2+、SO42-
13.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
14.有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。为确定其组成,进行如下实验:①取少量该固体粉末,加足量水搅拌,静置得到白色沉淀,上层为无色溶液;②过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。根据上述实验现象,下列对原固体粉末的判断正确的是( )
A.一定含有碳酸钠、硫酸钠、硝酸钡和氯化钾,可能含有氦化铜
B.一定含有碳酸钠、硫酸钠和硝酸钡,一定不含氯化铜,可能含有氯化钾
C.一定含有碳酸钠、硫酸钠和硝酸钡,可能含有氯化铜和氯化钾
D.一定含有碳酸钠和硝酸钡,一定不含硫酸钠和氯化铜,可能含有氯化钾
二、填空题
15.甲乙两车间的废水中含有Na+、Ag+、Cu2+、CO32-、OH–、NO3–六种离子(甲乙车间各含三种离子):
(1)乙车间的废水呈蓝色,其中的阴离子为
(2)如果将甲乙两车间的废水混合,可以使废水的某些离子转化为沉淀,经过滤后的废水中一定含有的溶质是 ;
16.有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成。为确认其中的成分,按以下流程进行实验:
(1)操作A是 。
(2)根据实验现象,白色粉末中一定有 (写化学式)。
(3)实验中不能用BaCl2溶液代替Ba(NO3)2溶液,理由是 。
17.某溶液中可能含有Na+, H+, Cl-, SO42-中的几种离子,现欲检验两种阴离子是否存在,选用的最佳方案是:先向溶液中滴入足量的 溶液,若有白色沉淀产生,则证明有SO42-存在;再取上层清液滴加 溶液,若出现白色沉淀,则可得出Cl-存在的结论。
18.有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,科学学习小组进行了下列实验,请回答实验中的相关问题:
(1)取适量添加剂于试管中,加入足量稀盐酸,产生大量气泡并有红色固体残留,该现象说明添加剂中一定含有 ;
(2)另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。则蓝色溶液中一定含有的溶质是 。
19.人们常称铁是第一金属,铁及其化合物在生产生活中发挥着重要作用。
(1)我国早在春秋战国时期就开始生产和使用铁器。深埋的古墓中有些铁器保存至今可能是因为 (可多选)。
A.铁不活泼 B.密封缺氧 C.干燥缺水
(2)日常生活中我们拆开某种食品包装袋时,常常会发现一小包铁粉,撕开后发现袋内有板结的铁锈。这一小包铁粉有 作用。
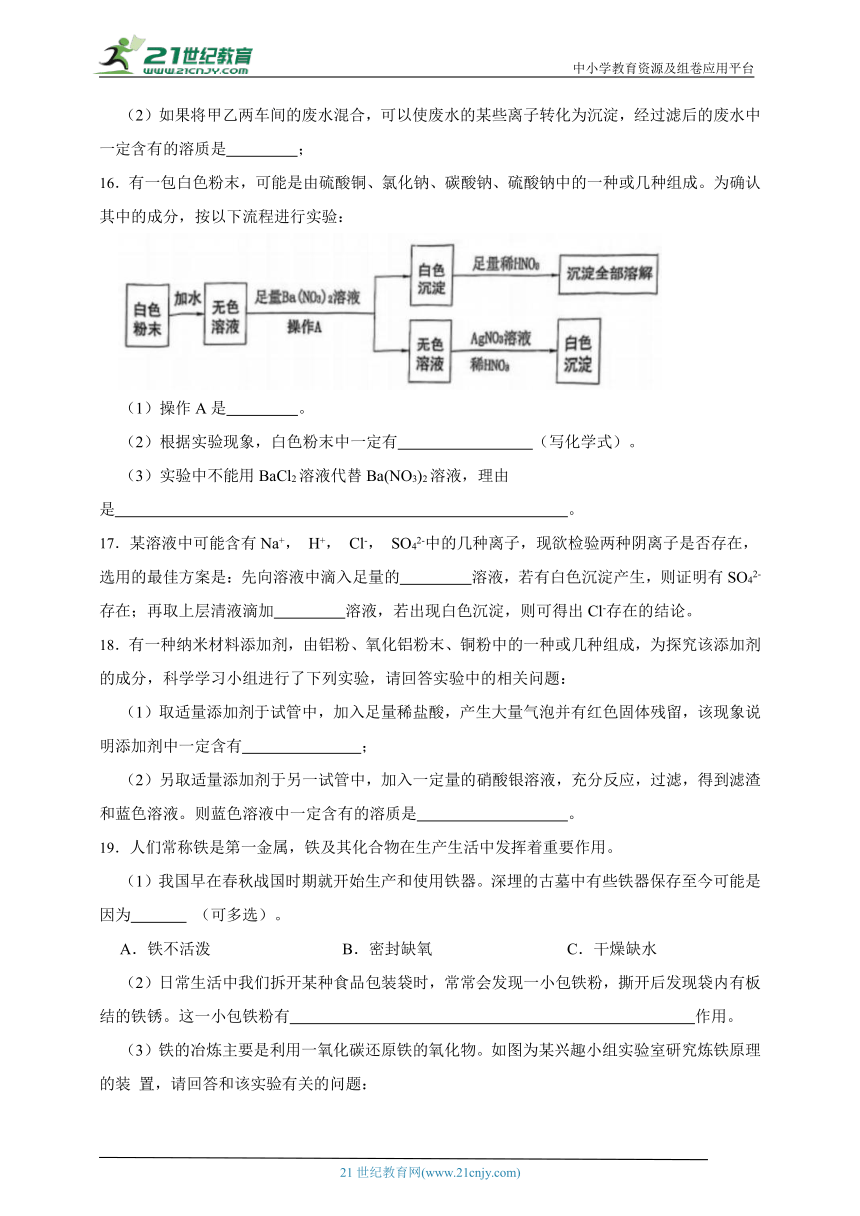
(3)铁的冶炼主要是利用一氧化碳还原铁的氧化物。如图为某兴趣小组实验室研究炼铁原理的装 置,请回答和该实验有关的问题:
① 通入 CO 前要先检验装置的 。
② 实验时先点燃 (填“A”或“C”)酒 精灯,理由是 。
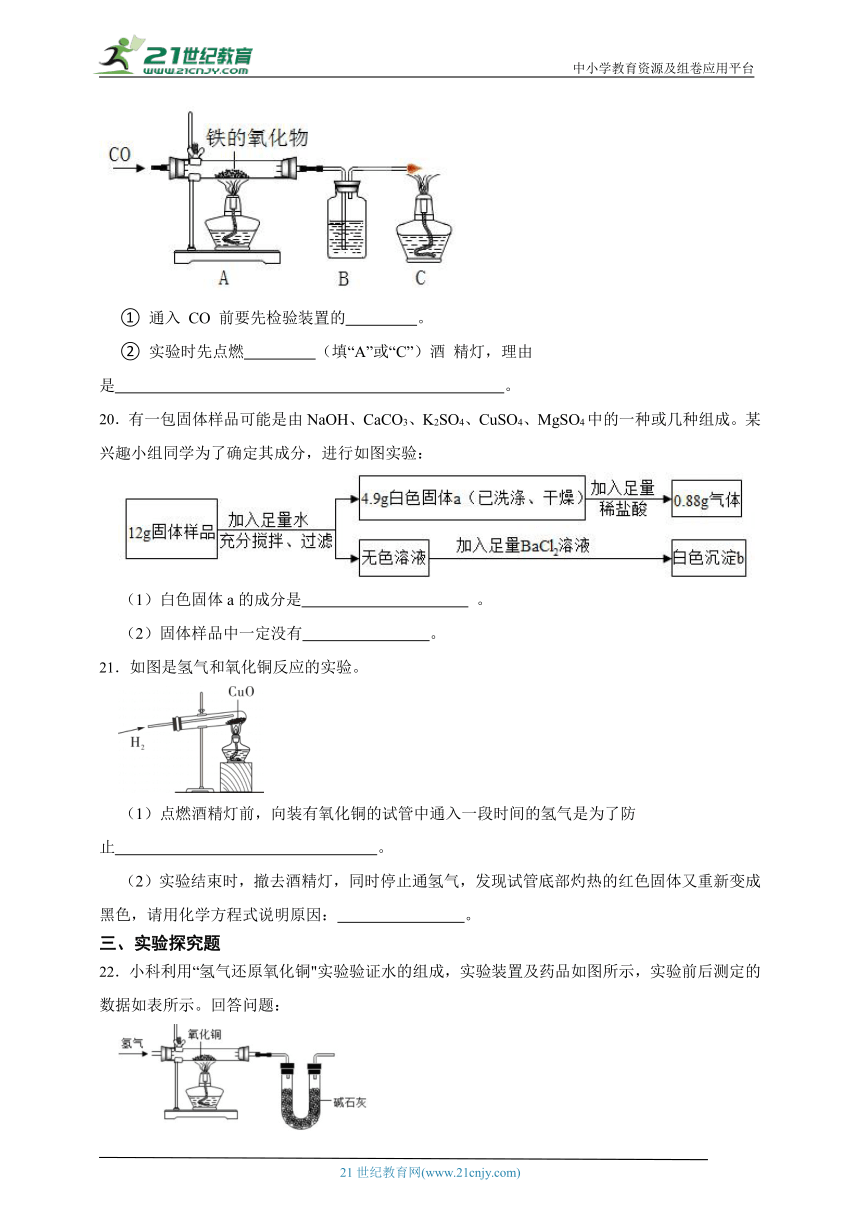
20.有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验:
(1)白色固体a的成分是 。
(2)固体样品中一定没有 。
21.如图是氢气和氧化铜反应的实验。
(1)点燃酒精灯前,向装有氧化铜的试管中通入一段时间的氢气是为了防止 。
(2)实验结束时,撤去酒精灯,同时停止通氢气,发现试管底部灼热的红色固体又重新变成黑色,请用化学方程式说明原因: 。
三、实验探究题
22.小科利用“氢气还原氧化铜"实验验证水的组成,实验装置及药品如图所示,实验前后测定的数据如表所示。回答问题:
实验前 实验后
硬质玻璃管及其内药品的质量/克 75.6 69.2
U形管及其内药品的质量/克 110.8 118.2
(1)为了实验安全,不开后加热硬质玻璃管内氧化铜前,应先进行的实验操作是 。
(2)实验中观察到硬质玻璃管中黑色粉末逐渐变红,则发生反应的化学方程式为 。
(3)验证水的组成的原理为:根据硬质玻璃管及其内药品在反应前后的质量差m1,U形管及其内药品在反应前后的质量差m2,可计算出水中氢、氧元素的质量比为 (用m1、m2表示)。
(4)若实验过程中小科操作无误,依据实验数据,分析产生误差的可能原因 (写出1点)。
23.某混合气体可能有、、中的一种或几种,某学习小组的同学为了探究气体的组成,设计了如下装置进行实验(夹持装置已省略)。实验后发现A装置中溶液变浑浊,C中的固体由黑色变红色,D中的固体由白色变蓝色,F装置中的水流入烧杯。
在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如下表:
反应前后 反应前 反应后
C装置中玻璃管与固体的总质量g a c
D装置中U形管与固体的总质量/g b d
请分析回答下列问题:
(1)一定能证明原混合气体中有氢气存在的实验现象是 。
(2)F装置的作用:①“抽气”;② 。
(3)证明原混合气体中有CO存在的定量关系式子是 (用字母a、b、c、d表示)。
四、解答题
24.实验室用金属镁与100g盐酸反应探究酸的性质。小保取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求:
(1)0.58g沉淀的成分为 。
(2)a点时与NaOH反应的物质化学式 。
(3)若在b点溶液中加AgNO 溶液,出现白色沉淀 (填“能”“不能”)证明HCl有剩余;
(4)计算100g稀盐酸的溶质质量分数。(写出计算过程)
25.已知氢气还原氧化铜实验中氢气和氧化铜已完全反应,但生成物中除了Cu还含有Cu2O,现做“测定产物中Cu2O”的含量实验,已知Cu和Cu2O均为不溶于水的红色固体,Cu2O+H2 H2O+Cu.取氢气还原CuO后的2g的固体样品,小科用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠混合物),并测得以下数据。
(1)在Cu2O+H2H2O+Cu中,氢气体现的化学性质是 性。
(2)经测定反应前后装置d的质量分别为100.00g、100.18g, 计算产物中Cu2O的含量,由数据可知,该样品中Cu2O的质量分数是
(3)另有一种方法利用同样的装置,还可通过测定反应前后装置 (填“a”、 “b”或“c”)的质量达到实验目的。
26.图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8g。将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入的NaOH溶液的质量关系如图乙所示。在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)A溶液中溶质的化学式为 。
(2)NaOH溶液中溶质的质量分数是多少?
(3)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液中溶质的质量是多少?
27.某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算:
(1)固体样品中氧化铁的质量是多少克?
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】C
11.【答案】C
12.【答案】C
13.【答案】C
14.【答案】B
15.【答案】(1)NO3–
(2)NaNO3
16.【答案】(1)过滤
(2)NaCl、Na2CO3
(3)使用氯化钡代替硝酸钡,会引入氯离子,影响氯化钠的鉴别
17.【答案】硝酸钡;硝酸银
18.【答案】(1)铝粉、铜粉
(2)硝酸铜、硝酸铝
19.【答案】(1)B;C
(2)吸收食品中氧气和水分,延缓食品被氧化变质的作用
(3)气密性;C;防止装置发生爆炸,防止污染空气(合理均给分)
20.【答案】(1)碳酸钙、氢氧化镁
(2)CuSO4 K2SO4
21.【答案】(1)氢气与空气混合加热而导致爆炸
(2)2Cu+O2 2CuO
22.【答案】(1)通一段时间的氢气
(2)CuO+H2Cu+H2O
(3)(m2—m1)∶m1
(4)U形管中的碱石灰吸收了空气中的水和二氧化碳
23.【答案】(1)D中固体由白色变为蓝色
(2)收集尾气
(3)
24.【答案】(1)Mg(OH)2
(2)HCl
(3)不能
(4)解:氢氧化钠溶液中钠元素的质量=150g×8%××100%=6.9g,
生成的氯化钠的质量=6.9g÷×100%=17.55g,
其中氯元素的质量=17.55g××100%=10.65g,
所用盐酸中HCl的质量=10.65g÷x100%=10.95%,
100g=×100%=10.95%
稀盐酸的溶质质量分数
25.【答案】(1)还原
(2)72%
(3)c
26.【答案】(1)H2SO4
(2)设由CuO生成的CuSO4的质量为x
CuO+H2SO4=CuSO4+H2O
80 160
8g x
;
解得:x=16g;
设与CuSO4反应的NaOH的质量为y,同时生成Na2SO4的质量为a,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 142
16g y a
;
解得:y=8g;
所用氢氧化钠溶液中溶质的质量分数为:;
;
解得:a=14.2g;
(3)设硫酸与氢氧化钠反应生成硫酸钠质量为b,
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g×20% b
;
解得:b=21.3g;
所得溶液中溶质的质量为:21.3g+14.2g=35.5g。
27.【答案】(1)解:设固体样品中氧化铁的质量为x,则
Fe2O3+3CO 2Fe+3CO2 固体减重
160 112 160-112
x 13.6g-11.2g
解得:x=8g
(2)解:设生成的氯化铁和氢气质量分别为y、z,则
Fe+2HCl= FeCl2+ H2↑
56 127 2
11.2g y z
解得y=25.4g;z=0.4g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
新初三科学新课预习十(物质的转化)
一、单选题
1.下列转化不能通过一步反应实现的是( )
A.Fe2O3→Fe B.CO2→CO C.NaNO3→NaCl D.CO2→CaCO3
2.钢铁是应用最广泛的金属,冶金工业中常采用高炉法炼铁,主要存在着如下化学反应:Fe2O3+3COFe+3CO2,该反应利用了CO的( )
A.可燃性 B.有毒性 C.还原性 D.密度小
3.鉴别是重要的实验技能。分别鉴别两组物质:①C、CuO②稀H2SO4、Na2CO3溶液,都能选用的试剂是( )
A.O2 B.NaOH溶液 C.铁片 D.稀H2SO4
4.下列物质的转化中,只有加入酸才能一步实现的是( )
A.CaCO3→CaCl2 B.Fe→FeSO4
C.NaOH→NaCl D.Ba(NO3)2→BaSO4
5.某无色无味的干燥气体通过甲装置后使红棕色的氧化铁粉末变黑。小明猜测该气体可能是氢气、一氧化碳中的一种或两种。为验证猜测,小明从图乙中选择装置和对应药品,并按一定次序连接在甲装置的后面,其中装置和药品选择及装置连接次序最好的是( )
A.①②③⑤ B.①③②⑤ C.①④②⑤ D.③①②⑤
6.不用其他试剂,仅利用组内各溶液之间的相互反应,就能将它们区别出来的是( )
A.H SO 、CuSO 、BaCl 、Na SO
B.FeCl 、Ca(OH) 、NaCl、NaOH
C.Na CO 、BaCl 、HCl、H SO
D.AgNO 、Na CO 、NaCl、Na SO
7.下表所列各组物质中,物质之间按箭头所示方向的转化通过一步反应就能实现的是( )
选项 物质
甲 乙 丙 丁
A CO2 CaCO3 H2O O2
B NaOH NaCl CO2 Na2CO3
C H2O2 H2O O2 MgO
D CaO Ca(OH)2 H2O CaCl2
A.A B.B C.C D.D
8.分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是( )
A.MgCl2 NaOH H2SO4 B.Ba(NO3)2 Na2SO4 HCl
C.KOH CuSO4 HCl D.AgNO3 NaCl HNO3
9.四瓶失去标签的溶液分别为:①NaOH②CuSO4③MgCl2④Na2SO4,不用其他任何试剂而要将它们一一检验出来的正确顺序是( )
A.③①②④ B.②③①④ C.②①③④ D.①③②④
10.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的,目的是排尽装置内的空气,防止加热时发生爆炸
C.溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入至固体冷却为止
11.如图是小科同学绘制的单质铜及其化合物的转化模型图,其中能转化的环节有( )
A.①② B.②③ C.①③ D.②④
12.实验废液中可能含有离子K+、Mg2+、Cl-、Ba2+、SO42-、CO32-中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:
①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解,
分析上面实验得出的结论中,正确的是( )
A.只含有Mg2+、SO42-
B.一定含有K+、Mg2+、Cl-、SO42-
C.一定含有Mg2+、SO42-,可能含有Cl-、K+
D.一定含有Cl-、K+,可能含有Mg2+、SO42-
13.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
14.有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。为确定其组成,进行如下实验:①取少量该固体粉末,加足量水搅拌,静置得到白色沉淀,上层为无色溶液;②过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。根据上述实验现象,下列对原固体粉末的判断正确的是( )
A.一定含有碳酸钠、硫酸钠、硝酸钡和氯化钾,可能含有氦化铜
B.一定含有碳酸钠、硫酸钠和硝酸钡,一定不含氯化铜,可能含有氯化钾
C.一定含有碳酸钠、硫酸钠和硝酸钡,可能含有氯化铜和氯化钾
D.一定含有碳酸钠和硝酸钡,一定不含硫酸钠和氯化铜,可能含有氯化钾
二、填空题
15.甲乙两车间的废水中含有Na+、Ag+、Cu2+、CO32-、OH–、NO3–六种离子(甲乙车间各含三种离子):
(1)乙车间的废水呈蓝色,其中的阴离子为
(2)如果将甲乙两车间的废水混合,可以使废水的某些离子转化为沉淀,经过滤后的废水中一定含有的溶质是 ;
16.有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成。为确认其中的成分,按以下流程进行实验:
(1)操作A是 。
(2)根据实验现象,白色粉末中一定有 (写化学式)。
(3)实验中不能用BaCl2溶液代替Ba(NO3)2溶液,理由是 。
17.某溶液中可能含有Na+, H+, Cl-, SO42-中的几种离子,现欲检验两种阴离子是否存在,选用的最佳方案是:先向溶液中滴入足量的 溶液,若有白色沉淀产生,则证明有SO42-存在;再取上层清液滴加 溶液,若出现白色沉淀,则可得出Cl-存在的结论。
18.有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,科学学习小组进行了下列实验,请回答实验中的相关问题:
(1)取适量添加剂于试管中,加入足量稀盐酸,产生大量气泡并有红色固体残留,该现象说明添加剂中一定含有 ;
(2)另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。则蓝色溶液中一定含有的溶质是 。
19.人们常称铁是第一金属,铁及其化合物在生产生活中发挥着重要作用。
(1)我国早在春秋战国时期就开始生产和使用铁器。深埋的古墓中有些铁器保存至今可能是因为 (可多选)。
A.铁不活泼 B.密封缺氧 C.干燥缺水
(2)日常生活中我们拆开某种食品包装袋时,常常会发现一小包铁粉,撕开后发现袋内有板结的铁锈。这一小包铁粉有 作用。
(3)铁的冶炼主要是利用一氧化碳还原铁的氧化物。如图为某兴趣小组实验室研究炼铁原理的装 置,请回答和该实验有关的问题:
① 通入 CO 前要先检验装置的 。
② 实验时先点燃 (填“A”或“C”)酒 精灯,理由是 。
20.有一包固体样品可能是由NaOH、CaCO3、K2SO4、CuSO4、MgSO4中的一种或几种组成。某兴趣小组同学为了确定其成分,进行如图实验:
(1)白色固体a的成分是 。
(2)固体样品中一定没有 。
21.如图是氢气和氧化铜反应的实验。
(1)点燃酒精灯前,向装有氧化铜的试管中通入一段时间的氢气是为了防止 。
(2)实验结束时,撤去酒精灯,同时停止通氢气,发现试管底部灼热的红色固体又重新变成黑色,请用化学方程式说明原因: 。
三、实验探究题
22.小科利用“氢气还原氧化铜"实验验证水的组成,实验装置及药品如图所示,实验前后测定的数据如表所示。回答问题:
实验前 实验后
硬质玻璃管及其内药品的质量/克 75.6 69.2
U形管及其内药品的质量/克 110.8 118.2
(1)为了实验安全,不开后加热硬质玻璃管内氧化铜前,应先进行的实验操作是 。
(2)实验中观察到硬质玻璃管中黑色粉末逐渐变红,则发生反应的化学方程式为 。
(3)验证水的组成的原理为:根据硬质玻璃管及其内药品在反应前后的质量差m1,U形管及其内药品在反应前后的质量差m2,可计算出水中氢、氧元素的质量比为 (用m1、m2表示)。
(4)若实验过程中小科操作无误,依据实验数据,分析产生误差的可能原因 (写出1点)。
23.某混合气体可能有、、中的一种或几种,某学习小组的同学为了探究气体的组成,设计了如下装置进行实验(夹持装置已省略)。实验后发现A装置中溶液变浑浊,C中的固体由黑色变红色,D中的固体由白色变蓝色,F装置中的水流入烧杯。
在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如下表:
反应前后 反应前 反应后
C装置中玻璃管与固体的总质量g a c
D装置中U形管与固体的总质量/g b d
请分析回答下列问题:
(1)一定能证明原混合气体中有氢气存在的实验现象是 。
(2)F装置的作用:①“抽气”;② 。
(3)证明原混合气体中有CO存在的定量关系式子是 (用字母a、b、c、d表示)。
四、解答题
24.实验室用金属镁与100g盐酸反应探究酸的性质。小保取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求:
(1)0.58g沉淀的成分为 。
(2)a点时与NaOH反应的物质化学式 。
(3)若在b点溶液中加AgNO 溶液,出现白色沉淀 (填“能”“不能”)证明HCl有剩余;
(4)计算100g稀盐酸的溶质质量分数。(写出计算过程)
25.已知氢气还原氧化铜实验中氢气和氧化铜已完全反应,但生成物中除了Cu还含有Cu2O,现做“测定产物中Cu2O”的含量实验,已知Cu和Cu2O均为不溶于水的红色固体,Cu2O+H2 H2O+Cu.取氢气还原CuO后的2g的固体样品,小科用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠混合物),并测得以下数据。
(1)在Cu2O+H2H2O+Cu中,氢气体现的化学性质是 性。
(2)经测定反应前后装置d的质量分别为100.00g、100.18g, 计算产物中Cu2O的含量,由数据可知,该样品中Cu2O的质量分数是
(3)另有一种方法利用同样的装置,还可通过测定反应前后装置 (填“a”、 “b”或“c”)的质量达到实验目的。
26.图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8g。将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入的NaOH溶液的质量关系如图乙所示。在D中加入Ba(NO3)2溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)A溶液中溶质的化学式为 。
(2)NaOH溶液中溶质的质量分数是多少?
(3)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液中溶质的质量是多少?
27.某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算:
(1)固体样品中氧化铁的质量是多少克?
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】D
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】A
8.【答案】A
9.【答案】C
10.【答案】C
11.【答案】C
12.【答案】C
13.【答案】C
14.【答案】B
15.【答案】(1)NO3–
(2)NaNO3
16.【答案】(1)过滤
(2)NaCl、Na2CO3
(3)使用氯化钡代替硝酸钡,会引入氯离子,影响氯化钠的鉴别
17.【答案】硝酸钡;硝酸银
18.【答案】(1)铝粉、铜粉
(2)硝酸铜、硝酸铝
19.【答案】(1)B;C
(2)吸收食品中氧气和水分,延缓食品被氧化变质的作用
(3)气密性;C;防止装置发生爆炸,防止污染空气(合理均给分)
20.【答案】(1)碳酸钙、氢氧化镁
(2)CuSO4 K2SO4
21.【答案】(1)氢气与空气混合加热而导致爆炸
(2)2Cu+O2 2CuO
22.【答案】(1)通一段时间的氢气
(2)CuO+H2Cu+H2O
(3)(m2—m1)∶m1
(4)U形管中的碱石灰吸收了空气中的水和二氧化碳
23.【答案】(1)D中固体由白色变为蓝色
(2)收集尾气
(3)
24.【答案】(1)Mg(OH)2
(2)HCl
(3)不能
(4)解:氢氧化钠溶液中钠元素的质量=150g×8%××100%=6.9g,
生成的氯化钠的质量=6.9g÷×100%=17.55g,
其中氯元素的质量=17.55g××100%=10.65g,
所用盐酸中HCl的质量=10.65g÷x100%=10.95%,
100g=×100%=10.95%
稀盐酸的溶质质量分数
25.【答案】(1)还原
(2)72%
(3)c
26.【答案】(1)H2SO4
(2)设由CuO生成的CuSO4的质量为x
CuO+H2SO4=CuSO4+H2O
80 160
8g x
;
解得:x=16g;
设与CuSO4反应的NaOH的质量为y,同时生成Na2SO4的质量为a,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 142
16g y a
;
解得:y=8g;
所用氢氧化钠溶液中溶质的质量分数为:;
;
解得:a=14.2g;
(3)设硫酸与氢氧化钠反应生成硫酸钠质量为b,
H2SO4+2NaOH=Na2SO4+2H2O
80 142
60g×20% b
;
解得:b=21.3g;
所得溶液中溶质的质量为:21.3g+14.2g=35.5g。
27.【答案】(1)解:设固体样品中氧化铁的质量为x,则
Fe2O3+3CO 2Fe+3CO2 固体减重
160 112 160-112
x 13.6g-11.2g
解得:x=8g
(2)解:设生成的氯化铁和氢气质量分别为y、z,则
Fe+2HCl= FeCl2+ H2↑
56 127 2
11.2g y z
解得y=25.4g;z=0.4g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
