1.3 第2课时 氧化剂和还原剂(学案)(含答案)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3 第2课时 氧化剂和还原剂(学案)(含答案)高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | doc | ||
| 文件大小 | 847.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-12 21:54:02 | ||
图片预览




文档简介
1.3 第2课时 氧化剂和还原剂
[学习目标] 1.知道常见的氧化剂和还原剂。2.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念。
探究一 氧化剂与还原剂
1.氧化剂与还原剂
(1)氧化剂:在氧化还原反应中,所含元素的化合价_______,即_______电子(或电子对 偏向 )的物质。
(2)还原剂:在氧化还原反应中,所含元素的化合价_______,即_______电子(或电子对_______)的物质。
2.氧化产物与还原产物
(1)氧化产物:还原剂被_______生成的物质。
(2)还原产物:氧化剂被_______生成的物质。
[问题探究]
[探究1] 用单线桥法标出下列反应电子转移的方向及数目。
(1)WO3+3H2W+3H2O
(2)MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(3)2H2S+SO2===3S↓+2H2O
[探究2] 用图示法表示氧化还原反应中相关概念之间的联系。
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
表示电子转移方向及数目的方法——单线桥法
1.单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2.注意事项
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向反应物中得电子元素原子。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
分析下列反应并按要求填空。
(1)2Fe+3Cl22FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)2KMnO4K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是________,被还原的元素是________。
(3)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是________;氧化产物是________,还原产物是 ______ 。
探究二 常见氧化剂与还原剂
1.常见的氧化剂
(1)活泼性较强的非金属单质:如_______、O2等。
(2)变价元素的高价态化合物:如_______、_______、_______等。
(3)过氧化物:如Na2O2、H2O2等。
(4)其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
2.常见的还原剂
(1)活泼性较强的金属单质:如Al、Fe、Zn等。
(2)某些非金属单质:如_______、_______、_______等。
(3)含有较低价态元素的化合物:如KI、CO、SO2等。
(4)其他:如浓盐酸、NH3等。
3.氧化性与还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
[问题探究]
[探究1] 探究物质的氧化性、还原性与元素化合价的关系
下列微粒:①S2- ②SO2 ③浓H2SO4,从硫元素的角度分析,只有还原性的是 ______ (填序号,下同),只有氧化性的是 ______ ,既有氧化性又有还原性的是______。
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
元素处于最高价只有氧化性,元素处于最低价只有还原性,元素处于中间价态既有氧化性又有还原性。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[探究2] 比较氧化性、还原性的强弱
1.已知下列反应:①2Fe+3Cl22FeCl3、②Fe+SFeS。可判断氧化性:氯气________硫。
2.常温下,发生下列反应:①16H++10Cl-+2MnO===2Mn2++5Cl2↑+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 ______________ ,还原性由强到弱的顺序是 ______________ 。
3.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ________ (填代码)。
①2W-+Z2===2Z-+W2
②2X-+Z2===2Z-+X2
③2Y-+W2===2W-+Y2
④2Z-+X2===2X-+Z2
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
根据氧化还原反应方程式比较氧化性、还原性强弱
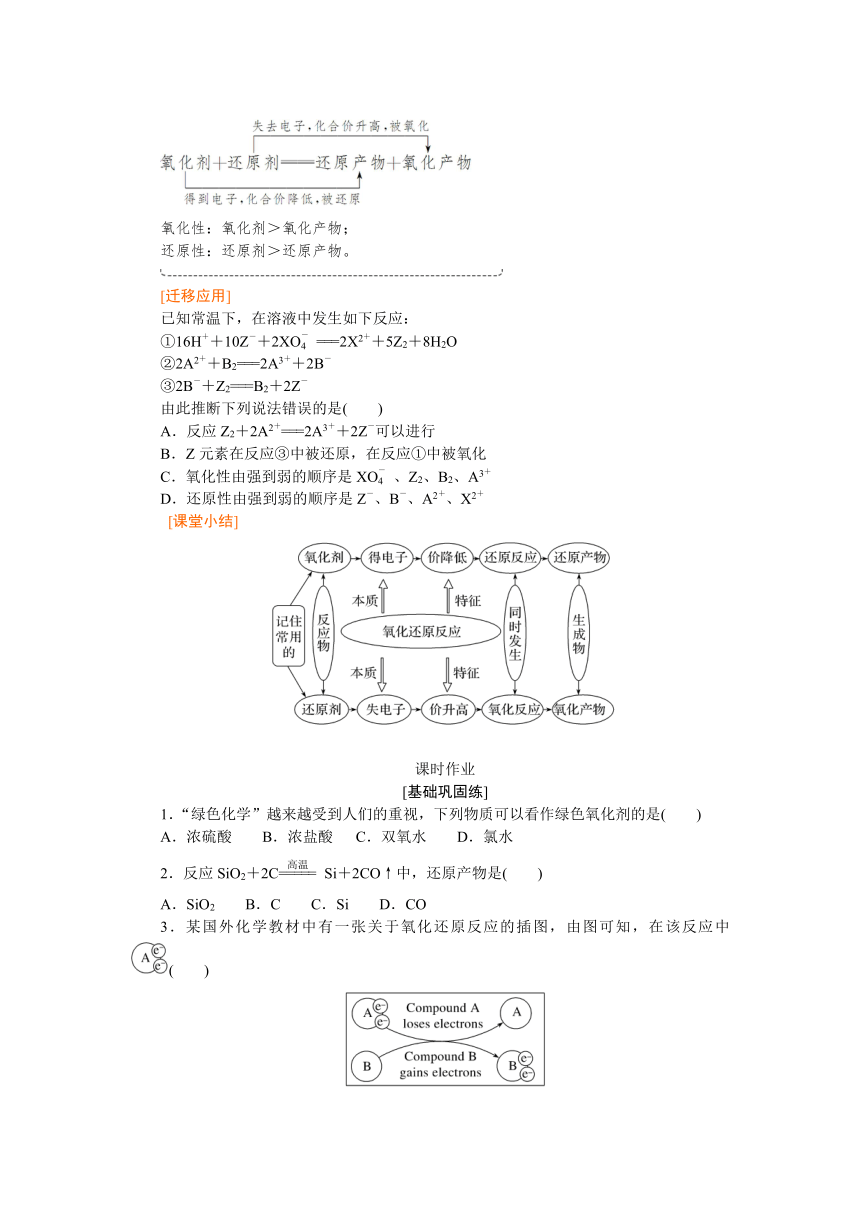
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
[课堂小结]
课时作业
[基础巩固练]
1.“绿色化学”越来越受到人们的重视,下列物质可以看作绿色氧化剂的是( )
A.浓硫酸 B.浓盐酸 C.双氧水 D.氯水
2.反应SiO2+2CSi+2CO↑中,还原产物是( )
A.SiO2 B.C C.Si D.CO
3.某国外化学教材中有一张关于氧化还原反应的插图,由图可知,在该反应中( )
A.作还原剂 B.作氧化剂
C.发生还原反应 D.表现氧化性
4.当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物。则这种空气中常见的氧化剂是( )
A.N2 B.O2 C.H2O D.CO2
5.在下列反应中,CO2作氧化剂的是( )
A.Ca(OH)2+CO2===CaCO3↓+H2O
B.CO2+C2CO
C.2Fe2O3+3C4Fe+3CO2↑
D.C+2H2O(g)2H2+CO2
6.下列变化过程一定需要加入还原剂的是( )
A.KClO3―→KCl B.KCl―→AgCl
C.H+―→H2 D.C―→CO2
7.下列微粒中,只有氧化性的是( )
①S2- ②S ③H+ ④Na+ ⑤Mg
A.①⑤ B.②④ C.③④ D.②⑤
8.根据离子方程式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+。可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
9.在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是 ________,实例: __________________________________ 。
(2)只能做还原剂的是:________,实例: ________________________________ 。
(3)H2O作为氧化剂的反应实例: __________________________________ 。
[能力提升练]
10.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.2F2+2H2O===4HF+O2
C.Cl2+H2O===HCl+HClO
D.2Na+2H2O===2NaOH+H2↑
11.下列氧化还原反应中电子转移数目及方向都正确的是( )
12.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是该反应的产物之一。
(1)从硫和氮元素的价态看,只有氧化性的物质是 ____________ ,只有还原性的物质是 __________ ,既有氧化性又有还原性的物质是 __________ 。
(2)该反应中还原剂是 ____________ ,氧化剂是 ____________ 。
(3)氧化性:HNO3________S(填“>”或“<”)。
【答案解析】
1.3 第2课时 氧化剂和还原剂
探究一 氧化剂与还原剂
1.氧化剂与还原剂
(1)氧化剂:在氧化还原反应中,所含元素的化合价 降低 ,即 得到 电子(或电子对 偏向 )的物质。
(2)还原剂:在氧化还原反应中,所含元素的化合价 升高 ,即 失去 电子(或电子对 偏离 )的物质。
2.氧化产物与还原产物
(1)氧化产物:还原剂被 氧化 生成的物质。
(2)还原产物:氧化剂被 还原 生成的物质。
[问题探究]
[探究1] 用单线桥法标出下列反应电子转移的方向及数目。
(1)WO3+3H2W+3H2O
(2)MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(3)2H2S+SO2===3S↓+2H2O
[提示] (1)
(2)
(3)
[探究2] 用图示法表示氧化还原反应中相关概念之间的联系。
[提示]
[或(1)还原剂→化合价升高→失去电子→发生氧化反应(被氧化)→生成氧化产物。
(2)氧化剂化→合价降低→得到电子→发生还原反应(被还原)→生成还原产物。]
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
表示电子转移方向及数目的方法——单线桥法
1.单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2.注意事项
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向反应物中得电子元素原子。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
分析下列反应并按要求填空。
(1)2Fe+3Cl22FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)2KMnO4K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是________,被还原的元素是________。
(3)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是________;氧化产物是________,还原产物是 ______ 。
[答案] (1)Cl2 Fe Fe Cl2
(2)KMnO4 KMnO4 O Mn
(3)H2O2 Fe2+ Fe3+ H2O
探究二 常见氧化剂与还原剂
1.常见的氧化剂
(1)活泼性较强的非金属单质:如 Cl2 、O2等。
(2)变价元素的高价态化合物:如 KMnO4 、 FeCl3 、 HNO3 等。
(3)过氧化物:如Na2O2、H2O2等。
(4)其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
2.常见的还原剂
(1)活泼性较强的金属单质:如Al、Fe、Zn等。
(2)某些非金属单质:如 H2 、 S 、 C 等。
(3)含有较低价态元素的化合物:如KI、CO、SO2等。
(4)其他:如浓盐酸、NH3等。
3.氧化性与还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
[问题探究]
[探究1] 探究物质的氧化性、还原性与元素化合价的关系
下列微粒:①S2- ②SO2 ③浓H2SO4,从硫元素的角度分析,只有还原性的是 ______ (填序号,下同),只有氧化性的是 ______ ,既有氧化性又有还原性的是 ______ 。
[提示] ① ③ ②
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
元素处于最高价只有氧化性,元素处于最低价只有还原性,元素处于中间价态既有氧化性又有还原性。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[探究2] 比较氧化性、还原性的强弱
1.已知下列反应:①2Fe+3Cl22FeCl3、②Fe+SFeS。可判断氧化性:氯气________硫。
[提示] >
2.常温下,发生下列反应:①16H++10Cl-+2MnO===2Mn2++5Cl2↑+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 ______________ ,还原性由强到弱的顺序是 ______________ 。
[提示] MnO>Cl2>Br2>Fe3+ Fe2+>Br->Cl->Mn2+
3.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ________ (填代码)。
①2W-+Z2===2Z-+W2
②2X-+Z2===2Z-+X2
③2Y-+W2===2W-+Y2
④2Z-+X2===2X-+Z2
[提示] ②③
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
根据氧化还原反应方程式比较氧化性、还原性强弱
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
D [由反应①可知氧化性:XO>Z2、还原性Z->X2+;由反应②可知氧化性B2>A3+、还原性A2+>B-;由反应③可知氧化性Z2>B2、还原性B->Z-。所以有氧化性XO>Z2>B2>A3+;还原性A2+>B->Z->X2+。A.根据分析可知氧化性Z2>A3+,所以Z2可以氧化A2+,故A正确;B.反应③中Z元素化合价由0价变为-1价被还原;反应①中Z元素化合价由-1价变为0价被氧化,故B正确;C.根据分析可知氧化性由强到弱为XO>Z2>B2>A3+,故C正确;D.根据分析可知还原性由强到弱为A2+>B->Z->X2+,故D错误。]
[课堂小结]
课时作业
[基础巩固练]
1.“绿色化学”越来越受到人们的重视,下列物质可以看作绿色氧化剂的是( )
A.浓硫酸 B.浓盐酸 C.双氧水 D.氯水
C [双氧水还原后的产物为水,对环境没有污染。]
2.反应SiO2+2CSi+2CO↑中,还原产物是( )
A.SiO2 B.C C.Si D.CO
[答案] C
3.某国外化学教材中有一张关于氧化还原反应的插图,由图可知,在该反应中( )
A.作还原剂 B.作氧化剂
C.发生还原反应 D.表现氧化性
[答案] A
4.当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物。则这种空气中常见的氧化剂是( )
A.N2 B.O2 C.H2O D.CO2
[答案] B
5.在下列反应中,CO2作氧化剂的是( )
A.Ca(OH)2+CO2===CaCO3↓+H2O
B.CO2+C2CO
C.2Fe2O3+3C4Fe+3CO2↑
D.C+2H2O(g)2H2+CO2
B [选项A中CO2中碳元素化合价无变化;选项B中CO2中碳元素化合价由+4降低为+2,作氧化剂;选项C、D中CO2都为氧化产物。]
6.下列变化过程一定需要加入还原剂的是( )
A.KClO3―→KCl B.KCl―→AgCl
C.H+―→H2 D.C―→CO2
C [变化过程一定需要加入还原剂,这说明该微粒作氧化剂,得到电子,相关元素的化合价一定降低。但A项可发生2KClO32KCl+3O2↑,无需加入还原剂,故A错。]
7.下列微粒中,只有氧化性的是( )
①S2- ②S ③H+ ④Na+ ⑤Mg
A.①⑤ B.②④ C.③④ D.②⑤
C [元素的化合价位于最高价态时,只具有氧化性,五种微粒中只有H+、Na+是对应元素的最高价态,因此只具有氧化性。]
8.根据离子方程式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+。可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
B [根据同一氧化还原反应中,还原性:还原剂>还原产物进行判断。①中,还原性:I->Fe2+,②中,还原性:Fe2+>Br-。]
9.在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是 ________,实例: __________________________________ 。
(2)只能做还原剂的是:________,实例: ________________________________ 。
(3)H2O作为氧化剂的反应实例: __________________________________ 。
[解析] 所含元素处于最高价的只能做氧化剂(Cu2+),所含元素处于最低价的只能做还原剂(Mg)。
[答案] (1)Cu2+ Mg+CuCl2===MgCl2+Cu
(2)Mg Mg+2HCl===MgCl2+H2↑
(3)C+H2O(g)CO+H2(答案合理即可)
[能力提升练]
10.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.2F2+2H2O===4HF+O2
C.Cl2+H2O===HCl+HClO
D.2Na+2H2O===2NaOH+H2↑
C [各元素的化合价均没有发生变化,不属于氧化还原反应,A错误;水中O元素的化合价升高,水作还原剂,B错误;Cl2中Cl元素的化合价发生变化,属于氧化还原反应,但水中H、O元素的化合价均不变,故水既不作氧化剂又不作还原剂,C正确;水中H元素的化合价降低,水作氧化剂,D错误。]
11.下列氧化还原反应中电子转移数目及方向都正确的是( )
B [A.Cl元素得到电子,O元素失去电子,该反应转移12e-,图中转移电子数目不正确,错误;B.Fe元素得到电子,I元素失去电子,该反应转移2e-,正确;C.F元素得到电子,O元素失去电子,该反应转移4e-,图中箭头的方向标反了,错误;D.Br元素得到电子,S元素失去电子,该反应转移2e-,图中箭头的方向标反了,错误。]
12.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是该反应的产物之一。
(1)从硫和氮元素的价态看,只有氧化性的物质是 ____________ ,只有还原性的物质是 __________ ,既有氧化性又有还原性的物质是 __________ 。
(2)该反应中还原剂是 ____________ ,氧化剂是 ____________ 。
(3)氧化性:HNO3________S(填“>”或“<”)。
[解析] 水是生成物之一,说明反应物中肯定含有氢、氧元素,含有氢元素的有H2S和HNO3,含有氧元素的有HNO3和NO;观察五种物质,含硫元素的有S和H2S,含氮元素的有HNO3和NO。根据氧化还原反应的特点,如果S是反应物,则H2S是生成物,此时S得电子,N只能失电子,即NO是反应物,两种反应物中均没有氢元素,所以S和NO不可能是反应物;由以上分析可知,反应物只能是H2S和HNO3,生成物只能是S、NO和H2O。
[答案] (1)HNO3 H2S NO、S
(2)H2S HNO3
(3)>
[学习目标] 1.知道常见的氧化剂和还原剂。2.能从化学反应中元素化合价的变化认识氧化剂和还原剂、氧化产物和还原产物等概念。
探究一 氧化剂与还原剂
1.氧化剂与还原剂
(1)氧化剂:在氧化还原反应中,所含元素的化合价_______,即_______电子(或电子对 偏向 )的物质。
(2)还原剂:在氧化还原反应中,所含元素的化合价_______,即_______电子(或电子对_______)的物质。
2.氧化产物与还原产物
(1)氧化产物:还原剂被_______生成的物质。
(2)还原产物:氧化剂被_______生成的物质。
[问题探究]
[探究1] 用单线桥法标出下列反应电子转移的方向及数目。
(1)WO3+3H2W+3H2O
(2)MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(3)2H2S+SO2===3S↓+2H2O
[探究2] 用图示法表示氧化还原反应中相关概念之间的联系。
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
表示电子转移方向及数目的方法——单线桥法
1.单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2.注意事项
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向反应物中得电子元素原子。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
分析下列反应并按要求填空。
(1)2Fe+3Cl22FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)2KMnO4K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是________,被还原的元素是________。
(3)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是________;氧化产物是________,还原产物是 ______ 。
探究二 常见氧化剂与还原剂
1.常见的氧化剂
(1)活泼性较强的非金属单质:如_______、O2等。
(2)变价元素的高价态化合物:如_______、_______、_______等。
(3)过氧化物:如Na2O2、H2O2等。
(4)其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
2.常见的还原剂
(1)活泼性较强的金属单质:如Al、Fe、Zn等。
(2)某些非金属单质:如_______、_______、_______等。
(3)含有较低价态元素的化合物:如KI、CO、SO2等。
(4)其他:如浓盐酸、NH3等。
3.氧化性与还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
[问题探究]
[探究1] 探究物质的氧化性、还原性与元素化合价的关系
下列微粒:①S2- ②SO2 ③浓H2SO4,从硫元素的角度分析,只有还原性的是 ______ (填序号,下同),只有氧化性的是 ______ ,既有氧化性又有还原性的是______。
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
元素处于最高价只有氧化性,元素处于最低价只有还原性,元素处于中间价态既有氧化性又有还原性。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[探究2] 比较氧化性、还原性的强弱
1.已知下列反应:①2Fe+3Cl22FeCl3、②Fe+SFeS。可判断氧化性:氯气________硫。
2.常温下,发生下列反应:①16H++10Cl-+2MnO===2Mn2++5Cl2↑+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 ______________ ,还原性由强到弱的顺序是 ______________ 。
3.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ________ (填代码)。
①2W-+Z2===2Z-+W2
②2X-+Z2===2Z-+X2
③2Y-+W2===2W-+Y2
④2Z-+X2===2X-+Z2
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
根据氧化还原反应方程式比较氧化性、还原性强弱
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
[课堂小结]
课时作业
[基础巩固练]
1.“绿色化学”越来越受到人们的重视,下列物质可以看作绿色氧化剂的是( )
A.浓硫酸 B.浓盐酸 C.双氧水 D.氯水
2.反应SiO2+2CSi+2CO↑中,还原产物是( )
A.SiO2 B.C C.Si D.CO
3.某国外化学教材中有一张关于氧化还原反应的插图,由图可知,在该反应中( )
A.作还原剂 B.作氧化剂
C.发生还原反应 D.表现氧化性
4.当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物。则这种空气中常见的氧化剂是( )
A.N2 B.O2 C.H2O D.CO2
5.在下列反应中,CO2作氧化剂的是( )
A.Ca(OH)2+CO2===CaCO3↓+H2O
B.CO2+C2CO
C.2Fe2O3+3C4Fe+3CO2↑
D.C+2H2O(g)2H2+CO2
6.下列变化过程一定需要加入还原剂的是( )
A.KClO3―→KCl B.KCl―→AgCl
C.H+―→H2 D.C―→CO2
7.下列微粒中,只有氧化性的是( )
①S2- ②S ③H+ ④Na+ ⑤Mg
A.①⑤ B.②④ C.③④ D.②⑤
8.根据离子方程式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+。可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
9.在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是 ________,实例: __________________________________ 。
(2)只能做还原剂的是:________,实例: ________________________________ 。
(3)H2O作为氧化剂的反应实例: __________________________________ 。
[能力提升练]
10.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.2F2+2H2O===4HF+O2
C.Cl2+H2O===HCl+HClO
D.2Na+2H2O===2NaOH+H2↑
11.下列氧化还原反应中电子转移数目及方向都正确的是( )
12.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是该反应的产物之一。
(1)从硫和氮元素的价态看,只有氧化性的物质是 ____________ ,只有还原性的物质是 __________ ,既有氧化性又有还原性的物质是 __________ 。
(2)该反应中还原剂是 ____________ ,氧化剂是 ____________ 。
(3)氧化性:HNO3________S(填“>”或“<”)。
【答案解析】
1.3 第2课时 氧化剂和还原剂
探究一 氧化剂与还原剂
1.氧化剂与还原剂
(1)氧化剂:在氧化还原反应中,所含元素的化合价 降低 ,即 得到 电子(或电子对 偏向 )的物质。
(2)还原剂:在氧化还原反应中,所含元素的化合价 升高 ,即 失去 电子(或电子对 偏离 )的物质。
2.氧化产物与还原产物
(1)氧化产物:还原剂被 氧化 生成的物质。
(2)还原产物:氧化剂被 还原 生成的物质。
[问题探究]
[探究1] 用单线桥法标出下列反应电子转移的方向及数目。
(1)WO3+3H2W+3H2O
(2)MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
(3)2H2S+SO2===3S↓+2H2O
[提示] (1)
(2)
(3)
[探究2] 用图示法表示氧化还原反应中相关概念之间的联系。
[提示]
[或(1)还原剂→化合价升高→失去电子→发生氧化反应(被氧化)→生成氧化产物。
(2)氧化剂化→合价降低→得到电子→发生还原反应(被还原)→生成还原产物。]
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
表示电子转移方向及数目的方法——单线桥法
1.单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2.注意事项
(1)不需要标明“得到”或“失去”,只标明电子转移数目;
(2)要用箭头标明电子转移的方向;
(3)箭头由反应物中失电子元素原子指向反应物中得电子元素原子。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
分析下列反应并按要求填空。
(1)2Fe+3Cl22FeCl3
氧化剂是________,还原剂是________;发生氧化反应的是________,发生还原反应的是________。
(2)2KMnO4K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是________,被还原的元素是________。
(3)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是________;氧化产物是________,还原产物是 ______ 。
[答案] (1)Cl2 Fe Fe Cl2
(2)KMnO4 KMnO4 O Mn
(3)H2O2 Fe2+ Fe3+ H2O
探究二 常见氧化剂与还原剂
1.常见的氧化剂
(1)活泼性较强的非金属单质:如 Cl2 、O2等。
(2)变价元素的高价态化合物:如 KMnO4 、 FeCl3 、 HNO3 等。
(3)过氧化物:如Na2O2、H2O2等。
(4)其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
2.常见的还原剂
(1)活泼性较强的金属单质:如Al、Fe、Zn等。
(2)某些非金属单质:如 H2 、 S 、 C 等。
(3)含有较低价态元素的化合物:如KI、CO、SO2等。
(4)其他:如浓盐酸、NH3等。
3.氧化性与还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
[问题探究]
[探究1] 探究物质的氧化性、还原性与元素化合价的关系
下列微粒:①S2- ②SO2 ③浓H2SO4,从硫元素的角度分析,只有还原性的是 ______ (填序号,下同),只有氧化性的是 ______ ,既有氧化性又有还原性的是 ______ 。
[提示] ① ③ ②
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
元素处于最高价只有氧化性,元素处于最低价只有还原性,元素处于中间价态既有氧化性又有还原性。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[探究2] 比较氧化性、还原性的强弱
1.已知下列反应:①2Fe+3Cl22FeCl3、②Fe+SFeS。可判断氧化性:氯气________硫。
[提示] >
2.常温下,发生下列反应:①16H++10Cl-+2MnO===2Mn2++5Cl2↑+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 ______________ ,还原性由强到弱的顺序是 ______________ 。
[提示] MnO>Cl2>Br2>Fe3+ Fe2+>Br->Cl->Mn2+
3.已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ________ (填代码)。
①2W-+Z2===2Z-+W2
②2X-+Z2===2Z-+X2
③2Y-+W2===2W-+Y2
④2Z-+X2===2X-+Z2
[提示] ②③
INCLUDEPICTURE "反思归纳.TIF" INCLUDEPICTURE "反思归纳.TIF" \* MERGEFORMAT
根据氧化还原反应方程式比较氧化性、还原性强弱
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
INCLUDEPICTURE "下点线.TIF" INCLUDEPICTURE "下点线.TIF" \* MERGEFORMAT
[迁移应用]
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此推断下列说法错误的是( )
A.反应Z2+2A2+===2A3++2Z-可以进行
B.Z元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是XO、Z2、B2、A3+
D.还原性由强到弱的顺序是Z-、B-、A2+、X2+
D [由反应①可知氧化性:XO>Z2、还原性Z->X2+;由反应②可知氧化性B2>A3+、还原性A2+>B-;由反应③可知氧化性Z2>B2、还原性B->Z-。所以有氧化性XO>Z2>B2>A3+;还原性A2+>B->Z->X2+。A.根据分析可知氧化性Z2>A3+,所以Z2可以氧化A2+,故A正确;B.反应③中Z元素化合价由0价变为-1价被还原;反应①中Z元素化合价由-1价变为0价被氧化,故B正确;C.根据分析可知氧化性由强到弱为XO>Z2>B2>A3+,故C正确;D.根据分析可知还原性由强到弱为A2+>B->Z->X2+,故D错误。]
[课堂小结]
课时作业
[基础巩固练]
1.“绿色化学”越来越受到人们的重视,下列物质可以看作绿色氧化剂的是( )
A.浓硫酸 B.浓盐酸 C.双氧水 D.氯水
C [双氧水还原后的产物为水,对环境没有污染。]
2.反应SiO2+2CSi+2CO↑中,还原产物是( )
A.SiO2 B.C C.Si D.CO
[答案] C
3.某国外化学教材中有一张关于氧化还原反应的插图,由图可知,在该反应中( )
A.作还原剂 B.作氧化剂
C.发生还原反应 D.表现氧化性
[答案] A
4.当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物。则这种空气中常见的氧化剂是( )
A.N2 B.O2 C.H2O D.CO2
[答案] B
5.在下列反应中,CO2作氧化剂的是( )
A.Ca(OH)2+CO2===CaCO3↓+H2O
B.CO2+C2CO
C.2Fe2O3+3C4Fe+3CO2↑
D.C+2H2O(g)2H2+CO2
B [选项A中CO2中碳元素化合价无变化;选项B中CO2中碳元素化合价由+4降低为+2,作氧化剂;选项C、D中CO2都为氧化产物。]
6.下列变化过程一定需要加入还原剂的是( )
A.KClO3―→KCl B.KCl―→AgCl
C.H+―→H2 D.C―→CO2
C [变化过程一定需要加入还原剂,这说明该微粒作氧化剂,得到电子,相关元素的化合价一定降低。但A项可发生2KClO32KCl+3O2↑,无需加入还原剂,故A错。]
7.下列微粒中,只有氧化性的是( )
①S2- ②S ③H+ ④Na+ ⑤Mg
A.①⑤ B.②④ C.③④ D.②⑤
C [元素的化合价位于最高价态时,只具有氧化性,五种微粒中只有H+、Na+是对应元素的最高价态,因此只具有氧化性。]
8.根据离子方程式:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Br-+2Fe3+。可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
B [根据同一氧化还原反应中,还原性:还原剂>还原产物进行判断。①中,还原性:I->Fe2+,②中,还原性:Fe2+>Br-。]
9.在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是 ________,实例: __________________________________ 。
(2)只能做还原剂的是:________,实例: ________________________________ 。
(3)H2O作为氧化剂的反应实例: __________________________________ 。
[解析] 所含元素处于最高价的只能做氧化剂(Cu2+),所含元素处于最低价的只能做还原剂(Mg)。
[答案] (1)Cu2+ Mg+CuCl2===MgCl2+Cu
(2)Mg Mg+2HCl===MgCl2+H2↑
(3)C+H2O(g)CO+H2(答案合理即可)
[能力提升练]
10.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.2F2+2H2O===4HF+O2
C.Cl2+H2O===HCl+HClO
D.2Na+2H2O===2NaOH+H2↑
C [各元素的化合价均没有发生变化,不属于氧化还原反应,A错误;水中O元素的化合价升高,水作还原剂,B错误;Cl2中Cl元素的化合价发生变化,属于氧化还原反应,但水中H、O元素的化合价均不变,故水既不作氧化剂又不作还原剂,C正确;水中H元素的化合价降低,水作氧化剂,D错误。]
11.下列氧化还原反应中电子转移数目及方向都正确的是( )
B [A.Cl元素得到电子,O元素失去电子,该反应转移12e-,图中转移电子数目不正确,错误;B.Fe元素得到电子,I元素失去电子,该反应转移2e-,正确;C.F元素得到电子,O元素失去电子,该反应转移4e-,图中箭头的方向标反了,错误;D.Br元素得到电子,S元素失去电子,该反应转移2e-,图中箭头的方向标反了,错误。]
12.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是该反应的产物之一。
(1)从硫和氮元素的价态看,只有氧化性的物质是 ____________ ,只有还原性的物质是 __________ ,既有氧化性又有还原性的物质是 __________ 。
(2)该反应中还原剂是 ____________ ,氧化剂是 ____________ 。
(3)氧化性:HNO3________S(填“>”或“<”)。
[解析] 水是生成物之一,说明反应物中肯定含有氢、氧元素,含有氢元素的有H2S和HNO3,含有氧元素的有HNO3和NO;观察五种物质,含硫元素的有S和H2S,含氮元素的有HNO3和NO。根据氧化还原反应的特点,如果S是反应物,则H2S是生成物,此时S得电子,N只能失电子,即NO是反应物,两种反应物中均没有氢元素,所以S和NO不可能是反应物;由以上分析可知,反应物只能是H2S和HNO3,生成物只能是S、NO和H2O。
[答案] (1)HNO3 H2S NO、S
(2)H2S HNO3
(3)>
