湖北省武汉市华中师范大学第一附属中学2023-2024学年高一下学期7月期末考试化学试题 (含答案)
文档属性
| 名称 | 湖北省武汉市华中师范大学第一附属中学2023-2024学年高一下学期7月期末考试化学试题 (含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-13 19:18:00 | ||
图片预览



文档简介
华中师大一附中2023-2024学年度下学期期末检测
高一年级化学试题
满分:100分,考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 Cl-35.5 Fe-56 Cu-64 Au-197 Hg-200
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列说法正确的有
①在同一能级上运动的电子,其能量可能不同
②量子力学把电子在原子核外的一个运动状态称为一个原子轨道
③前四周期元素的基态原子中只有有4个未成对电子
④元素周期系和元素周期表多种多样
⑤元素周期表的每一个区都有金属元素
⑥第族元素氟、氯、溴、碘因都能成盐而总称卤素
⑦分子空间结构与其稳定性无关
⑧利用质谱仪,可测定出甲酸的相对分子质量为
⑨缺角的氯化钠晶体在饱和溶液中可变为完美的立方体块
⑩液晶具有各向异性,可以用于制备液晶显示器
A. 4项 B. 5项 C. 6项 D. 7项
2. 化学用语可以表达变化过程。下列化学用语表达正确的是
A. 用电子式表示的形成:
B. 用化学方程式表示过量通入溶液时的反应:
C. 用轨道表示式表示铜的价电子由激发态跃迁回基态的过程:
D. 用电子云轮廓图示意中键的形成:
3. 设阿伏加德罗常数的值为。下列说法正确的是
A. 晶体中,十二元环上氧原子数目平均为
B. 与溶液反应时每生成还原产物,转移电子数目为
C. 标准状况下,与充分反应,生成的分子数目为
D. 笼状分子()中,σ键数目为
4. 我国科学家在青蒿素(结构如图)研究方面为人类健康作出了巨大贡献。下列说法错误的是
A. 用沸水浸泡青蒿可获得青蒿素的提取液
B. 通过红外光谱可分析青蒿素分子中的化学键信息
C. 通过射线衍射可测定青蒿素晶体中各个原子的坐标
D. 青蒿素分子中含有7个手性碳原子
5. 硫、氮和硅及其化合物的转化具有重要应用。下列说法正确的是
A. 工业制硫酸过程中的物质转化:
B. 工业制硝酸过程中的物质转化:
C. 侯氏制碱过程中的物质转化:
D. 工业制高纯硅过程中的物质转化:
6. 结构决定性质,性质决定用途。下列事实解释错误的是
事实 解释
A 液氨可用作制冷剂 中键能大,断裂吸收大量热量
B 表面活性剂可以降低水的表面张力 表面活性剂在水面形单分子膜,破坏了水分子间的氢键
C 在水中的溶解度: 离子之间存在氢键,更难与水分子形成氢键
D 常压下,石墨比金刚石更稳定 石墨中键长更短,键能更大
A. A B. B C. C D. D
7. 如图所示,扫描隧道显微镜可利用碳纳米管探测器上的有机分子探针,检出金刚石表面排列的原子中存储的信息。下列说法错误的是
A. 碳纳米管和金刚石互同素异形体
B. 碳纳米管和金刚石的晶体均属于共价晶体
C. 碳纳米管是新型无机非金属材料,强度高,电学性能优良
D. 扫描隧道显微镜可以观察和定位单个原子,测定分子结构
8. 是原子序数依次增大的短周期主族元素,其中的电子只有一种自旋取向,第一电离能介于与之间的同周期元素有4种,是氧化性最强的单质,是地壳中含量第二的元素。下列说法错误的是
A. 共价键极性:,键能:
B. 在常温下与反应生成两种气体
C. 原子半径和电负性均依次减小
D. 、的单质晶体中熔点最高的为的单质
9. 氨基酸的结构简式可表示为(为原子或原子团,甘氨酸中代表氢原子),常以内盐的形式存在,且有如下反应。
下列说法正确的是
A. 氨基酸均含有手性碳
B. 氨基酸易溶于有机溶剂
C. 氨基酸既能和酸反应又能和碱反应
D. 的比的大
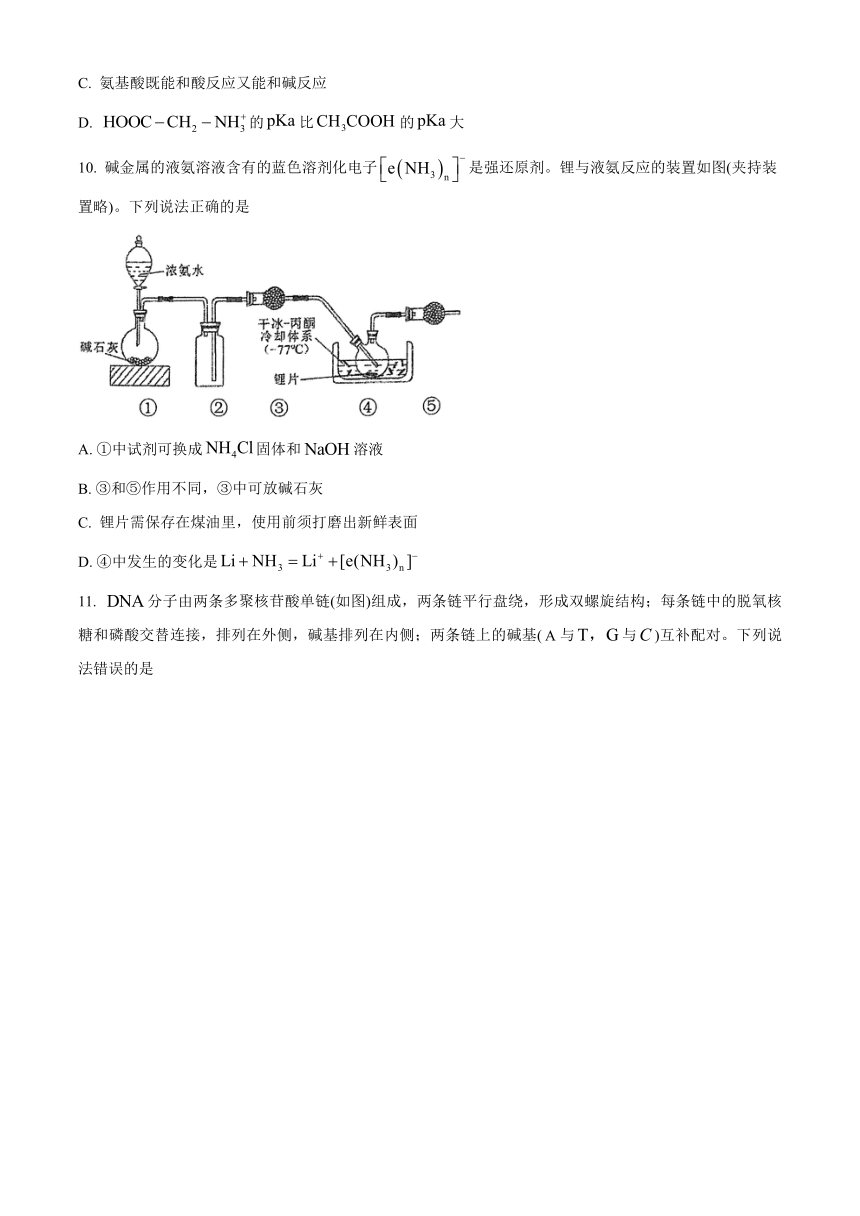
10. 碱金属的液氨溶液含有的蓝色溶剂化电子是强还原剂。锂与液氨反应的装置如图(夹持装置略)。下列说法正确的是
A. ①中试剂可换成固体和溶液
B. ③和⑤作用不同,③中可放碱石灰
C. 锂片需保存在煤油里,使用前须打磨出新鲜表面
D. ④中发生的变化是
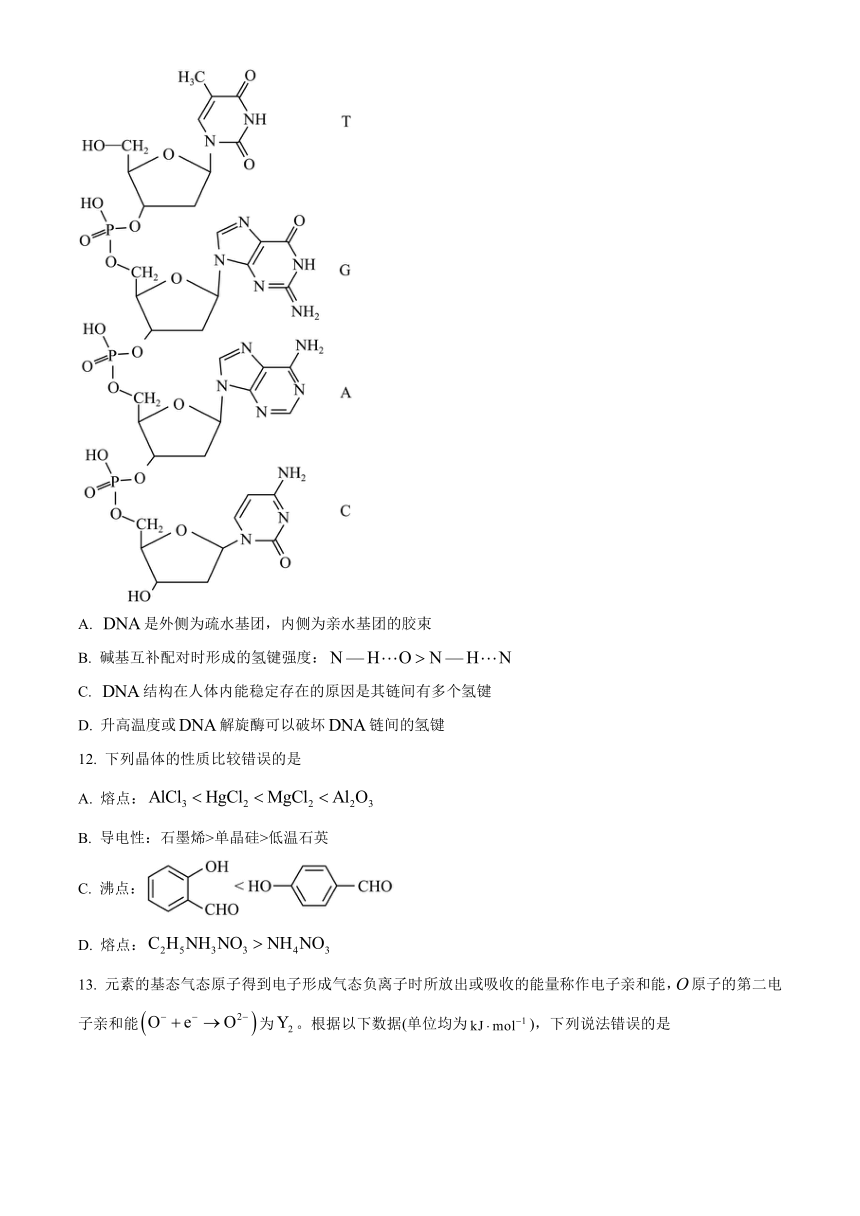
11. 分子由两条多聚核苷酸单链(如图)组成,两条链平行盘绕,形成双螺旋结构;每条链中的脱氧核糖和磷酸交替连接,排列在外侧,碱基排列在内侧;两条链上的碱基(与与)互补配对。下列说法错误的是
A. 是外侧为疏水基团,内侧为亲水基团的胶束
B. 碱基互补配对时形成的氢键强度:
C. 结构在人体内能稳定存在的原因是其链间有多个氢键
D. 升高温度或解旋酶可以破坏链间的氢键
12. 下列晶体的性质比较错误的是
A. 熔点:
B. 导电性:石墨烯>单晶硅>低温石英
C. 沸点:
D. 熔点:
13. 元素的基态气态原子得到电子形成气态负离子时所放出或吸收的能量称作电子亲和能,原子的第二电子亲和能为。根据以下数据(单位均为),下列说法错误的是
A. 的第三电离能远远大于 B. 的第一电离能小于
C. 的键能为 D.
14. 某化合物可用于制备高性能防腐蚀涂料,其结构如图所示。是原子序数依次增大的短周期元素,且占据三个不同周期,与的质子数之和是的2倍。下列说法错误的是
A. 简单离子半径:
B. 简单氢化物的稳定性和沸点:
C. 与可以形成含非极性共价键的非极性分子
D. 氧化物的化学键中离子键的百分数:的氧化物是分子晶体
15. 某碳酸盐是抗酸药的主要成分,其摩尔质量为,晶胞结构和晶胞参数如图所示。下列说法错误的是
A. 离子构型为平面三角形,在晶胞中有2种不同的取向
B. ①、②号与③号离子之间的距离相等
C. 该碳酸盐的化学式为不可能为
D. 该晶体的密度为
二、非选择题:本题共4小题,共55分。
16. 以磁铁矿(主要含有,含少量等杂质)为原料制备优良的吸附剂水合氧化铁的工艺流程如下。
回答下列问题:
(1)的电子式为___________,其离子间的氢键可表示为___________。
(2)“滤液1”的主要溶质为___________。
(3)“沉铁”时发生反应的离子方程式为___________。
(4)以含铁的磁铁矿为原料生产水合氧化铁,“还原”时消耗“试剂”,“沉铁”时损耗铁元素,则可生产纯度为的水合氧化铁___________(保留一位小数)。
(5)铁有两种晶体结构,其晶胞如图所示。A、B两种晶胞中的配位数之比为___________,B晶胞中正四面体空隙和正八面体空隙个数之比为___________。
17. 氮是构建化合物的常见元素,可以形成从到各价态的化合物。回答下列问题:
(1)下列关于和的说法正确的为___________。
A. 具有氧化性,还原性和配位能力 B. 键角:
C. 中的杂化方式为杂化 D. 的结构与的结构类似
(2)已知和中都存在中心电子的大键可用表示),且杂化轨道中成分越多,形成的键越长。结合信息分析,和中键长较短的是___________,其原因为___________。
(3)和有相同的价电子数,但实验测得两者的分子构型(忽略原子)分别为三角锥形和平面三角形。和中心原子的杂化方式分别为___________。两者分子结构不同的原因之一是某一分子可形成大键。已知轨道也可参与形成键,以表示出的相关大键:___________。另一原因与电负性有关,和的电负性由小到大的顺序是___________,中的价态为___________。
18. 臭氧是一种重要物质,在工业废水的处理中有广泛应用,是优良的污水净化剂、脱色剂和消毒剂。回答下列问题:
(1)中含有___________。
①极性键 ②非极性键 ③键 ④键 ⑤离子键 ⑥配位键 ⑦双键
(2)的分子具有极性,但极性微弱。请从分子的空间结构和中心原子上的孤电子对角度解释:___________。
(3)以下溶解度由大到小的顺序为___________。
A.在水中的溶解度 B.在水中的溶解度 C.在中的溶解度
(4)的氧化性比强。和的混合气体中浓度可用碘量法测定。将混合气体通入碱性溶液中,生成碘和另一种单质,该反应的离子反应方程式为___________。生成的碘再用溶液滴定,发生反应。从物质结构和性质分析,的结构应为___________(填序号)。
(5)的分子或离子构型均为___________。中键角比中键角___________(填“大”或“小”),其原因为___________。
19. 两种金属混合熔化成液体可形成互溶体系,冷却后可形成固态合金。如和互溶体冷却后可形成合金,其可能结构如图所示,乙和丙为立方晶胞。
(1)和原子结构和单质的晶体结构均相似,请结合元素周期表解释:___________。的简化电子排布式为___________。
(2)当互溶体被淬火处理后可形成甲,被退火处理后可形成乙和丙。淬火和退火的区别为___________。
(3)乙中与最邻近的个数为___________。丙的化学式为___________。
(4)黄金按质量分数分级,纯金为,则乙为___________(取整数)。
(5)设阿伏加德罗常数的值为,丙的晶胞参数为,则丙的摩尔体积___________(列出算式)。
参考答案
1. C。
2. C。
3. D。
4. A。
5. D。
6. A。
7. B。
8. C。
9. C。
10B
11. A。
12. D。
13. D。
14. C。
15. C。
16. (1)①. ②. N-H···F
(2)Na[Al(OH)4]和Na2SiO3
(3) (4)1271t
(5)①. 2:3 ②. 2:1
17. (1)ABD
(2)①. ②. 为sp杂化,为sp2杂化,故中键长较短
(3)①. sp3、sp2 ②. ③. Si、H、C、N ④. +4
18. (1)①③④
(2)臭氧中存在一个三中心、四电子的大π键,中间氧原子的电子云向两侧偏移,致使中心氧原子相对显正电性,两边氧原子相对显负电性。而且臭氧分子为V形结构,所以臭氧分子有偶极矩而显极性
(3)B>C>A
(4)①. O3+2I-+H2O=I2+2OH-+O2 ②. a
(5)①. V形 ②. 大 ③. 的中心原子S上有两个孤电子对,SO2的中心原子S上只有一个孤电子对,孤电子对间的排斥力大
19. (1)①. Cu和Au在周期表中处于同一族,价层电子排布相似,Cu为3d104s1,Au为5d106s1,结构决定性质 ②. [Xe]5d106s1
(2)淬火是将Cu—Au互溶体加热到临界点以上某一温度,保持一定的时间,然后以适当速度在淬冷介质中快速冷却,淬火后合金变硬,但同时变脆,经淬火后获得的组织不平衡,它的硬度高,但塑性、韧性差。退火是将工件加热到适当温度,根据材料和工件尺寸采用不同的保温时间,然后缓慢冷却到室温,目的是使金属内部组织达到或衡状态,获得良好的工艺性能和使用性能
(3)①. 4 ②. AuCu
(4)12 (5)5NAa3×10-37
高一年级化学试题
满分:100分,考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 Cl-35.5 Fe-56 Cu-64 Au-197 Hg-200
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列说法正确的有
①在同一能级上运动的电子,其能量可能不同
②量子力学把电子在原子核外的一个运动状态称为一个原子轨道
③前四周期元素的基态原子中只有有4个未成对电子
④元素周期系和元素周期表多种多样
⑤元素周期表的每一个区都有金属元素
⑥第族元素氟、氯、溴、碘因都能成盐而总称卤素
⑦分子空间结构与其稳定性无关
⑧利用质谱仪,可测定出甲酸的相对分子质量为
⑨缺角的氯化钠晶体在饱和溶液中可变为完美的立方体块
⑩液晶具有各向异性,可以用于制备液晶显示器
A. 4项 B. 5项 C. 6项 D. 7项
2. 化学用语可以表达变化过程。下列化学用语表达正确的是
A. 用电子式表示的形成:
B. 用化学方程式表示过量通入溶液时的反应:
C. 用轨道表示式表示铜的价电子由激发态跃迁回基态的过程:
D. 用电子云轮廓图示意中键的形成:
3. 设阿伏加德罗常数的值为。下列说法正确的是
A. 晶体中,十二元环上氧原子数目平均为
B. 与溶液反应时每生成还原产物,转移电子数目为
C. 标准状况下,与充分反应,生成的分子数目为
D. 笼状分子()中,σ键数目为
4. 我国科学家在青蒿素(结构如图)研究方面为人类健康作出了巨大贡献。下列说法错误的是
A. 用沸水浸泡青蒿可获得青蒿素的提取液
B. 通过红外光谱可分析青蒿素分子中的化学键信息
C. 通过射线衍射可测定青蒿素晶体中各个原子的坐标
D. 青蒿素分子中含有7个手性碳原子
5. 硫、氮和硅及其化合物的转化具有重要应用。下列说法正确的是
A. 工业制硫酸过程中的物质转化:
B. 工业制硝酸过程中的物质转化:
C. 侯氏制碱过程中的物质转化:
D. 工业制高纯硅过程中的物质转化:
6. 结构决定性质,性质决定用途。下列事实解释错误的是
事实 解释
A 液氨可用作制冷剂 中键能大,断裂吸收大量热量
B 表面活性剂可以降低水的表面张力 表面活性剂在水面形单分子膜,破坏了水分子间的氢键
C 在水中的溶解度: 离子之间存在氢键,更难与水分子形成氢键
D 常压下,石墨比金刚石更稳定 石墨中键长更短,键能更大
A. A B. B C. C D. D
7. 如图所示,扫描隧道显微镜可利用碳纳米管探测器上的有机分子探针,检出金刚石表面排列的原子中存储的信息。下列说法错误的是
A. 碳纳米管和金刚石互同素异形体
B. 碳纳米管和金刚石的晶体均属于共价晶体
C. 碳纳米管是新型无机非金属材料,强度高,电学性能优良
D. 扫描隧道显微镜可以观察和定位单个原子,测定分子结构
8. 是原子序数依次增大的短周期主族元素,其中的电子只有一种自旋取向,第一电离能介于与之间的同周期元素有4种,是氧化性最强的单质,是地壳中含量第二的元素。下列说法错误的是
A. 共价键极性:,键能:
B. 在常温下与反应生成两种气体
C. 原子半径和电负性均依次减小
D. 、的单质晶体中熔点最高的为的单质
9. 氨基酸的结构简式可表示为(为原子或原子团,甘氨酸中代表氢原子),常以内盐的形式存在,且有如下反应。
下列说法正确的是
A. 氨基酸均含有手性碳
B. 氨基酸易溶于有机溶剂
C. 氨基酸既能和酸反应又能和碱反应
D. 的比的大
10. 碱金属的液氨溶液含有的蓝色溶剂化电子是强还原剂。锂与液氨反应的装置如图(夹持装置略)。下列说法正确的是
A. ①中试剂可换成固体和溶液
B. ③和⑤作用不同,③中可放碱石灰
C. 锂片需保存在煤油里,使用前须打磨出新鲜表面
D. ④中发生的变化是
11. 分子由两条多聚核苷酸单链(如图)组成,两条链平行盘绕,形成双螺旋结构;每条链中的脱氧核糖和磷酸交替连接,排列在外侧,碱基排列在内侧;两条链上的碱基(与与)互补配对。下列说法错误的是
A. 是外侧为疏水基团,内侧为亲水基团的胶束
B. 碱基互补配对时形成的氢键强度:
C. 结构在人体内能稳定存在的原因是其链间有多个氢键
D. 升高温度或解旋酶可以破坏链间的氢键
12. 下列晶体的性质比较错误的是
A. 熔点:
B. 导电性:石墨烯>单晶硅>低温石英
C. 沸点:
D. 熔点:
13. 元素的基态气态原子得到电子形成气态负离子时所放出或吸收的能量称作电子亲和能,原子的第二电子亲和能为。根据以下数据(单位均为),下列说法错误的是
A. 的第三电离能远远大于 B. 的第一电离能小于
C. 的键能为 D.
14. 某化合物可用于制备高性能防腐蚀涂料,其结构如图所示。是原子序数依次增大的短周期元素,且占据三个不同周期,与的质子数之和是的2倍。下列说法错误的是
A. 简单离子半径:
B. 简单氢化物的稳定性和沸点:
C. 与可以形成含非极性共价键的非极性分子
D. 氧化物的化学键中离子键的百分数:的氧化物是分子晶体
15. 某碳酸盐是抗酸药的主要成分,其摩尔质量为,晶胞结构和晶胞参数如图所示。下列说法错误的是
A. 离子构型为平面三角形,在晶胞中有2种不同的取向
B. ①、②号与③号离子之间的距离相等
C. 该碳酸盐的化学式为不可能为
D. 该晶体的密度为
二、非选择题:本题共4小题,共55分。
16. 以磁铁矿(主要含有,含少量等杂质)为原料制备优良的吸附剂水合氧化铁的工艺流程如下。
回答下列问题:
(1)的电子式为___________,其离子间的氢键可表示为___________。
(2)“滤液1”的主要溶质为___________。
(3)“沉铁”时发生反应的离子方程式为___________。
(4)以含铁的磁铁矿为原料生产水合氧化铁,“还原”时消耗“试剂”,“沉铁”时损耗铁元素,则可生产纯度为的水合氧化铁___________(保留一位小数)。
(5)铁有两种晶体结构,其晶胞如图所示。A、B两种晶胞中的配位数之比为___________,B晶胞中正四面体空隙和正八面体空隙个数之比为___________。
17. 氮是构建化合物的常见元素,可以形成从到各价态的化合物。回答下列问题:
(1)下列关于和的说法正确的为___________。
A. 具有氧化性,还原性和配位能力 B. 键角:
C. 中的杂化方式为杂化 D. 的结构与的结构类似
(2)已知和中都存在中心电子的大键可用表示),且杂化轨道中成分越多,形成的键越长。结合信息分析,和中键长较短的是___________,其原因为___________。
(3)和有相同的价电子数,但实验测得两者的分子构型(忽略原子)分别为三角锥形和平面三角形。和中心原子的杂化方式分别为___________。两者分子结构不同的原因之一是某一分子可形成大键。已知轨道也可参与形成键,以表示出的相关大键:___________。另一原因与电负性有关,和的电负性由小到大的顺序是___________,中的价态为___________。
18. 臭氧是一种重要物质,在工业废水的处理中有广泛应用,是优良的污水净化剂、脱色剂和消毒剂。回答下列问题:
(1)中含有___________。
①极性键 ②非极性键 ③键 ④键 ⑤离子键 ⑥配位键 ⑦双键
(2)的分子具有极性,但极性微弱。请从分子的空间结构和中心原子上的孤电子对角度解释:___________。
(3)以下溶解度由大到小的顺序为___________。
A.在水中的溶解度 B.在水中的溶解度 C.在中的溶解度
(4)的氧化性比强。和的混合气体中浓度可用碘量法测定。将混合气体通入碱性溶液中,生成碘和另一种单质,该反应的离子反应方程式为___________。生成的碘再用溶液滴定,发生反应。从物质结构和性质分析,的结构应为___________(填序号)。
(5)的分子或离子构型均为___________。中键角比中键角___________(填“大”或“小”),其原因为___________。
19. 两种金属混合熔化成液体可形成互溶体系,冷却后可形成固态合金。如和互溶体冷却后可形成合金,其可能结构如图所示,乙和丙为立方晶胞。
(1)和原子结构和单质的晶体结构均相似,请结合元素周期表解释:___________。的简化电子排布式为___________。
(2)当互溶体被淬火处理后可形成甲,被退火处理后可形成乙和丙。淬火和退火的区别为___________。
(3)乙中与最邻近的个数为___________。丙的化学式为___________。
(4)黄金按质量分数分级,纯金为,则乙为___________(取整数)。
(5)设阿伏加德罗常数的值为,丙的晶胞参数为,则丙的摩尔体积___________(列出算式)。
参考答案
1. C。
2. C。
3. D。
4. A。
5. D。
6. A。
7. B。
8. C。
9. C。
10B
11. A。
12. D。
13. D。
14. C。
15. C。
16. (1)①. ②. N-H···F
(2)Na[Al(OH)4]和Na2SiO3
(3) (4)1271t
(5)①. 2:3 ②. 2:1
17. (1)ABD
(2)①. ②. 为sp杂化,为sp2杂化,故中键长较短
(3)①. sp3、sp2 ②. ③. Si、H、C、N ④. +4
18. (1)①③④
(2)臭氧中存在一个三中心、四电子的大π键,中间氧原子的电子云向两侧偏移,致使中心氧原子相对显正电性,两边氧原子相对显负电性。而且臭氧分子为V形结构,所以臭氧分子有偶极矩而显极性
(3)B>C>A
(4)①. O3+2I-+H2O=I2+2OH-+O2 ②. a
(5)①. V形 ②. 大 ③. 的中心原子S上有两个孤电子对,SO2的中心原子S上只有一个孤电子对,孤电子对间的排斥力大
19. (1)①. Cu和Au在周期表中处于同一族,价层电子排布相似,Cu为3d104s1,Au为5d106s1,结构决定性质 ②. [Xe]5d106s1
(2)淬火是将Cu—Au互溶体加热到临界点以上某一温度,保持一定的时间,然后以适当速度在淬冷介质中快速冷却,淬火后合金变硬,但同时变脆,经淬火后获得的组织不平衡,它的硬度高,但塑性、韧性差。退火是将工件加热到适当温度,根据材料和工件尺寸采用不同的保温时间,然后缓慢冷却到室温,目的是使金属内部组织达到或衡状态,获得良好的工艺性能和使用性能
(3)①. 4 ②. AuCu
(4)12 (5)5NAa3×10-37
同课章节目录
