3.1.3《铁盐和亚铁盐》教学课件(共18张PPT) 人教版(2019) 必修 第一册
文档属性
| 名称 | 3.1.3《铁盐和亚铁盐》教学课件(共18张PPT) 人教版(2019) 必修 第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-15 12:56:52 | ||
图片预览





文档简介
(共18张PPT)
第三章 第一节 铁及其化合物
第2课时 铁盐和亚铁盐
身边的化学
【知识储备】
1. FeCl2溶液中加入NaOH溶液,观察到的现象为:
FeCl3溶液中加入NaOH溶液,观察到的现象为: 。
2.元素化合价与氧化性、还原性的关系:
元素处于最高价,只有_________;
元素处于最低价,只有_________;
元素处于中间价态,既有_________,又有_________。
3.常见的氧化剂有:___________________________ ;
常见的还原剂有: _________________________ 。
氧化性
还原性
氧化性
还原性
O2、Cl2;浓H2SO4、HNO3;KMnO4、FeCl3
生成白色沉淀,迅速变为灰绿色,最后变为红褐色。
生成红褐色沉淀
Zn、Fe;C、H2;CO、SO2;KI
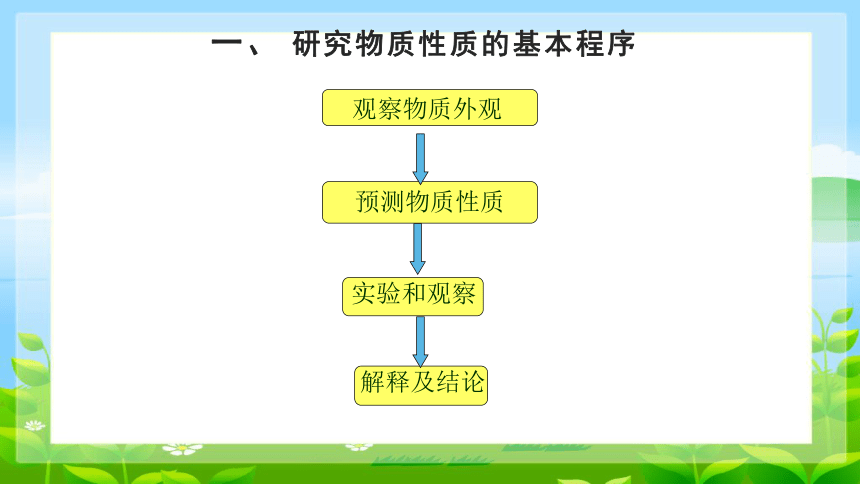
一、 研究物质性质的基本程序
观察物质外观
预测物质性质
实验和观察
解释及结论
1.观察物质外观
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见 物质 FeSO4·7H2O、FeCl2等 FeCl3·6H2O、Fe2(SO4)3等
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
(黄色)
Fe3+
Fe2+
FeSO4溶液
FeCl3溶液
2.预测物质性质 (以FeCl3、FeSO4为例)
①从物质类别角度:
FeCl3和FeSO4都属于盐类,能和碱反应生成 及 。
Fe(OH)3
Fe(OH)2
白色
白色
红褐色
知识回顾
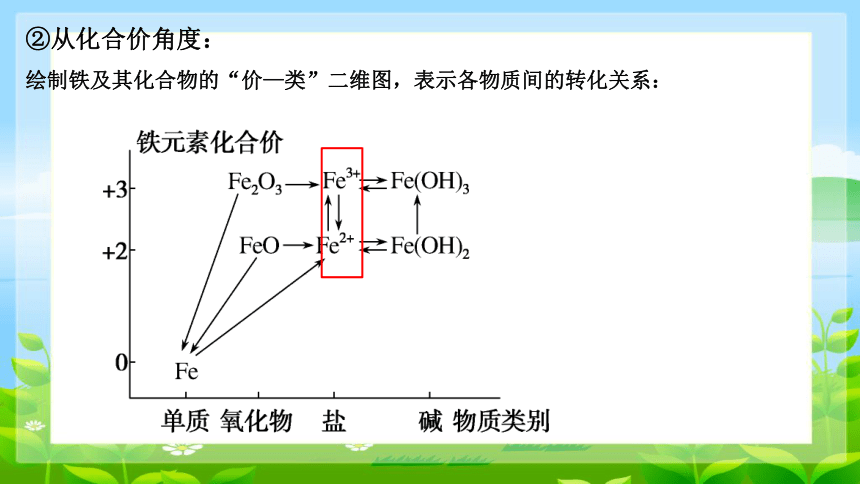
②从化合价角度:
绘制铁及其化合物的“价—类”二维图,表示各物质间的转化关系:
3.实验和观察
【实验3-2】
Fe3+和KSCN(硫氰化钾)溶液反应,
现象:溶液变 。
离子方程式:__________________________。
红色
Fe3++3SCN-===Fe(SCN)3
KSCN
硫氰化钾
3.实验和观察(亚铁盐和铁盐的性质探究)
实验药品:
FeSO4溶液、FeCl3溶液、KSCN溶液、Fe粉、KI溶液、淀粉溶液、
H2O2溶液、新制氯水、酸性KMnO4溶液。
小组讨论,设计实验方案。
Fe3+ Fe2+
氧化剂
→
还原剂
→
4.解释和结论
a.亚铁盐具有还原性,如能被氯气氧化,
离子方程式为:_______________________;
b.铁盐具有氧化性,能被Fe还原,
离子方程式为: _____________________。
2Fe2++Cl2====2Fe3++2Cl-
2Fe3++ Fe====3Fe2+
思考:根据氧化还原反应中“强制弱”的规律,还有哪些物质可以氧化
Fe2+?哪些物质可以还原Fe3+?
1.配制FeCl2溶液时,为什么要加入少量铁屑?
小试身手
防止Fe2+被氧化成Fe3+。
铁屑可将溶液中Fe3+转化成Fe2+,离子方程式为 2Fe3++Fe===3Fe2+。
2.如何通过实验证明铁锈中含有Fe3+?
向试管中加入少量铁锈,加入稀盐酸使其溶解,再滴入几滴KSCN溶液,若溶液变成红色,则说明铁锈中含有Fe3+。
3.向某溶液中滴加氯水后,再滴入几滴KSCN溶液,溶液变成红色,能否说明溶液中含有Fe2+?
不能;若溶液中含有Fe3+而不含Fe2+,会发生相同的现象。
二、Fe2+、Fe3+的检验
(1)直接观察颜色
(2)利用氢氧化物沉淀的颜色(加碱法)
(3)利用显色反应(加KSCN法)
1.证明某溶液中只含有Fe2+而不含有Fe3+的方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.滴加酸性高锰酸钾溶液后,溶液褪色
2.下列试剂中,能使Fe2+转化为Fe3+的是( )
①氯气 ②NaCl溶液 ③KMnO4溶液 ④次氯酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
课堂练习:
作业:
1.结合课本70页实验探究“利用覆铜板制作图案”,查阅资
料,完成【思考与讨论】。
2.认真完成第2课时的课时作业。
谢谢观看 !
第三章 第一节 铁及其化合物
第2课时 铁盐和亚铁盐
身边的化学
【知识储备】
1. FeCl2溶液中加入NaOH溶液,观察到的现象为:
FeCl3溶液中加入NaOH溶液,观察到的现象为: 。
2.元素化合价与氧化性、还原性的关系:
元素处于最高价,只有_________;
元素处于最低价,只有_________;
元素处于中间价态,既有_________,又有_________。
3.常见的氧化剂有:___________________________ ;
常见的还原剂有: _________________________ 。
氧化性
还原性
氧化性
还原性
O2、Cl2;浓H2SO4、HNO3;KMnO4、FeCl3
生成白色沉淀,迅速变为灰绿色,最后变为红褐色。
生成红褐色沉淀
Zn、Fe;C、H2;CO、SO2;KI
一、 研究物质性质的基本程序
观察物质外观
预测物质性质
实验和观察
解释及结论
1.观察物质外观
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见 物质 FeSO4·7H2O、FeCl2等 FeCl3·6H2O、Fe2(SO4)3等
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
(黄色)
Fe3+
Fe2+
FeSO4溶液
FeCl3溶液
2.预测物质性质 (以FeCl3、FeSO4为例)
①从物质类别角度:
FeCl3和FeSO4都属于盐类,能和碱反应生成 及 。
Fe(OH)3
Fe(OH)2
白色
白色
红褐色
知识回顾
②从化合价角度:
绘制铁及其化合物的“价—类”二维图,表示各物质间的转化关系:
3.实验和观察
【实验3-2】
Fe3+和KSCN(硫氰化钾)溶液反应,
现象:溶液变 。
离子方程式:__________________________。
红色
Fe3++3SCN-===Fe(SCN)3
KSCN
硫氰化钾
3.实验和观察(亚铁盐和铁盐的性质探究)
实验药品:
FeSO4溶液、FeCl3溶液、KSCN溶液、Fe粉、KI溶液、淀粉溶液、
H2O2溶液、新制氯水、酸性KMnO4溶液。
小组讨论,设计实验方案。
Fe3+ Fe2+
氧化剂
→
还原剂
→
4.解释和结论
a.亚铁盐具有还原性,如能被氯气氧化,
离子方程式为:_______________________;
b.铁盐具有氧化性,能被Fe还原,
离子方程式为: _____________________。
2Fe2++Cl2====2Fe3++2Cl-
2Fe3++ Fe====3Fe2+
思考:根据氧化还原反应中“强制弱”的规律,还有哪些物质可以氧化
Fe2+?哪些物质可以还原Fe3+?
1.配制FeCl2溶液时,为什么要加入少量铁屑?
小试身手
防止Fe2+被氧化成Fe3+。
铁屑可将溶液中Fe3+转化成Fe2+,离子方程式为 2Fe3++Fe===3Fe2+。
2.如何通过实验证明铁锈中含有Fe3+?
向试管中加入少量铁锈,加入稀盐酸使其溶解,再滴入几滴KSCN溶液,若溶液变成红色,则说明铁锈中含有Fe3+。
3.向某溶液中滴加氯水后,再滴入几滴KSCN溶液,溶液变成红色,能否说明溶液中含有Fe2+?
不能;若溶液中含有Fe3+而不含Fe2+,会发生相同的现象。
二、Fe2+、Fe3+的检验
(1)直接观察颜色
(2)利用氢氧化物沉淀的颜色(加碱法)
(3)利用显色反应(加KSCN法)
1.证明某溶液中只含有Fe2+而不含有Fe3+的方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.只需滴加KSCN溶液
C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D.滴加酸性高锰酸钾溶液后,溶液褪色
2.下列试剂中,能使Fe2+转化为Fe3+的是( )
①氯气 ②NaCl溶液 ③KMnO4溶液 ④次氯酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
课堂练习:
作业:
1.结合课本70页实验探究“利用覆铜板制作图案”,查阅资
料,完成【思考与讨论】。
2.认真完成第2课时的课时作业。
谢谢观看 !
