【同步课堂】2024-2025学年华师大版科学九上 1.2.1化合反应和分解反应(14页ppt)
文档属性
| 名称 | 【同步课堂】2024-2025学年华师大版科学九上 1.2.1化合反应和分解反应(14页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-07-16 09:16:33 | ||
图片预览






文档简介
(共14张PPT)
1.2 化合反应和分解反应
九年级上化学
第一章 化学反应
分类思想在萌发
通过上一课的学习,我们已经知道自然界中各物质之间的相互转化极其复杂,因此发生的化学反应也极其繁多,故而对化学反应进行分类,通过总结一类反应的共同特征来学习个体往往可以达到事半功倍的效果。
观察与发现
写出下列方程式
1 铁丝在氧气中燃烧
2 木炭在空气中燃烧
3 电解水
4 双氧水制取氧气
如果按照反应物和生成物的数目变化情况,将上述反应分成2类,你觉得应该怎么分?
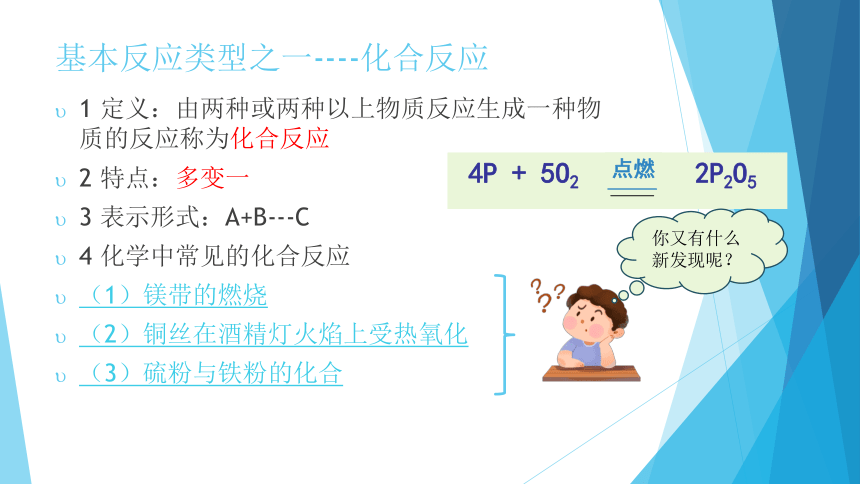
基本反应类型之一----化合反应
1 定义:由两种或两种以上物质反应生成一种物质的反应称为化合反应
2 特点:多变一
3 表示形式:A+B---C
4 化学中常见的化合反应
(1)镁带的燃烧
(2)铜丝在酒精灯火焰上受热氧化
(3)硫粉与铁粉的化合
4P + 5O2 2P2O5
点燃
你又有什么新发现呢?
我会总结
1 化合反应常伴有发光发热的现象
例如 碳在空气中燃烧
2 化合反应一定只是单质和单质的化合吗?
例如
(1)二氧化碳溶于水形成碳酸(H2CO3)
(2)高温下木炭与二氧化碳反应生成一氧化碳
像科学家一样推理
在化合反应中:A+B---C,C的物质类别应该属于哪一类?(化合物?单质?)
如果A和B中有一个是氧气的话,那么就会生成一类化学中典型的物质------________
氧化物
还记得氧化物是怎么定义的吗?
两个要点:
① 只含有两种元素②其中一种元素是氧元素
实践出真知
牛刀小试:找出氧化物
H2O SO3 H2CO3
Fe2O3 Na2CO3 O2
若将上述的氧化物根据元素组成你会分成哪两类?
2 分类:
金属氧化物
非金属氧化物
现学现卖
分一分:将下列的氧化物分类
CuO MgO CO Fe3O4
SO SiO Al O P O5
金属氧化物: ;
金属非氧化物: ;
CuO、 MgO、 Fe3O4 、 Al O
CO 、 SO 、 SiO 、 P O5
基本反应类型之二----分解反应
1 定义:由一种物质反应生成两种或两种以上物质的反应称为分解反应
2 特点:一变多
3 表示形式:A---B+C
4 化学中常见的分解反应
(1)氯酸钾制取氧气
(2)电解水
(3)双氧水制氧气
H2O=====H2 + O2
通电
↑
↑
你又有什么新发现呢?
我会小结
1 分解反应时常需要提供一定的条件
2 分解反应可以生成单质和化合物
例如
氯酸钾制氧气:
2KClO3=====2KCl + 3O2
催化剂
↑
加热
碳酸氢钠分解的探究
思考题:
1 用哪一层火焰加热
2 预热的目的是?
3 如何检验反应生成的气体?
4 实验现象:______
5 为什么试管口要略向下倾斜?
6 实验结束时,应该先熄灭酒精灯还是先移出导管?为什么?
实验现象:
①试管口有水珠出现
②澄清石灰水变浑浊
防止生成的水倒流,使试管受热不均而破裂
观察与发现
1 铁和硫酸铜反应
Fe+CuSO4=FeSO4+Cu
2 锌与盐酸反应
Zn+2HCl===ZnCl2+H2
3 炭还原氧化铜
C+2CuO====CO2+2Cu
这些反应在书写上有什么特点?
加热
这些是化合反应或者分解反应吗?
在书写化学式时元素的位置发生了替换,如果让你命名,你会把这类反应称为什么反应呢?
基本反应类型之三----置换反应
1 定义:由一种单质和一种化合物反应生成新的单质和化合物的反应称为置换反应
2 表示形式:A+BC---AC+B
今天学到了什么?
四大基本反应类型:
1 化合
2 分解
3 置换
1.2 化合反应和分解反应
九年级上化学
第一章 化学反应
分类思想在萌发
通过上一课的学习,我们已经知道自然界中各物质之间的相互转化极其复杂,因此发生的化学反应也极其繁多,故而对化学反应进行分类,通过总结一类反应的共同特征来学习个体往往可以达到事半功倍的效果。
观察与发现
写出下列方程式
1 铁丝在氧气中燃烧
2 木炭在空气中燃烧
3 电解水
4 双氧水制取氧气
如果按照反应物和生成物的数目变化情况,将上述反应分成2类,你觉得应该怎么分?
基本反应类型之一----化合反应
1 定义:由两种或两种以上物质反应生成一种物质的反应称为化合反应
2 特点:多变一
3 表示形式:A+B---C
4 化学中常见的化合反应
(1)镁带的燃烧
(2)铜丝在酒精灯火焰上受热氧化
(3)硫粉与铁粉的化合
4P + 5O2 2P2O5
点燃
你又有什么新发现呢?
我会总结
1 化合反应常伴有发光发热的现象
例如 碳在空气中燃烧
2 化合反应一定只是单质和单质的化合吗?
例如
(1)二氧化碳溶于水形成碳酸(H2CO3)
(2)高温下木炭与二氧化碳反应生成一氧化碳
像科学家一样推理
在化合反应中:A+B---C,C的物质类别应该属于哪一类?(化合物?单质?)
如果A和B中有一个是氧气的话,那么就会生成一类化学中典型的物质------________
氧化物
还记得氧化物是怎么定义的吗?
两个要点:
① 只含有两种元素②其中一种元素是氧元素
实践出真知
牛刀小试:找出氧化物
H2O SO3 H2CO3
Fe2O3 Na2CO3 O2
若将上述的氧化物根据元素组成你会分成哪两类?
2 分类:
金属氧化物
非金属氧化物
现学现卖
分一分:将下列的氧化物分类
CuO MgO CO Fe3O4
SO SiO Al O P O5
金属氧化物: ;
金属非氧化物: ;
CuO、 MgO、 Fe3O4 、 Al O
CO 、 SO 、 SiO 、 P O5
基本反应类型之二----分解反应
1 定义:由一种物质反应生成两种或两种以上物质的反应称为分解反应
2 特点:一变多
3 表示形式:A---B+C
4 化学中常见的分解反应
(1)氯酸钾制取氧气
(2)电解水
(3)双氧水制氧气
H2O=====H2 + O2
通电
↑
↑
你又有什么新发现呢?
我会小结
1 分解反应时常需要提供一定的条件
2 分解反应可以生成单质和化合物
例如
氯酸钾制氧气:
2KClO3=====2KCl + 3O2
催化剂
↑
加热
碳酸氢钠分解的探究
思考题:
1 用哪一层火焰加热
2 预热的目的是?
3 如何检验反应生成的气体?
4 实验现象:______
5 为什么试管口要略向下倾斜?
6 实验结束时,应该先熄灭酒精灯还是先移出导管?为什么?
实验现象:
①试管口有水珠出现
②澄清石灰水变浑浊
防止生成的水倒流,使试管受热不均而破裂
观察与发现
1 铁和硫酸铜反应
Fe+CuSO4=FeSO4+Cu
2 锌与盐酸反应
Zn+2HCl===ZnCl2+H2
3 炭还原氧化铜
C+2CuO====CO2+2Cu
这些反应在书写上有什么特点?
加热
这些是化合反应或者分解反应吗?
在书写化学式时元素的位置发生了替换,如果让你命名,你会把这类反应称为什么反应呢?
基本反应类型之三----置换反应
1 定义:由一种单质和一种化合物反应生成新的单质和化合物的反应称为置换反应
2 表示形式:A+BC---AC+B
今天学到了什么?
四大基本反应类型:
1 化合
2 分解
3 置换
