【同步课堂】2024-2025学年华师大版科学九上 1.3用分解反应制取氧气(22页ppt)
文档属性
| 名称 | 【同步课堂】2024-2025学年华师大版科学九上 1.3用分解反应制取氧气(22页ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-07-16 09:19:58 | ||
图片预览






文档简介
(共22张PPT)
1.3 用分解反应制取氧气
九年级上化学
第一章 化学反应
氧气的用途
氧气对于我们而言有着重要的意义,你能说说在生活和生产中氧气的用途吗?
像科学家一样思考
作用
①可以湿润气体
②可以观察氧气的输出速度
这个装置有什么用呢?
氧气的获得
氧气的用途如此广泛且重要,那么我们有哪些方法可以来获得氧气呢?
植物的光合作用
电解水
分离液化空气
.
.
.
这些方法中哪些适合来制取氧气呢?
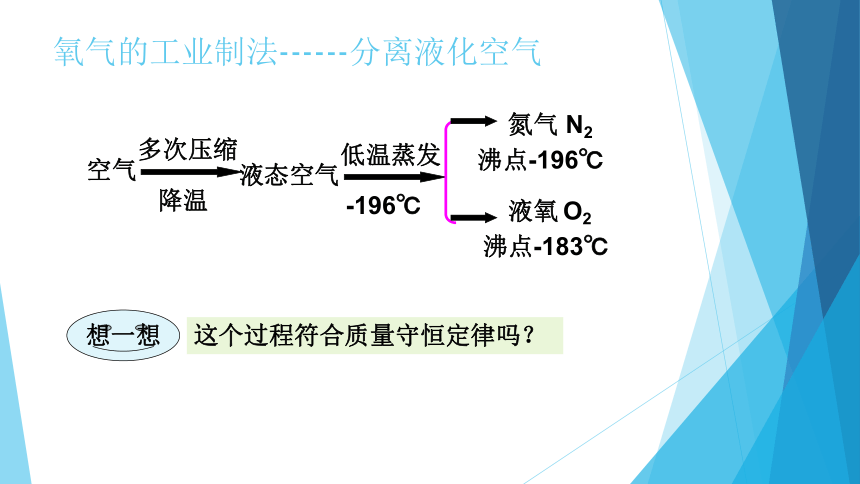
空气
多次压缩
降温
液态空气
低温蒸发
-196℃
沸点-196℃
沸点-183℃
氮气 N2
液氧 O2
想一想
这个过程符合质量守恒定律吗?
氧气的工业制法------分离液化空气
实验室的氧气制取
常见的三种实验室制法:
1 氯酸钾:
2 高锰酸钾:
3 过氧化氢:
你觉得以上三种方法哪种最适合学生操作呢?为什么?
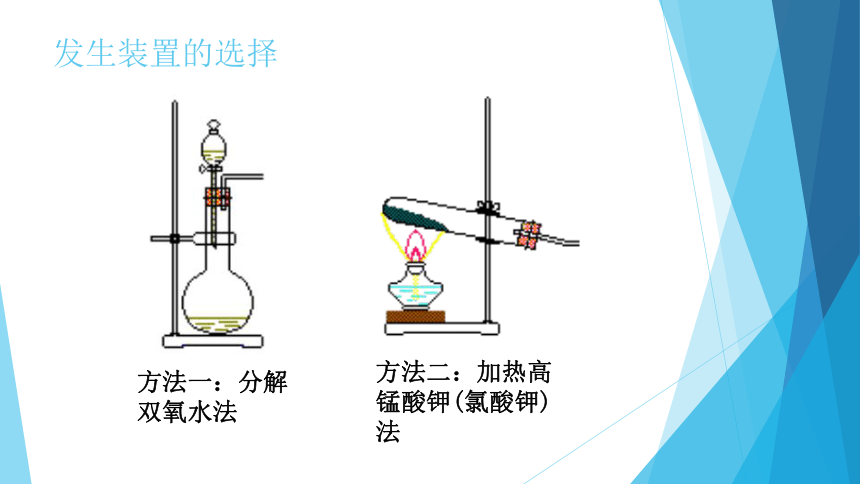
方法二:加热高锰酸钾(氯酸钾)法
方法一:分解双氧水法
发生装置的选择
我会小结
温馨小贴士:发生装置的选择依据:
(1)物质的状态
(2)反应的条件
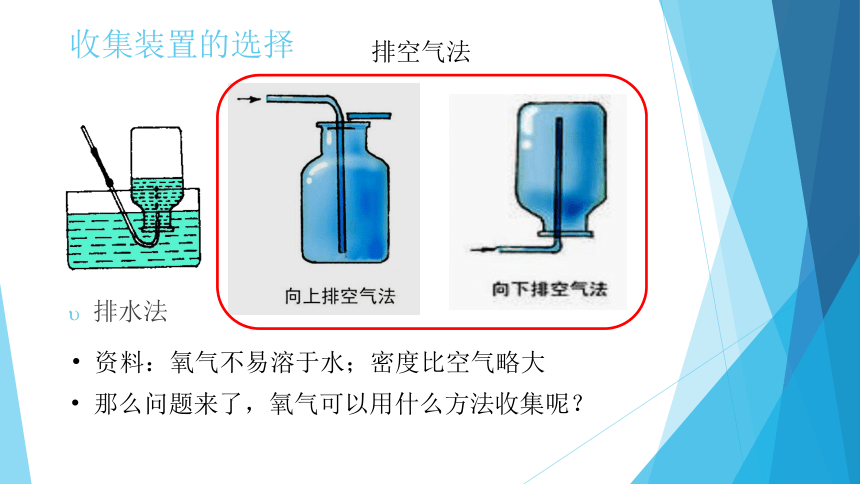
收集装置的选择
资料:氧气不易溶于水;密度比空气略大
排水法
那么问题来了,氧气可以用什么方法收集呢?
排空气法
过 氧 化 氢 溶 液
观察:向三支试管中分别加入过氧化氢,仔细观察是否有气泡产生以及产生的速率,将带火星的木条伸入三支试管的试管口,观察哪个能够复燃。
实验中的新发现
选用药品 产生气体速率 能否使带火星的木条复燃
1 过氧化氢 慢 否
2 过氧化氢和二氧化锰 快 能
3 过氧化氢和猪肝 快 能
实验现象
催化剂
小资料
1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化碳的质量不发生改变
2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
3.收集加二氧化锰与不加二氧化锰产生的氧气,发现质量相同。
二氧化锰加快了过氧化氢的反应速率,本身的质量和化学性质在反应前后不变。
催化剂不影响生成物的产量
我会总结
1 催化剂的作用:改变(加快和减慢)化学反应的反应速率
2 催化剂的特点:其自身的组成、化学性质和质量不会发生改变的物质。
分解过氧化氢(双氧水H2O2)法
仪器:分液漏斗(有阀门的)、锥形瓶、集气瓶、导管、双孔橡皮塞、水槽
装配仪器的顺序:
要求:从下到上、从左到右
过氧化氢制取氧气
实验室制取氧气装置
发生装置
收集装置
分液漏斗
锥形瓶
分液漏斗
MnO2(催化剂)
过氧化氢溶液
检查装置气密性
先连接如图所示的装置,将分液漏斗的阀门关闭,然后将导管放入水中,然后用手握住锥形瓶,如果导管口有气泡产生或者松手后导管中有一段水柱,则气密性良好。
装置连接完毕后,能马上装药品进行实验吗?
那么如何进行气密性检查呢?
构建原理:
先构建密闭空间,然后进行实验操作,并观察气压是否变化
气密性检查方法
(1)将实验装置如图连接,在水槽中注满水,并将导管的一端浸入水中;
(2)用双手捂住锥形瓶的外壁(对其加热);
(3) 观察;
如水中出现气泡,且锥形瓶冷却后,水进入导管形成一端水柱,则说明气密性良好。
双氧水制氧气的实验步骤
检:
检查装置的气密性
装:
装药品
开:
打开分液漏斗的开关
收:
用合适的方法收集氧气
氧气的收集
1 什么时候开始收集?
2 用什么方法收集?
当气泡连续均匀冒出时
3 什么时候停
排水法:将水排尽
向上排空气法:用带火星的木条放于瓶口附近,观察木条是否复燃。
4 收集完,集气瓶该怎么放?
用毛玻璃盖住后正放
双氧水制氧气的实验步骤
检:
检查装置的气密性
装:
装药品
开:
打开分液漏斗的开关
收:
用合适的方法收集氧气
移:
从水槽中移出导管
关:
关上开关
思考
1 怎么检验收集的气体就是氧气呢?
将带火星的木条放入集气瓶中,观察是否复燃
2 如果将分液漏斗换成长颈漏斗,那漏斗下端应该有什么要求?
补充学习
仔细观察两个装置,有什么区别?为什么?
1.3 用分解反应制取氧气
九年级上化学
第一章 化学反应
氧气的用途
氧气对于我们而言有着重要的意义,你能说说在生活和生产中氧气的用途吗?
像科学家一样思考
作用
①可以湿润气体
②可以观察氧气的输出速度
这个装置有什么用呢?
氧气的获得
氧气的用途如此广泛且重要,那么我们有哪些方法可以来获得氧气呢?
植物的光合作用
电解水
分离液化空气
.
.
.
这些方法中哪些适合来制取氧气呢?
空气
多次压缩
降温
液态空气
低温蒸发
-196℃
沸点-196℃
沸点-183℃
氮气 N2
液氧 O2
想一想
这个过程符合质量守恒定律吗?
氧气的工业制法------分离液化空气
实验室的氧气制取
常见的三种实验室制法:
1 氯酸钾:
2 高锰酸钾:
3 过氧化氢:
你觉得以上三种方法哪种最适合学生操作呢?为什么?
方法二:加热高锰酸钾(氯酸钾)法
方法一:分解双氧水法
发生装置的选择
我会小结
温馨小贴士:发生装置的选择依据:
(1)物质的状态
(2)反应的条件
收集装置的选择
资料:氧气不易溶于水;密度比空气略大
排水法
那么问题来了,氧气可以用什么方法收集呢?
排空气法
过 氧 化 氢 溶 液
观察:向三支试管中分别加入过氧化氢,仔细观察是否有气泡产生以及产生的速率,将带火星的木条伸入三支试管的试管口,观察哪个能够复燃。
实验中的新发现
选用药品 产生气体速率 能否使带火星的木条复燃
1 过氧化氢 慢 否
2 过氧化氢和二氧化锰 快 能
3 过氧化氢和猪肝 快 能
实验现象
催化剂
小资料
1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化碳的质量不发生改变
2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
3.收集加二氧化锰与不加二氧化锰产生的氧气,发现质量相同。
二氧化锰加快了过氧化氢的反应速率,本身的质量和化学性质在反应前后不变。
催化剂不影响生成物的产量
我会总结
1 催化剂的作用:改变(加快和减慢)化学反应的反应速率
2 催化剂的特点:其自身的组成、化学性质和质量不会发生改变的物质。
分解过氧化氢(双氧水H2O2)法
仪器:分液漏斗(有阀门的)、锥形瓶、集气瓶、导管、双孔橡皮塞、水槽
装配仪器的顺序:
要求:从下到上、从左到右
过氧化氢制取氧气
实验室制取氧气装置
发生装置
收集装置
分液漏斗
锥形瓶
分液漏斗
MnO2(催化剂)
过氧化氢溶液
检查装置气密性
先连接如图所示的装置,将分液漏斗的阀门关闭,然后将导管放入水中,然后用手握住锥形瓶,如果导管口有气泡产生或者松手后导管中有一段水柱,则气密性良好。
装置连接完毕后,能马上装药品进行实验吗?
那么如何进行气密性检查呢?
构建原理:
先构建密闭空间,然后进行实验操作,并观察气压是否变化
气密性检查方法
(1)将实验装置如图连接,在水槽中注满水,并将导管的一端浸入水中;
(2)用双手捂住锥形瓶的外壁(对其加热);
(3) 观察;
如水中出现气泡,且锥形瓶冷却后,水进入导管形成一端水柱,则说明气密性良好。
双氧水制氧气的实验步骤
检:
检查装置的气密性
装:
装药品
开:
打开分液漏斗的开关
收:
用合适的方法收集氧气
氧气的收集
1 什么时候开始收集?
2 用什么方法收集?
当气泡连续均匀冒出时
3 什么时候停
排水法:将水排尽
向上排空气法:用带火星的木条放于瓶口附近,观察木条是否复燃。
4 收集完,集气瓶该怎么放?
用毛玻璃盖住后正放
双氧水制氧气的实验步骤
检:
检查装置的气密性
装:
装药品
开:
打开分液漏斗的开关
收:
用合适的方法收集氧气
移:
从水槽中移出导管
关:
关上开关
思考
1 怎么检验收集的气体就是氧气呢?
将带火星的木条放入集气瓶中,观察是否复燃
2 如果将分液漏斗换成长颈漏斗,那漏斗下端应该有什么要求?
补充学习
仔细观察两个装置,有什么区别?为什么?
