河北南宫中学高一化学人教版必修一第一章 第2节 化学计量在实验中的应用 导学案
文档属性
| 名称 | 河北南宫中学高一化学人教版必修一第一章 第2节 化学计量在实验中的应用 导学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 241.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-28 00:00:00 | ||
图片预览



文档简介
第一章 第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
【学习目标】
1.了解物质的量及其单位——摩尔所表示的意义。
2.了解物质的量与微观粒子数之间的关系;掌握阿伏加德罗常数的意义。
【知识导学】
一、物质的量及其单位——摩尔
1.物质的量的概念
国际单位制中7个基本物理量之一,它表示含有①的集合体,符号为②。
2.物质的量的单位——摩尔
( http: / / www.21cnjy.com )
3.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数,符号为⑨。
(2)通常用6.02×1023 mol-1表示。
4.物质的量、阿伏加德罗常数与粒子数之间的关系⑩。
二、摩尔质量
( http: / / www.21cnjy.com )
【三点探究】
探究1:物质的量及其单位
1.“1 mol鸡蛋”和“1 mol氧”这两种说法是否准确?使用摩尔表示物质的量时应如何表达?
2.1 mol CO(NH2)2含有的氢原子的物质的量是多少?
探究2:摩尔质量
1.摩尔质量与物质的相对分子(原子)质量数值上相等吗?
2.2 mol CO(NH2)2含有的氧原子的质量是多少?
3.2 mol CO(NH2)2所含氢原子数跟多少克H2O所含氢原子数相等?
【技能训练】
1.下列说法中不正确的是( )。
A.物质的量是国际单位制中的一个基本物理量
B.阿伏加德罗常数个粒子的物质的量是1 mol
C.1 mol任何物质都含有约6.02×1023个原子
D.0.5 mol O2含有6.02×1023个O原子
2.下列说法中不正确的是( )。
A.1 mol氧原子的质量是16 g·mol-1 B.Na+的摩尔质量是23 g·mol-1
C.CO2的摩尔质量是44 g·mol-1 D.3.01×1022个H的质量是0.05 g
3.下列叙述中不正确的是( )。
A.摩尔质量的常用单位为 g·mol-1 B.水的摩尔质量为18 g·mol-1
C.二氧化硫的摩尔质量为64 g·mol-1 D.摩尔质量就是相对原子质量的6.02×1023倍
4.关于摩尔质量的说法正确的是( )。
A.H2O的摩尔质量是18 g B.钠的摩尔质量为23
C.Cl2的摩尔质量为35.5 g·mol-1 D.氢原子的摩尔质量为1 g·mol-1
5.下列关于阿伏加德罗常数的说法中正确的是( )。
A.阿伏加德罗常数等于6.02×1023
B.阿伏加德罗常数约等于6.02×1023 mol-1
C.阿伏加德罗常数等于6.02×1023 mol
D.阿伏加德罗常数约等于6.02×1023
【拓展提升】
6.11 g CO2中含有 个CO2,其中有 个O。
7.在14.2 g Na2SO4中,
(1)含有的Na+的数目是____________;
(2)含有的SO的质量是__________;
(3)含氧原子的物质的量是________。
8.现有4.9 g H3PO4,若用NA表示阿伏加德罗常数,请完成下列各题:
(1)H3PO4的摩尔质量为__________。
(2)H3PO4的物质的量为__________。
(3)H3PO4中原子总数为________。
9.1.7 g NH3所含的分子数与______ g氮气所含的分子数相同,所含原子数与______ g氮气所含的原子数相同。
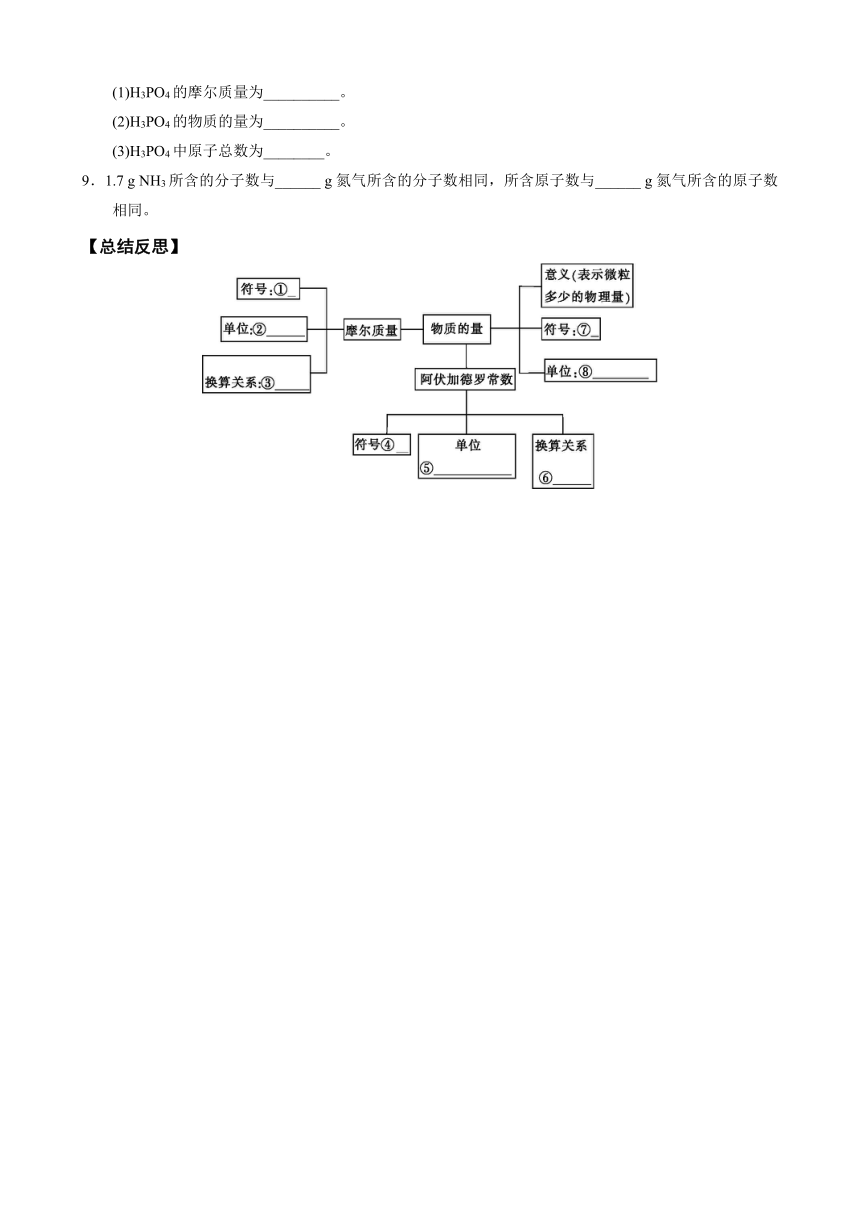
【总结反思】
( http: / / www.21cnjy.com )
第2课时 气体摩尔体积
【学习目标】
1.掌握气体摩尔体积的概念及影响气体体积的因素。
2.了解物质的量、气体摩尔体积和气体的体积之间的关系。
【知识导学】
一、气体摩尔体积
1.气体摩尔体积是 ,符号是 ,单位
是 。标准状况下,气体摩尔体积约为 。
对于气体摩尔体积的理解,应注意以下几点:
(1)气体摩尔体积的适用范围是 。在 下,1 mol 所占的体积约是22.4 L。
(2)气体的体积与温度、压强有关。相同温 ( http: / / www.21cnjy.com )度下,单位物质的量的气体压强越小,气体体积 ;相同压强下,单位物质的量的气体温度越高,气体体积 。
(3)气体摩尔体积不仅适用于纯气体,也适用 ( http: / / www.21cnjy.com )于 。如0.3 mol H2与0.7 mol O2的混合气在标准状况下的体积约为 。
2.标准状况下,气体摩尔体积的有关计算
①气体的物质的量n= mol; ②气体的摩尔质量M=Vm·ρ=22.4ρ_g·mol-1;
③气体的分子数N=n·NA=·NA; ④气体的质量m=n·M=·M g。
二、阿伏伽德罗定律及其推论
1.分析下列1mol物质在0℃、1.01×105Pa下的体积,发现规律
物质 状态 密度 体积
Fe 固体 7.8g/ml 7.2ml
Al 固体 2.7g/ml 10ml
H2O 液体 1g/ml 18ml
H2SO4 液体 1.83g/ml 53.6ml
H2 气体 0.0893g/L 22.4
O2 气体 1.429g/L 22.39
CO2 气体 1.965g/L 22.39L
N2 气体 1.25g/L 22.4L
结论:
①在同温同压下,气体的物质的量比等于 。
②在同温同压下,1 mol的不同气体,其体积 。
2.阿伏伽德罗定律及其推论
阿伏加德罗定律: 。
相同条件下的气体,同体积时,分子数 ( http: / / www.21cnjy.com ) ;反之,分子数相同时,体积也 ;气体的体积比等于 。
【三点探究】
探究1:气体摩尔体积
1.请判断“标准状况下,1.12 L由O2和CO2组成的混合气体含有0.1NA个氧原子”是否正确,并说明理由。
2.请判断“标准状况下,22.4 L四氯化碳中含有NA个四氯化碳分子”是否正确,并说明理由。
3.有人说:“非标准状况下,1mol气体的体积一定不是22.4L。”这一说法对吗? 为什么?
探究2:阿伏加德罗定律及其推论
1.同温同压下,向两个体积相同的密闭容器中分别充满O2、O3气体,则两种气体的质量之比为多少?物质的量之比为多少?密度之比为多少?
2.同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,则两种气体的体积之比为多少?物质的量之比为多少?密度之比为多少?
【技能训练】
1.下列各图中,白球代表氢原子,黑球代表氦原子,表示等质量的氢气与氦气的混合气体的是
2.标准状况下,0.4 mol NH3的体积是( )。
A.22.4 L B.11.2 L C.4.48 L D.8.96 L
3.在两个容积相同的容器中,一个盛有CH4,另一个盛有H2。在同温同压下,两容器内的气体一定具有相同的是( )。
A.原子数 B.分子数 C.质量 D.密度
4.下列说法正确的是( )。
A.常温常压下,22.4 L CO2中含有NA个CO2分子
B.标准状况下,22.4 L空气含有NA个单质分子
C.22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1NA个氧原子
【拓展提升】
5.已知某气体单质R3的摩 ( http: / / www.21cnjy.com )尔质量为M g·mol-1,阿伏加德罗常数的数值用NA表示,现有V L(标准状况下)该气体,用含M、V、NA的代数式回答下列问题:
(1)该气体的物质的量为 mol。
(2)该气体在标准状况下的密度为 g·L-1。
(3)该气体所含原子总数为 。
(4)一个R原子的质量为 g。
6.CO和CO2的混合气体18 g,完全燃烧后测得CO2的体积为11.2 L(标准状况)。试回答:
(1)混合气体中CO的质量是____________ g。
(2)混合气体中CO2在标准状况下的体积是________。
(3)混合气体在标准状况下的密度是____________。
【总结反思】
( http: / / www.21cnjy.com )
第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
【知识导学】
①一定数目粒子 ②n ③0.012 ④6.02×1023 ⑤mol ⑥原子 ⑦分子 ⑧离子 ⑨NA ⑩n= M g/mol或g·mol-1 相对原子质量或相对分子质量 n=
【三点探究】
探究1:物质的量及其单位
1.不准确,物质的量计量的对象不是宏观 ( http: / / www.21cnjy.com )物体,而是微观具有可数性的“基本单元”——微粒或特定组合。在使用摩尔表示物质的量时,必须用化学式指明粒子的种类。
2. 1 mol CO(NH2)2含有4 mol 氢原子
探究2:摩尔质量
1.摩尔质量取单位g·mol-1时其数值与相对分子(原子)质量相等。
2.2 mol CO(NH2)2含有2 mol 氧原子,其质量为2 mol×16 g·mol-1=32 g。
3.2 mol CO(NH2)2含 ( http: / / www.21cnjy.com )有8 mol 氢原子,含有8 mol 氢原子需4 mol H2O,其质量为 4 mol×18 g·mol-1=72 g。
【技能训练】
1. C 2. A 3. D 4.D 5. B
【拓展提升】
6. 1.505×1023;3.01×1023
7. (1)1.204×1023 (2)9.6g (3)0.4mol
8.(1)98g·mol-1 (2)0.05mol (3)0.4 NA
9. 2.8 5.6
第2课时 气体摩尔体积
【知识导学】
一、气体摩尔体积
1. 单位物质的量的气体所占的体积 Vm L·mol-1 22.4 L·mol-1
(1)气体 标准状况 任何气体
(2)越大 越大
(3)混合气体 22.4 L
二、阿伏伽德罗定律及其推论
1.体积之比 相同
2.在同温同压下,粒子数相同的任何气体具有相同的体积 相同 相同 分子数之比
【三点探究】
探究1:气体摩尔体积
1. 正确。1.12 L由O2和C ( http: / / www.21cnjy.com )O2组成的混合气体的物质的量为0.05 mol,分子数为0.05NA,1个氧气分子有2个氧原子,1个二氧化碳分子也有2个氧原子,所以氧原子数是0.05NA×2=0.1NA,故正确。
2. 不正确。标准状况下,四氯化碳是液体,故22.4 L四氯化碳不是1 mol。
3. 不对。气体的体积温度和压强两个因素的影响,两个因素都改变,气体的体积可能与标况相同。
探究2:阿伏加德罗定律及其推论
1. 质量之比为2∶3,物质的量之比为1:1,密度之比为2:3
2. 体积之比为3:2,物质的量之比为3:2,密度之比为2:3
【技能训练】
1.B 2.D 3.B 4.D
【拓展提升】
5.(1) (2) (3) (4)
6.(1)7 (2)5.6 L (3)1.607g·L-1
【总结反思】
①0 ℃ ②1 mol ③n·Vm ④L·mol-1 ⑤Vm ⑥温度 ⑦压强
第1课时 物质的量的单位——摩尔
【学习目标】
1.了解物质的量及其单位——摩尔所表示的意义。
2.了解物质的量与微观粒子数之间的关系;掌握阿伏加德罗常数的意义。
【知识导学】
一、物质的量及其单位——摩尔
1.物质的量的概念
国际单位制中7个基本物理量之一,它表示含有①的集合体,符号为②。
2.物质的量的单位——摩尔
( http: / / www.21cnjy.com )
3.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数,符号为⑨。
(2)通常用6.02×1023 mol-1表示。
4.物质的量、阿伏加德罗常数与粒子数之间的关系⑩。
二、摩尔质量
( http: / / www.21cnjy.com )
【三点探究】
探究1:物质的量及其单位
1.“1 mol鸡蛋”和“1 mol氧”这两种说法是否准确?使用摩尔表示物质的量时应如何表达?
2.1 mol CO(NH2)2含有的氢原子的物质的量是多少?
探究2:摩尔质量
1.摩尔质量与物质的相对分子(原子)质量数值上相等吗?
2.2 mol CO(NH2)2含有的氧原子的质量是多少?
3.2 mol CO(NH2)2所含氢原子数跟多少克H2O所含氢原子数相等?
【技能训练】
1.下列说法中不正确的是( )。
A.物质的量是国际单位制中的一个基本物理量
B.阿伏加德罗常数个粒子的物质的量是1 mol
C.1 mol任何物质都含有约6.02×1023个原子
D.0.5 mol O2含有6.02×1023个O原子
2.下列说法中不正确的是( )。
A.1 mol氧原子的质量是16 g·mol-1 B.Na+的摩尔质量是23 g·mol-1
C.CO2的摩尔质量是44 g·mol-1 D.3.01×1022个H的质量是0.05 g
3.下列叙述中不正确的是( )。
A.摩尔质量的常用单位为 g·mol-1 B.水的摩尔质量为18 g·mol-1
C.二氧化硫的摩尔质量为64 g·mol-1 D.摩尔质量就是相对原子质量的6.02×1023倍
4.关于摩尔质量的说法正确的是( )。
A.H2O的摩尔质量是18 g B.钠的摩尔质量为23
C.Cl2的摩尔质量为35.5 g·mol-1 D.氢原子的摩尔质量为1 g·mol-1
5.下列关于阿伏加德罗常数的说法中正确的是( )。
A.阿伏加德罗常数等于6.02×1023
B.阿伏加德罗常数约等于6.02×1023 mol-1
C.阿伏加德罗常数等于6.02×1023 mol
D.阿伏加德罗常数约等于6.02×1023
【拓展提升】
6.11 g CO2中含有 个CO2,其中有 个O。
7.在14.2 g Na2SO4中,
(1)含有的Na+的数目是____________;
(2)含有的SO的质量是__________;
(3)含氧原子的物质的量是________。
8.现有4.9 g H3PO4,若用NA表示阿伏加德罗常数,请完成下列各题:
(1)H3PO4的摩尔质量为__________。
(2)H3PO4的物质的量为__________。
(3)H3PO4中原子总数为________。
9.1.7 g NH3所含的分子数与______ g氮气所含的分子数相同,所含原子数与______ g氮气所含的原子数相同。
【总结反思】
( http: / / www.21cnjy.com )
第2课时 气体摩尔体积
【学习目标】
1.掌握气体摩尔体积的概念及影响气体体积的因素。
2.了解物质的量、气体摩尔体积和气体的体积之间的关系。
【知识导学】
一、气体摩尔体积
1.气体摩尔体积是 ,符号是 ,单位
是 。标准状况下,气体摩尔体积约为 。
对于气体摩尔体积的理解,应注意以下几点:
(1)气体摩尔体积的适用范围是 。在 下,1 mol 所占的体积约是22.4 L。
(2)气体的体积与温度、压强有关。相同温 ( http: / / www.21cnjy.com )度下,单位物质的量的气体压强越小,气体体积 ;相同压强下,单位物质的量的气体温度越高,气体体积 。
(3)气体摩尔体积不仅适用于纯气体,也适用 ( http: / / www.21cnjy.com )于 。如0.3 mol H2与0.7 mol O2的混合气在标准状况下的体积约为 。
2.标准状况下,气体摩尔体积的有关计算
①气体的物质的量n= mol; ②气体的摩尔质量M=Vm·ρ=22.4ρ_g·mol-1;
③气体的分子数N=n·NA=·NA; ④气体的质量m=n·M=·M g。
二、阿伏伽德罗定律及其推论
1.分析下列1mol物质在0℃、1.01×105Pa下的体积,发现规律
物质 状态 密度 体积
Fe 固体 7.8g/ml 7.2ml
Al 固体 2.7g/ml 10ml
H2O 液体 1g/ml 18ml
H2SO4 液体 1.83g/ml 53.6ml
H2 气体 0.0893g/L 22.4
O2 气体 1.429g/L 22.39
CO2 气体 1.965g/L 22.39L
N2 气体 1.25g/L 22.4L
结论:
①在同温同压下,气体的物质的量比等于 。
②在同温同压下,1 mol的不同气体,其体积 。
2.阿伏伽德罗定律及其推论
阿伏加德罗定律: 。
相同条件下的气体,同体积时,分子数 ( http: / / www.21cnjy.com ) ;反之,分子数相同时,体积也 ;气体的体积比等于 。
【三点探究】
探究1:气体摩尔体积
1.请判断“标准状况下,1.12 L由O2和CO2组成的混合气体含有0.1NA个氧原子”是否正确,并说明理由。
2.请判断“标准状况下,22.4 L四氯化碳中含有NA个四氯化碳分子”是否正确,并说明理由。
3.有人说:“非标准状况下,1mol气体的体积一定不是22.4L。”这一说法对吗? 为什么?
探究2:阿伏加德罗定律及其推论
1.同温同压下,向两个体积相同的密闭容器中分别充满O2、O3气体,则两种气体的质量之比为多少?物质的量之比为多少?密度之比为多少?
2.同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,则两种气体的体积之比为多少?物质的量之比为多少?密度之比为多少?
【技能训练】
1.下列各图中,白球代表氢原子,黑球代表氦原子,表示等质量的氢气与氦气的混合气体的是
2.标准状况下,0.4 mol NH3的体积是( )。
A.22.4 L B.11.2 L C.4.48 L D.8.96 L
3.在两个容积相同的容器中,一个盛有CH4,另一个盛有H2。在同温同压下,两容器内的气体一定具有相同的是( )。
A.原子数 B.分子数 C.质量 D.密度
4.下列说法正确的是( )。
A.常温常压下,22.4 L CO2中含有NA个CO2分子
B.标准状况下,22.4 L空气含有NA个单质分子
C.22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1NA个氧原子
【拓展提升】
5.已知某气体单质R3的摩 ( http: / / www.21cnjy.com )尔质量为M g·mol-1,阿伏加德罗常数的数值用NA表示,现有V L(标准状况下)该气体,用含M、V、NA的代数式回答下列问题:
(1)该气体的物质的量为 mol。
(2)该气体在标准状况下的密度为 g·L-1。
(3)该气体所含原子总数为 。
(4)一个R原子的质量为 g。
6.CO和CO2的混合气体18 g,完全燃烧后测得CO2的体积为11.2 L(标准状况)。试回答:
(1)混合气体中CO的质量是____________ g。
(2)混合气体中CO2在标准状况下的体积是________。
(3)混合气体在标准状况下的密度是____________。
【总结反思】
( http: / / www.21cnjy.com )
第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
【知识导学】
①一定数目粒子 ②n ③0.012 ④6.02×1023 ⑤mol ⑥原子 ⑦分子 ⑧离子 ⑨NA ⑩n= M g/mol或g·mol-1 相对原子质量或相对分子质量 n=
【三点探究】
探究1:物质的量及其单位
1.不准确,物质的量计量的对象不是宏观 ( http: / / www.21cnjy.com )物体,而是微观具有可数性的“基本单元”——微粒或特定组合。在使用摩尔表示物质的量时,必须用化学式指明粒子的种类。
2. 1 mol CO(NH2)2含有4 mol 氢原子
探究2:摩尔质量
1.摩尔质量取单位g·mol-1时其数值与相对分子(原子)质量相等。
2.2 mol CO(NH2)2含有2 mol 氧原子,其质量为2 mol×16 g·mol-1=32 g。
3.2 mol CO(NH2)2含 ( http: / / www.21cnjy.com )有8 mol 氢原子,含有8 mol 氢原子需4 mol H2O,其质量为 4 mol×18 g·mol-1=72 g。
【技能训练】
1. C 2. A 3. D 4.D 5. B
【拓展提升】
6. 1.505×1023;3.01×1023
7. (1)1.204×1023 (2)9.6g (3)0.4mol
8.(1)98g·mol-1 (2)0.05mol (3)0.4 NA
9. 2.8 5.6
第2课时 气体摩尔体积
【知识导学】
一、气体摩尔体积
1. 单位物质的量的气体所占的体积 Vm L·mol-1 22.4 L·mol-1
(1)气体 标准状况 任何气体
(2)越大 越大
(3)混合气体 22.4 L
二、阿伏伽德罗定律及其推论
1.体积之比 相同
2.在同温同压下,粒子数相同的任何气体具有相同的体积 相同 相同 分子数之比
【三点探究】
探究1:气体摩尔体积
1. 正确。1.12 L由O2和C ( http: / / www.21cnjy.com )O2组成的混合气体的物质的量为0.05 mol,分子数为0.05NA,1个氧气分子有2个氧原子,1个二氧化碳分子也有2个氧原子,所以氧原子数是0.05NA×2=0.1NA,故正确。
2. 不正确。标准状况下,四氯化碳是液体,故22.4 L四氯化碳不是1 mol。
3. 不对。气体的体积温度和压强两个因素的影响,两个因素都改变,气体的体积可能与标况相同。
探究2:阿伏加德罗定律及其推论
1. 质量之比为2∶3,物质的量之比为1:1,密度之比为2:3
2. 体积之比为3:2,物质的量之比为3:2,密度之比为2:3
【技能训练】
1.B 2.D 3.B 4.D
【拓展提升】
5.(1) (2) (3) (4)
6.(1)7 (2)5.6 L (3)1.607g·L-1
【总结反思】
①0 ℃ ②1 mol ③n·Vm ④L·mol-1 ⑤Vm ⑥温度 ⑦压强
