甘肃省武威市民勤一中2023-2024学年高一下学期期末考试化学试题(PDF版,无答案)
文档属性
| 名称 | 甘肃省武威市民勤一中2023-2024学年高一下学期期末考试化学试题(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 709.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-17 06:37:20 | ||
图片预览



文档简介
民勤一中 2023-2024 学年度第二学期期末考试
高一化学
(时间 75分钟 总分 100 分)
可能用到的相对原子质量:N 14 O 16
第Ⅰ卷(选择题 共 48分)
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,
只有一项是符合题目要求的。
1. 下列成语涉及高分子材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 人造奶油
2. 化学与生活息息相关,下列对应关系错误的是
物质 性质 用途
A 次氯酸钠 氧化性 衣物漂白
B 氢气 可燃性 制作燃料电池
C 硫酸钡 难溶胃酸 透视用“钡餐”
D 活性炭 吸附性 分解室内甲醛
A. A B. B C. C D. D
3. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 制取乙酸乙酯时,加入浓硫酸
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
4.化学用语是一种简洁、大方而又严谨的学科语言,下列有关化学用语使用错误的
是
A.氯离子的结构示意图: B.甲基的电子式为
C.乙烯的球棍模型为 D.乙酸的分子式为:CH3COOH
5.可逆反应A g 4B g C g D s ,在四种不同情况下的反应速率如下,
其中反应进行的最快的是
A. v A 0.15mol L min B. v B 0.06mol L s
C. v C 0.4mol L min D. v D 0.02mol L s
1
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
6.下列实验操作或做法正确且能达到目的的是
选项 操作或做法 目的
A 将混有乙烯的甲烷通入酸性高锰酸钾溶液 去除乙烯
可使产品更加纯
B 实验室将生成的乙酸乙酯导入饱和的Na2CO3溶液中
净
向淀粉溶液加入稀硫酸水浴加热,一段时间后加入新制
C 检验淀粉水解
Cu OH 2悬浊液加热
向试管溶液中滴加少量氯水后再滴加几滴KSCN溶液,
D 检验溶液中含有
溶液变血红色 Fe2
7.硫酸是重要的化工原料,可用于生产化肥、农药、炸药等,工业上一般以硫磺或
其他含硫矿物如黄铁矿(主要成分 FeS2)为原料制备硫酸,其制备原理示意图如下。下
列说法不正确的是( )
A.用黄铁矿燃烧生成 SO 高温2的化学方程式为 4FeS2+11O2=====2Fe2O3+8SO2
B.SO2氧化成 SO3时,加催化剂能使 SO2全部转化为 SO3
C.用 98.3%的浓硫酸吸收 SO3,目的是防止形成酸雾,以使 SO3吸收完全
D.为减少 SO2对大气的污染,可选用CaO做固硫剂把尾气中的 SO2以盐的形式固
定
8.化合物丙是一种医药中间体,可以通过如图反应制得。下列说法正确的是( )
A.丙的分子式为C10H16O2
B.甲的一氯代物有 4种
C.乙可以发生取代反应、加成反应、氧化反应
D.甲、丙均不能使酸性高锰酸钾溶液褪色
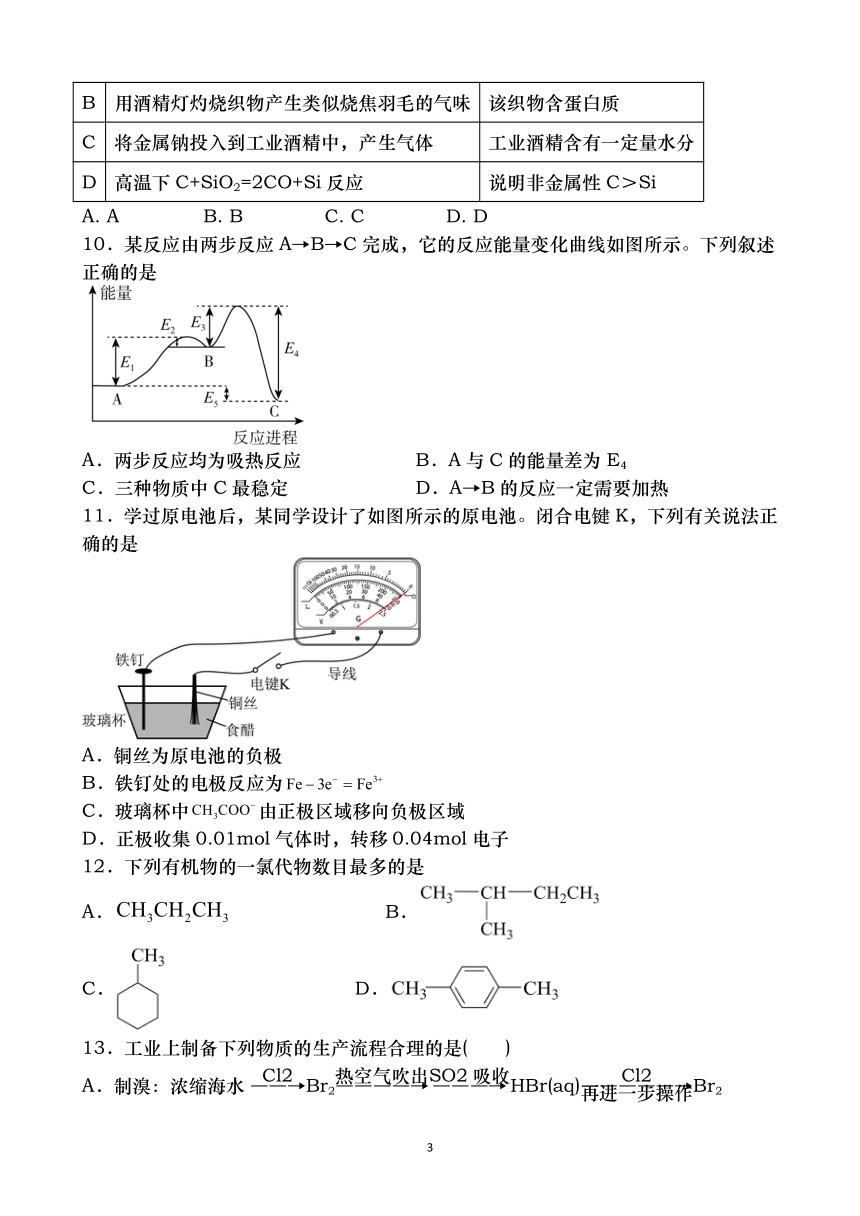
9. 下列实验操作、现象和结论相对应的是
实验操作、现象 结论
A 用蓝色石蕊试纸检验某无色溶液,试纸变红 该溶液是酸溶液
2
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
B 用酒精灯灼烧织物产生类似烧焦羽毛的气味 该织物含蛋白质
C 将金属钠投入到工业酒精中,产生气体 工业酒精含有一定量水分
D 高温下C+SiO2=2CO+Si 反应 说明非金属性C>Si
A. A B. B C. C D. D
10.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述
正确的是
A.两步反应均为吸热反应 B.A与 C的能量差为 E4
C.三种物质中 C最稳定 D.A→B的反应一定需要加热
11.学过原电池后,某同学设计了如图所示的原电池。闭合电键K,下列有关说法正
确的是
A.铜丝为原电池的负极
B.铁钉处的电极反应为 Fe 3e Fe3
C.玻璃杯中CH3COO 由正极区域移向负极区域
D.正极收集 0.01mol 气体时,转移 0.04mol 电子
12.下列有机物的一氯代物数目最多的是
A.CH3CH2CH3 B.
C. D.
13.工业上制备下列物质的生产流程合理的是( )
A.制溴:浓缩海水―C―l2→Br ―热空―气――吹→出S2 ―
O―2―吸→收HBr(aq)―再进――
Cl2
一步―操―作→Br2
3
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
B.从海水中提取镁:海水石――灰乳→Mg(OH) ―加―热2 →MgO―
电―解→Mg
C.由铝土矿冶炼铝:铝土矿―提―纯→Al2O ―
H―Cl3 →AlCl3―
电―解→Al
D.由 NaCl 制漂白粉:饱和食盐水―电―解→C N―a―O―H―溶l2 →
液漂白粉
14.向容积为 2.0 L 的密闭容器中通入一定量的N2O4(无色气体)和 NO2的混合气体,
发生反应:N2O4 2NO2(g),反应吸热,体系中各物质的物质的量随时间的变化如
图所示。下列有关说法正确的是( )
A.64 s 时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前 100 s 内,用NO2浓度的变
二、非选择题(本题共 4小题,共 58 分)
15.(14 分)
I.已知锌与稀硫酸反应为放热反应,某探究小组为了探究其反应过程中的速率变化,
用排水集气法收集反应放出的氢气,实验记录如下:
经过时间(min) 1 2 3 4 5
氢气体积(mL) 30 120 280 350 370
(1)反应速率最大的(即 0~1min、1~2min、2~3min、3~4min、4~5min)时
间段为_______,原因是_______。
(2)反应速率最小的时间段为_______,原因是_______。
II.该探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率
的因素。限选试剂:1.00 mol/L HNO3、2.00 mol/L HNO3,细颗粒大理石、粗颗
粒大理石,35℃水浴。
(3)他们能完成哪些因素对速率影响的探究_______?。
(4)请根据能进行的探究内容,补充完成下列实验设计表的空白部分,完成探究实
验:
4
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
实验编号 T/℃ 大理石规格 硝酸浓度(mol/L)
① 常温 细颗粒 2.00
② ___ 细颗粒 1.00
③ 35 ____ 2.00
④ 35 _____ 2.00
(5)整个实验中应控制的不变量是硝酸溶液体积和_______。
16.(15 分)氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx 对于环境保
护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设
计如图(部分夹持装置省略)。
①用装置 A制备 NH3,其中发生反应的化学方程式为
__________________________________;装置B内的试剂是____________。
②装置D中发生反应的离子方程式是_________________________________________,
铜丝可抽动的优点是_______________________________________。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3
和NO2的物质的量之比为__________________。
(2)用 NaOH溶液吸收法处理NOx(仅含 NO、NO2)。已知吸收过程发生的反应有
2NaOH+NO+NO2===2NaNO2+H2O;2NaOH+2NO2===NaNO3+NaNO2+
H2O。
①用不同浓度的NaOH溶液吸收 NO2含量不同的尾气,关系如图(α表示 NOx 中 NO2
的含量):
5
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
用NaOH溶液吸收氮氧化物的最佳条件为α=______,c(NaOH)=________________。
②若一定体积的NOx 被 250 mL 2 mol ·L-1的 NaOH溶液恰好完全吸收,溶液
质量增加 19.8 g,则 x的值为______________。
17.(15 分)一定温度下,在 2L 的密闭容器中,X、Y、Z(均为气体)的物质的量随时
间的变化曲线如图所示。请回答下列问题:
(1)该反应的化学方程式为_______,0 到 2 min 时,用物质X表示的反应速率为_______。
(2)在 2 min前的某一时刻采取下列措施,能使反应速率减小的是_______。
A.恒温恒容下,再充入X B.升高温度
C.恒温恒容下,充入 ArD.恒温恒压下,充入Ar
(3)不能说明反应已达到平衡状态的是_______(填序号)。
① v(X)=3v(Y);
②X的物质的量不变;
③混合气体的平均相对分子质量不变;
④X、Y的物质的量之比不变;
⑤容器内压强保持不变;
⑥单位时间内消耗3mol X,同时生成 2mol Z。
(4)若将amol X与bmol Y的混合气体通入密闭容器中发生上述反应,反应到某时刻
各物质的物质的量恰好满足: n(X)=n(Y)=n(Z),则原混合气体中 a:b= _______。
(5)CO 与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构
示意图如下。
6
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
电池总反应为 2CH3OH+3O2 =2CO2 +4H2O,则 c电极的电极反应式为_______。若外
电路中转移 2mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______L。
(6)下列反应中,属于吸热反应的是_______(填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与 NH4Cl 反应 ⑦铁粉与稀盐酸反应
18.(14 分)已知:有机物 A的产量可以用来衡量一个国家的石油化工发展水平,B有
特殊的香味,E是常见的高分子材料。现以 A为主要原料合成乙酸乙酯,其合成路线
如下图所示。
(1)A、D分子中官能团的名称分别是____、_____。反应④、⑤的反应类型分别是
____、____。
(2)反应②的化学方程式是_______,反应④的化学方程式是_______。
(3)某同学用如下图所示的实验装置制取少量乙酸乙酯。
7
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
实验结束后,烧杯D中上层出现透明的、不溶于水的油状液体。
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______。
②仪器 C的名称是_____。在该实验中,它的作用除了冷凝,还可以_________。
③烧杯D中盛放的溶液是________,它的作用是_______(填字母)
a.中和乙酸和乙醇
b.中和乙酸,吸收乙醇
c.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,利于它分层析出
d.加速酯的生成,提高其产率
④在实验室制备乙酸乙酯的实验中,要制备 1 mol 乙酸乙酯所需的B和 D远大于 1
mol(不考虑原料的挥发损耗),原因是___________。
8
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
高一化学
(时间 75分钟 总分 100 分)
可能用到的相对原子质量:N 14 O 16
第Ⅰ卷(选择题 共 48分)
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,
只有一项是符合题目要求的。
1. 下列成语涉及高分子材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 人造奶油
2. 化学与生活息息相关,下列对应关系错误的是
物质 性质 用途
A 次氯酸钠 氧化性 衣物漂白
B 氢气 可燃性 制作燃料电池
C 硫酸钡 难溶胃酸 透视用“钡餐”
D 活性炭 吸附性 分解室内甲醛
A. A B. B C. C D. D
3. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 制取乙酸乙酯时,加入浓硫酸
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
4.化学用语是一种简洁、大方而又严谨的学科语言,下列有关化学用语使用错误的
是
A.氯离子的结构示意图: B.甲基的电子式为
C.乙烯的球棍模型为 D.乙酸的分子式为:CH3COOH
5.可逆反应A g 4B g C g D s ,在四种不同情况下的反应速率如下,
其中反应进行的最快的是
A. v A 0.15mol L min B. v B 0.06mol L s
C. v C 0.4mol L min D. v D 0.02mol L s
1
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
6.下列实验操作或做法正确且能达到目的的是
选项 操作或做法 目的
A 将混有乙烯的甲烷通入酸性高锰酸钾溶液 去除乙烯
可使产品更加纯
B 实验室将生成的乙酸乙酯导入饱和的Na2CO3溶液中
净
向淀粉溶液加入稀硫酸水浴加热,一段时间后加入新制
C 检验淀粉水解
Cu OH 2悬浊液加热
向试管溶液中滴加少量氯水后再滴加几滴KSCN溶液,
D 检验溶液中含有
溶液变血红色 Fe2
7.硫酸是重要的化工原料,可用于生产化肥、农药、炸药等,工业上一般以硫磺或
其他含硫矿物如黄铁矿(主要成分 FeS2)为原料制备硫酸,其制备原理示意图如下。下
列说法不正确的是( )
A.用黄铁矿燃烧生成 SO 高温2的化学方程式为 4FeS2+11O2=====2Fe2O3+8SO2
B.SO2氧化成 SO3时,加催化剂能使 SO2全部转化为 SO3
C.用 98.3%的浓硫酸吸收 SO3,目的是防止形成酸雾,以使 SO3吸收完全
D.为减少 SO2对大气的污染,可选用CaO做固硫剂把尾气中的 SO2以盐的形式固
定
8.化合物丙是一种医药中间体,可以通过如图反应制得。下列说法正确的是( )
A.丙的分子式为C10H16O2
B.甲的一氯代物有 4种
C.乙可以发生取代反应、加成反应、氧化反应
D.甲、丙均不能使酸性高锰酸钾溶液褪色
9. 下列实验操作、现象和结论相对应的是
实验操作、现象 结论
A 用蓝色石蕊试纸检验某无色溶液,试纸变红 该溶液是酸溶液
2
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
B 用酒精灯灼烧织物产生类似烧焦羽毛的气味 该织物含蛋白质
C 将金属钠投入到工业酒精中,产生气体 工业酒精含有一定量水分
D 高温下C+SiO2=2CO+Si 反应 说明非金属性C>Si
A. A B. B C. C D. D
10.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述
正确的是
A.两步反应均为吸热反应 B.A与 C的能量差为 E4
C.三种物质中 C最稳定 D.A→B的反应一定需要加热
11.学过原电池后,某同学设计了如图所示的原电池。闭合电键K,下列有关说法正
确的是
A.铜丝为原电池的负极
B.铁钉处的电极反应为 Fe 3e Fe3
C.玻璃杯中CH3COO 由正极区域移向负极区域
D.正极收集 0.01mol 气体时,转移 0.04mol 电子
12.下列有机物的一氯代物数目最多的是
A.CH3CH2CH3 B.
C. D.
13.工业上制备下列物质的生产流程合理的是( )
A.制溴:浓缩海水―C―l2→Br ―热空―气――吹→出S2 ―
O―2―吸→收HBr(aq)―再进――
Cl2
一步―操―作→Br2
3
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
B.从海水中提取镁:海水石――灰乳→Mg(OH) ―加―热2 →MgO―
电―解→Mg
C.由铝土矿冶炼铝:铝土矿―提―纯→Al2O ―
H―Cl3 →AlCl3―
电―解→Al
D.由 NaCl 制漂白粉:饱和食盐水―电―解→C N―a―O―H―溶l2 →
液漂白粉
14.向容积为 2.0 L 的密闭容器中通入一定量的N2O4(无色气体)和 NO2的混合气体,
发生反应:N2O4 2NO2(g),反应吸热,体系中各物质的物质的量随时间的变化如
图所示。下列有关说法正确的是( )
A.64 s 时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前 100 s 内,用NO2浓度的变
二、非选择题(本题共 4小题,共 58 分)
15.(14 分)
I.已知锌与稀硫酸反应为放热反应,某探究小组为了探究其反应过程中的速率变化,
用排水集气法收集反应放出的氢气,实验记录如下:
经过时间(min) 1 2 3 4 5
氢气体积(mL) 30 120 280 350 370
(1)反应速率最大的(即 0~1min、1~2min、2~3min、3~4min、4~5min)时
间段为_______,原因是_______。
(2)反应速率最小的时间段为_______,原因是_______。
II.该探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率
的因素。限选试剂:1.00 mol/L HNO3、2.00 mol/L HNO3,细颗粒大理石、粗颗
粒大理石,35℃水浴。
(3)他们能完成哪些因素对速率影响的探究_______?。
(4)请根据能进行的探究内容,补充完成下列实验设计表的空白部分,完成探究实
验:
4
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
实验编号 T/℃ 大理石规格 硝酸浓度(mol/L)
① 常温 细颗粒 2.00
② ___ 细颗粒 1.00
③ 35 ____ 2.00
④ 35 _____ 2.00
(5)整个实验中应控制的不变量是硝酸溶液体积和_______。
16.(15 分)氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx 对于环境保
护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设
计如图(部分夹持装置省略)。
①用装置 A制备 NH3,其中发生反应的化学方程式为
__________________________________;装置B内的试剂是____________。
②装置D中发生反应的离子方程式是_________________________________________,
铜丝可抽动的优点是_______________________________________。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3
和NO2的物质的量之比为__________________。
(2)用 NaOH溶液吸收法处理NOx(仅含 NO、NO2)。已知吸收过程发生的反应有
2NaOH+NO+NO2===2NaNO2+H2O;2NaOH+2NO2===NaNO3+NaNO2+
H2O。
①用不同浓度的NaOH溶液吸收 NO2含量不同的尾气,关系如图(α表示 NOx 中 NO2
的含量):
5
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
用NaOH溶液吸收氮氧化物的最佳条件为α=______,c(NaOH)=________________。
②若一定体积的NOx 被 250 mL 2 mol ·L-1的 NaOH溶液恰好完全吸收,溶液
质量增加 19.8 g,则 x的值为______________。
17.(15 分)一定温度下,在 2L 的密闭容器中,X、Y、Z(均为气体)的物质的量随时
间的变化曲线如图所示。请回答下列问题:
(1)该反应的化学方程式为_______,0 到 2 min 时,用物质X表示的反应速率为_______。
(2)在 2 min前的某一时刻采取下列措施,能使反应速率减小的是_______。
A.恒温恒容下,再充入X B.升高温度
C.恒温恒容下,充入 ArD.恒温恒压下,充入Ar
(3)不能说明反应已达到平衡状态的是_______(填序号)。
① v(X)=3v(Y);
②X的物质的量不变;
③混合气体的平均相对分子质量不变;
④X、Y的物质的量之比不变;
⑤容器内压强保持不变;
⑥单位时间内消耗3mol X,同时生成 2mol Z。
(4)若将amol X与bmol Y的混合气体通入密闭容器中发生上述反应,反应到某时刻
各物质的物质的量恰好满足: n(X)=n(Y)=n(Z),则原混合气体中 a:b= _______。
(5)CO 与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构
示意图如下。
6
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
电池总反应为 2CH3OH+3O2 =2CO2 +4H2O,则 c电极的电极反应式为_______。若外
电路中转移 2mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______L。
(6)下列反应中,属于吸热反应的是_______(填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与 NH4Cl 反应 ⑦铁粉与稀盐酸反应
18.(14 分)已知:有机物 A的产量可以用来衡量一个国家的石油化工发展水平,B有
特殊的香味,E是常见的高分子材料。现以 A为主要原料合成乙酸乙酯,其合成路线
如下图所示。
(1)A、D分子中官能团的名称分别是____、_____。反应④、⑤的反应类型分别是
____、____。
(2)反应②的化学方程式是_______,反应④的化学方程式是_______。
(3)某同学用如下图所示的实验装置制取少量乙酸乙酯。
7
{#{QQABILYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
实验结束后,烧杯D中上层出现透明的、不溶于水的油状液体。
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______。
②仪器 C的名称是_____。在该实验中,它的作用除了冷凝,还可以_________。
③烧杯D中盛放的溶液是________,它的作用是_______(填字母)
a.中和乙酸和乙醇
b.中和乙酸,吸收乙醇
c.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,利于它分层析出
d.加速酯的生成,提高其产率
④在实验室制备乙酸乙酯的实验中,要制备 1 mol 乙酸乙酯所需的B和 D远大于 1
mol(不考虑原料的挥发损耗),原因是___________。
8
{#{QQABLIYYKKQ5gwggggAwAgosBSAACQa4gKCRQUQHGICICkkmOQkkJBEEiJCcCgEYgVGARKEqAAMQoqAgAZAFQIFBIAF=A}B#}AA=}#}
同课章节目录
