2023-2024学年下学期湖南省永州市名校联盟期末联考高一化学试卷(含答案)
文档属性
| 名称 | 2023-2024学年下学期湖南省永州市名校联盟期末联考高一化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-17 17:53:37 | ||
图片预览


文档简介
2023-2024学年下学期期末自检
高二化学
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。下列说法错误的是
A.油脂属于天然高分子化合物 B.乙炔可用于生产导电塑料
C.氯乙烷可用作冷冻麻醉剂 D.甲醛的水溶液可用于制作生物标本
2.下列有关物质结构和性质的说法错误的是
A.冰的密度比水小,主要是因为水分子间存在氢键
B.只要分子的空间构型为平面三角形,中心原子均为杂化
C.测定某一固体是否是晶体可用X射线衍射仪进行实验
D.三氟乙酸的酸性小于三氯乙酸的酸性
3.下列物质中,不能与金属钠反应的是
A.乙醇 B.乙酸 C.乙烯 D.水
4.下列化学用语或模型不正确的是
A.羟基的电子式:
B.聚丙烯的结构简式:
C.苯的最简式:CH
D.CCl4分子的球棍模型:
5.下列各组物质的性质比较中,正确的是
A.热稳定性: B.沸点:
C.密度: D.氧化性:
6.已知有机物A的结构如图所示,有关有机物A的性质描述正确的是
A.其分子式为C9H8O2
B.所有的原子可能在同一个平面上
C.可发生取代、加成、酯化、聚合反应
D.一定条件下,1mol有机物A可与5mol氢气反应
7.在3支试管中分别放有:①1mL乙酸乙酯和3mL水②1mL四氯化碳和3mL水③1mL乙酸和3mL水。下图中3支试管从左到右的排列顺序为
A.①②③ B.①③② C.②①③ D.②③①
8.用NA表示阿伏加德罗常数。下列说法正确的是
A.1 mol C2H2分子含有π键的数目为NA
B.1 mol基态Cr原子的未成对电子数为4NA
C.标况下,22.4 L HF所含分子数为NA
D.46 g NO2和的混合气体含有的原子数为3NA
9.已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )
A.第三周期Ⅷ族,p区 B.第三周期ⅤB族,d区
C.第四周期ⅠB族,ds区 D.第四周期ⅤB族,f区
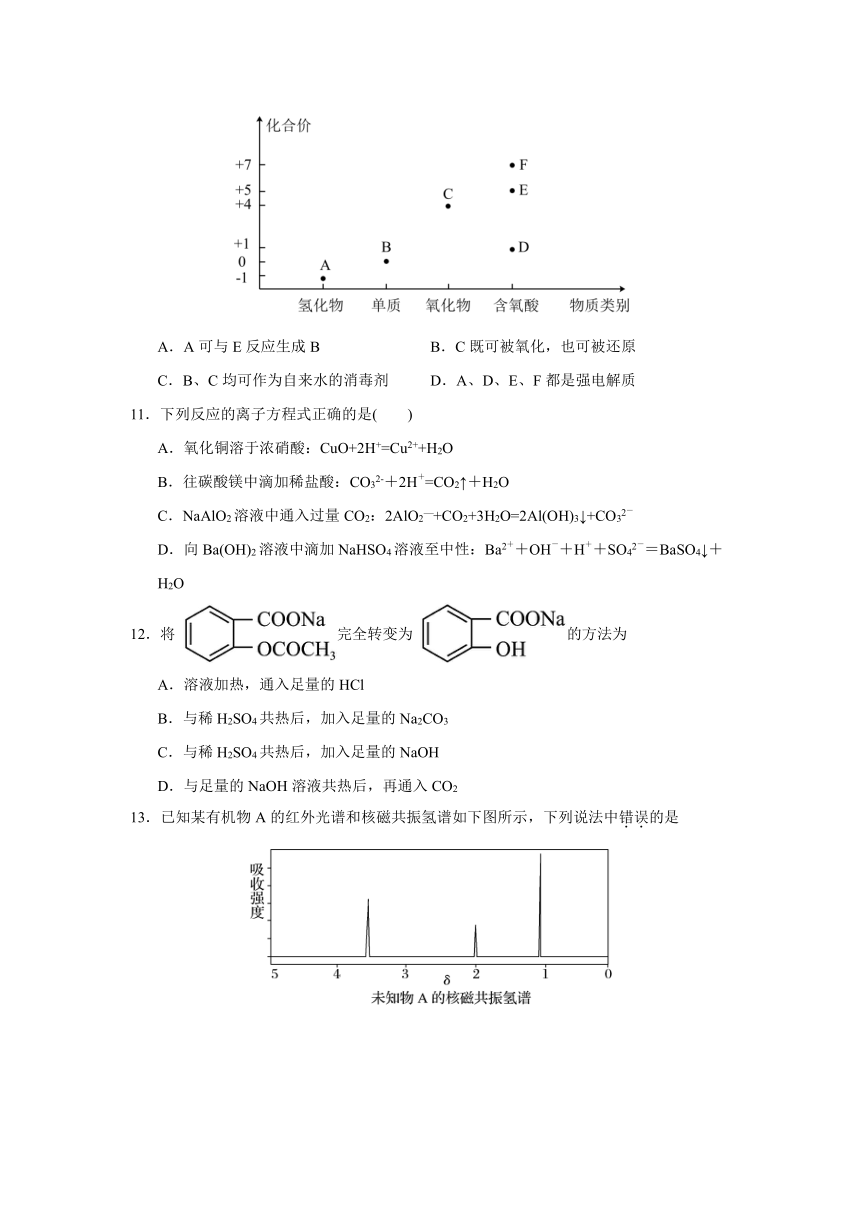
10.氯及其化合物种类繁多,部分含氯物质的价类二维关系如图所示。下列推断不合理的是
A.A可与E反应生成B B.C既可被氧化,也可被还原
C.B、C均可作为自来水的消毒剂 D.A、D、E、F都是强电解质
11.下列反应的离子方程式正确的是( )
A.氧化铜溶于浓硝酸:CuO+2H+=Cu2++H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
12.将 完全转变为 的方法为
A.溶液加热,通入足量的HCl
B.与稀H2SO4共热后,加入足量的Na2CO3
C.与稀H2SO4共热后,加入足量的NaOH
D.与足量的NaOH溶液共热后,再通入CO2
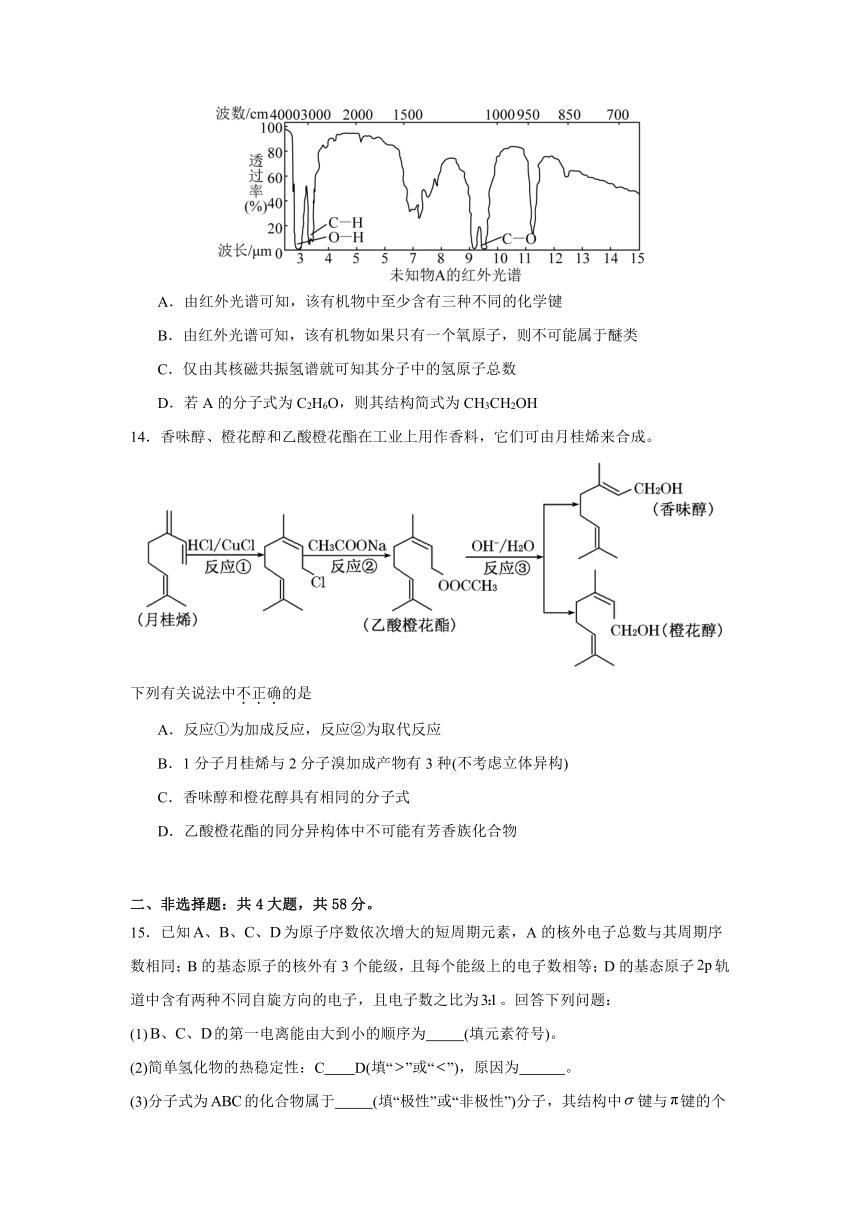
13.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由红外光谱可知,该有机物如果只有一个氧原子,则不可能属于醚类
C.仅由其核磁共振氢谱就可知其分子中的氢原子总数
D.若A的分子式为C2H6O,则其结构简式为CH3CH2OH
14.香味醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。
下列有关说法中不正确的是
A.反应①为加成反应,反应②为取代反应
B.1分子月桂烯与2分子溴加成产物有3种(不考虑立体异构)
C.香味醇和橙花醇具有相同的分子式
D.乙酸橙花酯的同分异构体中不可能有芳香族化合物
二、非选择题:共4大题,共58分。
15.已知为原子序数依次增大的短周期元素,A的核外电子总数与其周期序数相同;B的基态原子的核外有3个能级,且每个能级上的电子数相等;D的基态原子轨道中含有两种不同自旋方向的电子,且电子数之比为。回答下列问题:
(1)的第一电离能由大到小的顺序为 (填元素符号)。
(2)简单氢化物的热稳定性:C D(填“”或“”),原因为 。
(3)分子式为的化合物属于 (填“极性”或“非极性”)分子,其结构中键与键的个数比为 。
(4)桂皮中含有的肉桂醛()是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构,测其可发生如下反应,完成表格。
序号 参与反应的试剂 反应方程式 反应类型
① 新制的氢氧化铜 此空不填
② 溴的四氯化碳溶液 此空不填
16.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 溴 溴苯
密度/ 0.88 3.10 1.50
沸点/℃ 80 59 156
水中溶解度 微溶 微溶 微溶
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑;在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了 气体(填化学式)。a中反应的化学方程式为 。
(2)仪器c的名称 ,其作用是 。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑。
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
17.溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr2 2H2O的实验流程如下:
(1)步骤①需控制在70℃以下,温度不宜过高的原因是 。
(2)下列实验室制取少量NH3的方法正确的是 (填标号)。
A.B.C.D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为 。
(4)步骤④、⑤的目的依次是 、 。
(5)步骤⑥常用 进行脱色,它利用了该物质的 。
(6)步骤⑦得到产品的操作方法是 。
18.根据所学知识回答下列问题:
(1)用系统命名法命名有机化合物:
。
(2)结构简式为的有机物中,共直线的原子最多有 个。
(3)某苯的同系物分子式为,若苯环上的氢原子被卤原子取代,生成的一卤代物只有一种,则该苯的同系物的结构简式为 。
(4)0.2mol有机物和0.4mol在密闭容器中燃烧后的产物为、CO和。产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻了3.2g,最后全部气体再通过碱石灰被完全吸收,碱石灰的质量增加17.6g,该有机物的分子式为 ,请写出该有机物存在两种环境的氢的结构简式: 。
(5)写出实验室制备乙烯的化学方程式: 。
参考答案
1-14 ADCBD CDDCD ADCB
15.(1)N>O>C
(2) < O的原子半径比N小,电负性大于N,H-O键键能大于H-N键,的稳定性大于
(3) 极性 1∶1
(4) 氧化反应
16.(1) HBr +HBr↑
(2) 球形冷凝管 冷凝、回流
(3) 除去HBr和未反应的Br2 干燥溴苯
(4) 苯 C
17. 液溴易挥发 C Ca(BrO3)2+4NH3=CaBr2+2N2+6H2O 逐出氨气 中和滤液中的Ca(OH)2,使溶液呈弱酸性 活性炭 吸附性 蒸发浓缩、冷却结晶、过滤(洗涤)、干燥
18.(1)2,2,3,4-四甲基戊烷
(2)10
(3)
(4) C2H6O2 HOCH2CH2OH
(5)
试卷第1页,共3页
高二化学
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关。下列说法错误的是
A.油脂属于天然高分子化合物 B.乙炔可用于生产导电塑料
C.氯乙烷可用作冷冻麻醉剂 D.甲醛的水溶液可用于制作生物标本
2.下列有关物质结构和性质的说法错误的是
A.冰的密度比水小,主要是因为水分子间存在氢键
B.只要分子的空间构型为平面三角形,中心原子均为杂化
C.测定某一固体是否是晶体可用X射线衍射仪进行实验
D.三氟乙酸的酸性小于三氯乙酸的酸性
3.下列物质中,不能与金属钠反应的是
A.乙醇 B.乙酸 C.乙烯 D.水
4.下列化学用语或模型不正确的是
A.羟基的电子式:
B.聚丙烯的结构简式:
C.苯的最简式:CH
D.CCl4分子的球棍模型:
5.下列各组物质的性质比较中,正确的是
A.热稳定性: B.沸点:
C.密度: D.氧化性:
6.已知有机物A的结构如图所示,有关有机物A的性质描述正确的是
A.其分子式为C9H8O2
B.所有的原子可能在同一个平面上
C.可发生取代、加成、酯化、聚合反应
D.一定条件下,1mol有机物A可与5mol氢气反应
7.在3支试管中分别放有:①1mL乙酸乙酯和3mL水②1mL四氯化碳和3mL水③1mL乙酸和3mL水。下图中3支试管从左到右的排列顺序为
A.①②③ B.①③② C.②①③ D.②③①
8.用NA表示阿伏加德罗常数。下列说法正确的是
A.1 mol C2H2分子含有π键的数目为NA
B.1 mol基态Cr原子的未成对电子数为4NA
C.标况下,22.4 L HF所含分子数为NA
D.46 g NO2和的混合气体含有的原子数为3NA
9.已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )
A.第三周期Ⅷ族,p区 B.第三周期ⅤB族,d区
C.第四周期ⅠB族,ds区 D.第四周期ⅤB族,f区
10.氯及其化合物种类繁多,部分含氯物质的价类二维关系如图所示。下列推断不合理的是
A.A可与E反应生成B B.C既可被氧化,也可被还原
C.B、C均可作为自来水的消毒剂 D.A、D、E、F都是强电解质
11.下列反应的离子方程式正确的是( )
A.氧化铜溶于浓硝酸:CuO+2H+=Cu2++H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
12.将 完全转变为 的方法为
A.溶液加热,通入足量的HCl
B.与稀H2SO4共热后,加入足量的Na2CO3
C.与稀H2SO4共热后,加入足量的NaOH
D.与足量的NaOH溶液共热后,再通入CO2
13.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由红外光谱可知,该有机物如果只有一个氧原子,则不可能属于醚类
C.仅由其核磁共振氢谱就可知其分子中的氢原子总数
D.若A的分子式为C2H6O,则其结构简式为CH3CH2OH
14.香味醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。
下列有关说法中不正确的是
A.反应①为加成反应,反应②为取代反应
B.1分子月桂烯与2分子溴加成产物有3种(不考虑立体异构)
C.香味醇和橙花醇具有相同的分子式
D.乙酸橙花酯的同分异构体中不可能有芳香族化合物
二、非选择题:共4大题,共58分。
15.已知为原子序数依次增大的短周期元素,A的核外电子总数与其周期序数相同;B的基态原子的核外有3个能级,且每个能级上的电子数相等;D的基态原子轨道中含有两种不同自旋方向的电子,且电子数之比为。回答下列问题:
(1)的第一电离能由大到小的顺序为 (填元素符号)。
(2)简单氢化物的热稳定性:C D(填“”或“”),原因为 。
(3)分子式为的化合物属于 (填“极性”或“非极性”)分子,其结构中键与键的个数比为 。
(4)桂皮中含有的肉桂醛()是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构,测其可发生如下反应,完成表格。
序号 参与反应的试剂 反应方程式 反应类型
① 新制的氢氧化铜 此空不填
② 溴的四氯化碳溶液 此空不填
16.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 溴 溴苯
密度/ 0.88 3.10 1.50
沸点/℃ 80 59 156
水中溶解度 微溶 微溶 微溶
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑;在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了 气体(填化学式)。a中反应的化学方程式为 。
(2)仪器c的名称 ,其作用是 。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑。
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
17.溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr2 2H2O的实验流程如下:
(1)步骤①需控制在70℃以下,温度不宜过高的原因是 。
(2)下列实验室制取少量NH3的方法正确的是 (填标号)。
A.B.C.D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为 。
(4)步骤④、⑤的目的依次是 、 。
(5)步骤⑥常用 进行脱色,它利用了该物质的 。
(6)步骤⑦得到产品的操作方法是 。
18.根据所学知识回答下列问题:
(1)用系统命名法命名有机化合物:
。
(2)结构简式为的有机物中,共直线的原子最多有 个。
(3)某苯的同系物分子式为,若苯环上的氢原子被卤原子取代,生成的一卤代物只有一种,则该苯的同系物的结构简式为 。
(4)0.2mol有机物和0.4mol在密闭容器中燃烧后的产物为、CO和。产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻了3.2g,最后全部气体再通过碱石灰被完全吸收,碱石灰的质量增加17.6g,该有机物的分子式为 ,请写出该有机物存在两种环境的氢的结构简式: 。
(5)写出实验室制备乙烯的化学方程式: 。
参考答案
1-14 ADCBD CDDCD ADCB
15.(1)N>O>C
(2) < O的原子半径比N小,电负性大于N,H-O键键能大于H-N键,的稳定性大于
(3) 极性 1∶1
(4) 氧化反应
16.(1) HBr +HBr↑
(2) 球形冷凝管 冷凝、回流
(3) 除去HBr和未反应的Br2 干燥溴苯
(4) 苯 C
17. 液溴易挥发 C Ca(BrO3)2+4NH3=CaBr2+2N2+6H2O 逐出氨气 中和滤液中的Ca(OH)2,使溶液呈弱酸性 活性炭 吸附性 蒸发浓缩、冷却结晶、过滤(洗涤)、干燥
18.(1)2,2,3,4-四甲基戊烷
(2)10
(3)
(4) C2H6O2 HOCH2CH2OH
(5)
试卷第1页,共3页
同课章节目录
