【高效备课】2024人教新版九上化学--2.2 氧气 教学设计 (表格式)
文档属性
| 名称 | 【高效备课】2024人教新版九上化学--2.2 氧气 教学设计 (表格式) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-18 22:19:49 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第二单元《空气和氧气》教学设计
课题2 氧气
课题2 氧气 课时 1 授课年级 初三
课标要求 1.通过实验探究认识氧气的主要性质,认识物质的性质与用途的关系。 2.了解物质性质包括物理性质和化学性质,知道可以从物质的存在、组成、变化和用途等视角认识物质的性质。 3.了解观察、实验,以及对事实进行归纳概括、分析解释等认识物质性质的基本方法。
教材 分析 本课题介绍了氧气的性质和一类重要的化学反应——化合反应。以氧气的化学性质为核心,通过氧气发生的一些具体的化学反应,归纳出化合反应的概念,并分析了氧化反应的一些特点。 对氧气化学性质的认识主要运用了实验、观察、思考、分析的思维过程,通过对比物质在空气和氧气中燃烧的不同现象,引导学生分析氧气的含量对反应程度的影响。学生第一次将化学实验与研究纯净物的性质结合起来,需要学习如何观察实验现象,如何分析实验现象得出结论。因此,方法的指导是本课的重要任务之一。还有通过本课学习要让学生逐步学会研究物质的一般思路和方法。 本课题设计了多个物质与氧气反应的文字表达式,为后面学习反应的化学方程式打下基础,教学时可以让学生练习书写。
学情分析 对于氧气,学生已经有了一些感性的知识,再经过前面对空气的学习,学生对氧气有了更深刻的认识,所以在知识背景上具备了学习本课题的条件。 通过前几节实验课,学生已具备了一定的实验操作能力、观察能力、语言表达能力,可以开始尝试培养学生的自主学习能力和分析能力,但是现时的学生对实验现象的准确描述、综合分析能力还有待于进一步提高。 因此在教学过程中应注意积极引导学生应用已掌握的基础知识,通过理论分析和推理判断来获得新知识,发展抽象思维能力。做好每一个演示实验和调动好学生的积极性,不断提供动脑的问题情景,提供动手的练习机会,让每个学生参与到学习中来是上好本课题的关键。 另外,本课是研究纯净物性质的起始课,怎样研究物质?学生在学习思路和方法上还存有欠缺,所以,要通过本课的学习使学生逐步了解学习物质性质的基本思路。
教学目标 1.通过观察和实验探究认识氧气的主要性质,学会描述化学反应中的一些现象。 2.初步学习运用比较、归纳等方法对化学反应有分类的认识,知道化合反应、氧化反应及缓慢氧化的定义。 3.通过总结归纳氧气的性质,初步形成研究物质的一般思路和方法。
教学重、难点 重点:氧气的化学性质以及化合反应的概念。 难点:1.理解氧气的化学性质比较活泼。 2.观察并准确描述化学反应中的现象。
核心素养 化学观念:知道化学变化有新物质生成,能根据物质与氧气反应的实验现象判断化学变化的发生。 化学思维:通过实验、观察、思考、分析的思维过程推理出氧气能支持燃烧的化学性质;通过对比、归纳、分析的思维过程总结化合反应、氧化反应的概念。 科学探究与实践:通过物质在空气和氧气中燃烧的实验,并对比分析不同现象,了解氧气的性质,知道实验是研究物质性质的重要方法,发展学生以实验为主的科学探究能力。 科学态度与责任:通过了解物质性质的研究思路与方法,发展对物质世界的探究欲,保持对化学学习和科学探究的浓厚兴趣。
教学过程
教学环节 教学活动 设计意图
环节一、 新课导入 【引入】空气是一种非常宝贵的资源,氧气是空气中一种重要的组分,氧气可以供给呼吸,也可以支持燃烧,所以氧气对地球生命及人类社会的发展有着极其重要的作用。 【问题】从物质分类来说,氧气是一种纯净物,有固定的物理性质和化学性质。那么氧气有哪些性质呢?如何探究氧气的性质?本节课就来解决这些问题。 通过问题导入引发学生讨论,激发学生探究氧气性质的兴趣。
环节二、 氧气的物理性质 【过渡】首先探究氧气的物理性质,对物质物理性质的探究,一般包括颜色、状态、气味、密度、溶解性、熔沸点等。 【学生活动】阅读教材P38第一段的内容,了解氧气的物理性质。 【问题】 氧气的密度和空气相比如何? 氧气能溶于水吗? 常温常压下,氧气的色、态、味是怎样的,降低温度后呢? 【总结】 1. 标准状况下,氧气的密度为1.429 g/L,,空气的密度为1.293 g/L。所以氧气的密度比空气略大。 2. 氧气能溶于水,但不易溶于水。在室温下,1 L水中只能溶解约30 mL氧气,所以家庭水族箱中需要经常补充氧气,以供给鱼儿呼吸。 3. 常温常压下,氧气是无色、无味的气体。在压强101 kPa时,氧气在-183 ℃时变为淡蓝色液体,在-218 ℃时变为淡蓝色固体。 【对应训练】下列关于氧气物理性质的描述不正确的是( ) A.鱼能在水中生存,说明氧气极易溶于水 B.液态氧是淡蓝色的,固态氧也是淡蓝色的 C.氧气的密度比空气略大 D.通常情况下,氧气是无色无味的气体 【答案】A 通过自主学习,并配合资料展示,让学生在理解的基础上认识氧气的物理性质,培养学生的自主分析能力和观察能力。
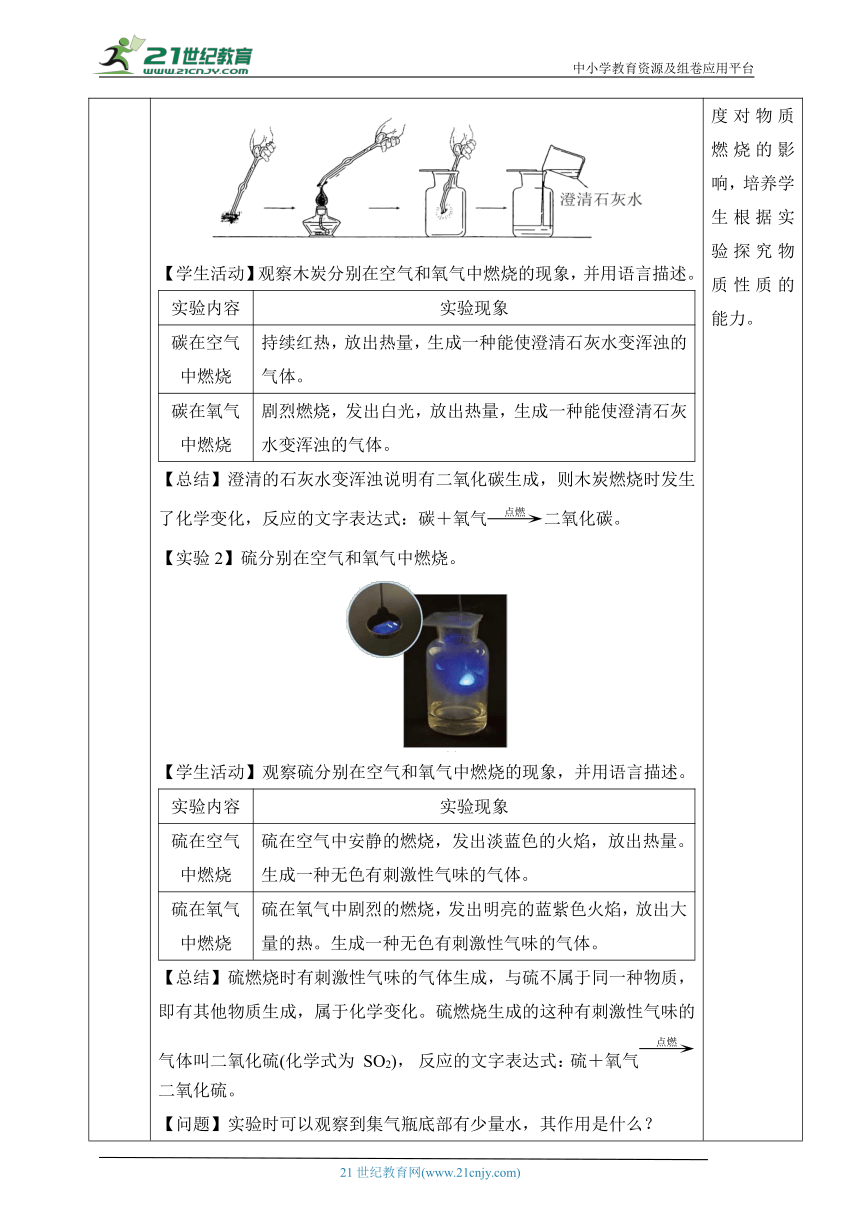
环节三、 氧气的化学性质 【过渡】物质的化学性质需要通过化学变化来体现,而判断物质的变化是否是化学变化需要验证是否有新物质生成。接下来继续探究氧气的化学性质。 【讲解】在学习氧气的用途时我们已经了解到氧气的性质之一是支持燃烧。为了让大家更形象化的知道氧气的助燃性,我们进行实验验证。 【实验】将带火星的木条伸入集气瓶中,观察木条能否复燃。 【活动】播放实验视频或学生动手实验,观察、描述并分析实验现象。 【总结】观察到带火星的木条伸入氧气瓶后,复燃。说明氧气可以使带有火星的木条复燃,即氧气支持燃烧。 【讲解】事实上,这就是我们最常用的氧气的检验方法。再强调一下,带有火星的木条能在氧气中复燃,说明氧气能支持燃烧,具有“助燃性”,另外需要注意的是,氧气本身是不能燃烧的。 【过渡】氧气能支持燃烧的性质我们还可以通过多组实验进行验证。 【实验1】木炭分别在空气和氧气中燃烧。 【学生活动】观察木炭分别在空气和氧气中燃烧的现象,并用语言描述。 实验内容实验现象碳在空气中燃烧持续红热,放出热量,生成一种能使澄清石灰水变浑浊的气体。碳在氧气中燃烧剧烈燃烧,发出白光,放出热量,生成一种能使澄清石灰水变浑浊的气体。
【总结】澄清的石灰水变浑浊说明有二氧化碳生成,则木炭燃烧时发生了化学变化,反应的文字表达式:碳+氧气二氧化碳。 【实验2】硫分别在空气和氧气中燃烧。 【学生活动】观察硫分别在空气和氧气中燃烧的现象,并用语言描述。 实验内容实验现象硫在空气中燃烧硫在空气中安静的燃烧,发出淡蓝色的火焰,放出热量。生成一种无色有刺激性气味的气体。硫在氧气中燃烧硫在氧气中剧烈的燃烧,发出明亮的蓝紫色火焰,放出大量的热。生成一种无色有刺激性气味的气体。
【总结】硫燃烧时有刺激性气味的气体生成,与硫不属于同一种物质,即有其他物质生成,属于化学变化。硫燃烧生成的这种有刺激性气味的气体叫二氧化硫(化学式为 SO2), 反应的文字表达式:硫+氧气二氧化硫。 【问题】实验时可以观察到集气瓶底部有少量水,其作用是什么? 【总结】二氧化硫易溶于水,可吸收二氧化硫,防止反应生成的二氧化硫有毒气体逸散到空气中,对空气产生污染。 【思考与讨论】木炭和硫分别在空气和氧气中燃烧的现象不同,这说明了什么 【总结】物质燃烧是与空气中的氧气发生反应,氧气的浓度越大,燃烧越剧烈,空气中氧气的含量低,所以在空气中燃烧没有在纯氧中剧烈。 【过渡】硫、木炭等既可以在空气中燃烧也可以在氧气中燃烧,那铁丝会燃烧吗? 【实验3】铁丝分别在空气和氧气中点燃。 【学生活动】观察并描述铁丝分别在空气和氧气中点燃后的现象。 实验内容实验现象铁丝在空气中燃烧空气中持续加热发红,离火后变冷,不能燃烧铁丝在氧气中燃烧剧烈燃烧,火星四射,放出大量的热,生成黑色固体
【总结】在空气中加热铁丝时,铁丝只能发生红热现象,不能燃烧;但在氧气里点燃细铁丝可发生剧烈燃烧,火星四射。铁与氧气反应生成黑色的四氧化三铁,属于化学变化。反应的文字表达式:铁+氧气四氧化三铁。 【问题】 1.集气瓶底为什么要先放少量水? 2.铁丝在空气中加热不能燃烧,而在氧气里燃烧,这说明了什么? 【总结】 1.集气瓶底要先放少量水是防止熔融的生成物溅入集气瓶瓶底,使集气瓶炸裂。也可用细沙替代。 2.说明反应物的浓度不但会影响反应的剧烈程度,有时还会影响反应是否能够发生。 【讲解】通过上面的探究我们知道,氧气支持燃烧,能够与多种物质发生反应,且氧气的浓度会影响反应的剧烈程度,化学性质比较活泼。氧气常被用作助燃剂,如液氧与液氢联合被用于运载火箭的推进剂。氧气在生产和生活中的应用非常广泛。 【对应训练1】下列物质在空气中无法燃烧的是( ) A.硫 B.木炭 C.红磷 D.铁丝 【对应训练2】下列有关实验现象的描述不正确的是( ) A.木炭在氧气中燃烧,发出白光 B.硫在空气中燃烧,产生淡蓝色火焰 C.磷在空气中燃烧,产生大量白烟 D.铁丝在空气中燃烧,火星四射,生成黑色四氧化三铁固体 【对应训练3】下列关于氧气的说法正确的是( ) A.能使带火星的木条复燃 B.易溶于水 C.可用作火箭燃料 D.物质与氧气的反应都很剧烈 【答案】1.D 2.D 3.A 通过木炭、硫、铁丝分别在空气和氧气中反应的现象,对比分析氧气对物质燃烧时所起的作用,归纳氧气的化学性质,并让学生进一步理解氧气的浓度对物质燃烧的影响,培养学生根据实验探究物质性质的能力。
环节四:化合反应和氧化反应 【思考与讨论】分析下列四个化学反应,有什么共同的特点? 木炭+氧气二氧化碳 硫+氧气二氧化硫 铁+氧气四氧化三铁 红磷+氧气五氧化二磷 【总结】 1.反应物是两种,生成物是一种; 2.反应物中都有氧气。 …… 【讲解】 1.化合反应 (1)定义:有两种或两种以上的物质生成另一种新物质的反应。 (2)特点:“多变一”。 2.氧化反应和缓慢氧化 (1)氧化反应:物质跟氧气发生的反应都属于氧化反应。 (2)缓慢氧化:进行得很慢,不容易被察觉的氧化反应叫缓慢氧化。 【补充】物质在氧气中的燃烧是较剧烈的氧化反应,但并不是所有的氧化反应都像燃烧那样剧烈并发光、放热。有些氧化反应进行得很慢,甚至不容易被察觉,这种氧化叫做缓慢氧化。如动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥料的腐熟等都包含物质的缓慢氧化。 【对应训练1】下列反应中,既是化合反应又是氧化反应的是( ) A.蜡烛+氧气二氧化碳+水 B.碳酸钙 氧化钙+二氧化碳 C.碳+氧气二氧化碳 D.高锰酸钾 锰酸钾+二氧化锰+氧气 【对应训练2】下列变化不属于缓慢氧化的是( ) A.食物变质 B.金属锈蚀 C. 光合作用 D.呼吸作用 【答案】1.C 2.C 【总结】研究物质性质的一般思路与方法。 看到一种物质,我们本能地会去观察它,看它有什么特征,什么颜色、状态等等。对于物质性质的研究,也是如此,我们一般先运用观察法来研究物质的外观性质,如颜色、气味、状态等。然后再应用实验进一步探究物质的溶解性、可燃性等不能直接观察到的性质。在实验中也需要观察、对比、分类等方法。 通过分析、讨论多个化学反应,让学生自主发现问题并总结规律,有助于学生对概念的理解。
课堂总结
板书 设计 课题2 氧气 一、氧气的物理性质 无色、无味、气体、不易溶于水、密度比空气大 二、氧气的化学性质 氧气化学性质比较活泼,能支持燃烧,氧气含量越高,物质燃烧得越剧烈 碳+氧气二氧化碳 硫+氧气二氧化硫 铁+氧气四氧化三铁 三、化合反应、氧化反应 化合反应:多变一 氧化反应:与氧气反应
教学 反思 本题的重点是通过实验探究氧气的化学性质,引导学生观察并描述实验现象,并通过现象分析物质的变化和所具有的性质,有利于培养学生的语言表达能力和分析归纳能力。 这节课成功的要点是要调控好课堂氛围,调动学生的主动性和积极性。师生合作融洽,才能达到良好的教学效果。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二单元《空气和氧气》教学设计
课题2 氧气
课题2 氧气 课时 1 授课年级 初三
课标要求 1.通过实验探究认识氧气的主要性质,认识物质的性质与用途的关系。 2.了解物质性质包括物理性质和化学性质,知道可以从物质的存在、组成、变化和用途等视角认识物质的性质。 3.了解观察、实验,以及对事实进行归纳概括、分析解释等认识物质性质的基本方法。
教材 分析 本课题介绍了氧气的性质和一类重要的化学反应——化合反应。以氧气的化学性质为核心,通过氧气发生的一些具体的化学反应,归纳出化合反应的概念,并分析了氧化反应的一些特点。 对氧气化学性质的认识主要运用了实验、观察、思考、分析的思维过程,通过对比物质在空气和氧气中燃烧的不同现象,引导学生分析氧气的含量对反应程度的影响。学生第一次将化学实验与研究纯净物的性质结合起来,需要学习如何观察实验现象,如何分析实验现象得出结论。因此,方法的指导是本课的重要任务之一。还有通过本课学习要让学生逐步学会研究物质的一般思路和方法。 本课题设计了多个物质与氧气反应的文字表达式,为后面学习反应的化学方程式打下基础,教学时可以让学生练习书写。
学情分析 对于氧气,学生已经有了一些感性的知识,再经过前面对空气的学习,学生对氧气有了更深刻的认识,所以在知识背景上具备了学习本课题的条件。 通过前几节实验课,学生已具备了一定的实验操作能力、观察能力、语言表达能力,可以开始尝试培养学生的自主学习能力和分析能力,但是现时的学生对实验现象的准确描述、综合分析能力还有待于进一步提高。 因此在教学过程中应注意积极引导学生应用已掌握的基础知识,通过理论分析和推理判断来获得新知识,发展抽象思维能力。做好每一个演示实验和调动好学生的积极性,不断提供动脑的问题情景,提供动手的练习机会,让每个学生参与到学习中来是上好本课题的关键。 另外,本课是研究纯净物性质的起始课,怎样研究物质?学生在学习思路和方法上还存有欠缺,所以,要通过本课的学习使学生逐步了解学习物质性质的基本思路。
教学目标 1.通过观察和实验探究认识氧气的主要性质,学会描述化学反应中的一些现象。 2.初步学习运用比较、归纳等方法对化学反应有分类的认识,知道化合反应、氧化反应及缓慢氧化的定义。 3.通过总结归纳氧气的性质,初步形成研究物质的一般思路和方法。
教学重、难点 重点:氧气的化学性质以及化合反应的概念。 难点:1.理解氧气的化学性质比较活泼。 2.观察并准确描述化学反应中的现象。
核心素养 化学观念:知道化学变化有新物质生成,能根据物质与氧气反应的实验现象判断化学变化的发生。 化学思维:通过实验、观察、思考、分析的思维过程推理出氧气能支持燃烧的化学性质;通过对比、归纳、分析的思维过程总结化合反应、氧化反应的概念。 科学探究与实践:通过物质在空气和氧气中燃烧的实验,并对比分析不同现象,了解氧气的性质,知道实验是研究物质性质的重要方法,发展学生以实验为主的科学探究能力。 科学态度与责任:通过了解物质性质的研究思路与方法,发展对物质世界的探究欲,保持对化学学习和科学探究的浓厚兴趣。
教学过程
教学环节 教学活动 设计意图
环节一、 新课导入 【引入】空气是一种非常宝贵的资源,氧气是空气中一种重要的组分,氧气可以供给呼吸,也可以支持燃烧,所以氧气对地球生命及人类社会的发展有着极其重要的作用。 【问题】从物质分类来说,氧气是一种纯净物,有固定的物理性质和化学性质。那么氧气有哪些性质呢?如何探究氧气的性质?本节课就来解决这些问题。 通过问题导入引发学生讨论,激发学生探究氧气性质的兴趣。
环节二、 氧气的物理性质 【过渡】首先探究氧气的物理性质,对物质物理性质的探究,一般包括颜色、状态、气味、密度、溶解性、熔沸点等。 【学生活动】阅读教材P38第一段的内容,了解氧气的物理性质。 【问题】 氧气的密度和空气相比如何? 氧气能溶于水吗? 常温常压下,氧气的色、态、味是怎样的,降低温度后呢? 【总结】 1. 标准状况下,氧气的密度为1.429 g/L,,空气的密度为1.293 g/L。所以氧气的密度比空气略大。 2. 氧气能溶于水,但不易溶于水。在室温下,1 L水中只能溶解约30 mL氧气,所以家庭水族箱中需要经常补充氧气,以供给鱼儿呼吸。 3. 常温常压下,氧气是无色、无味的气体。在压强101 kPa时,氧气在-183 ℃时变为淡蓝色液体,在-218 ℃时变为淡蓝色固体。 【对应训练】下列关于氧气物理性质的描述不正确的是( ) A.鱼能在水中生存,说明氧气极易溶于水 B.液态氧是淡蓝色的,固态氧也是淡蓝色的 C.氧气的密度比空气略大 D.通常情况下,氧气是无色无味的气体 【答案】A 通过自主学习,并配合资料展示,让学生在理解的基础上认识氧气的物理性质,培养学生的自主分析能力和观察能力。
环节三、 氧气的化学性质 【过渡】物质的化学性质需要通过化学变化来体现,而判断物质的变化是否是化学变化需要验证是否有新物质生成。接下来继续探究氧气的化学性质。 【讲解】在学习氧气的用途时我们已经了解到氧气的性质之一是支持燃烧。为了让大家更形象化的知道氧气的助燃性,我们进行实验验证。 【实验】将带火星的木条伸入集气瓶中,观察木条能否复燃。 【活动】播放实验视频或学生动手实验,观察、描述并分析实验现象。 【总结】观察到带火星的木条伸入氧气瓶后,复燃。说明氧气可以使带有火星的木条复燃,即氧气支持燃烧。 【讲解】事实上,这就是我们最常用的氧气的检验方法。再强调一下,带有火星的木条能在氧气中复燃,说明氧气能支持燃烧,具有“助燃性”,另外需要注意的是,氧气本身是不能燃烧的。 【过渡】氧气能支持燃烧的性质我们还可以通过多组实验进行验证。 【实验1】木炭分别在空气和氧气中燃烧。 【学生活动】观察木炭分别在空气和氧气中燃烧的现象,并用语言描述。 实验内容实验现象碳在空气中燃烧持续红热,放出热量,生成一种能使澄清石灰水变浑浊的气体。碳在氧气中燃烧剧烈燃烧,发出白光,放出热量,生成一种能使澄清石灰水变浑浊的气体。
【总结】澄清的石灰水变浑浊说明有二氧化碳生成,则木炭燃烧时发生了化学变化,反应的文字表达式:碳+氧气二氧化碳。 【实验2】硫分别在空气和氧气中燃烧。 【学生活动】观察硫分别在空气和氧气中燃烧的现象,并用语言描述。 实验内容实验现象硫在空气中燃烧硫在空气中安静的燃烧,发出淡蓝色的火焰,放出热量。生成一种无色有刺激性气味的气体。硫在氧气中燃烧硫在氧气中剧烈的燃烧,发出明亮的蓝紫色火焰,放出大量的热。生成一种无色有刺激性气味的气体。
【总结】硫燃烧时有刺激性气味的气体生成,与硫不属于同一种物质,即有其他物质生成,属于化学变化。硫燃烧生成的这种有刺激性气味的气体叫二氧化硫(化学式为 SO2), 反应的文字表达式:硫+氧气二氧化硫。 【问题】实验时可以观察到集气瓶底部有少量水,其作用是什么? 【总结】二氧化硫易溶于水,可吸收二氧化硫,防止反应生成的二氧化硫有毒气体逸散到空气中,对空气产生污染。 【思考与讨论】木炭和硫分别在空气和氧气中燃烧的现象不同,这说明了什么 【总结】物质燃烧是与空气中的氧气发生反应,氧气的浓度越大,燃烧越剧烈,空气中氧气的含量低,所以在空气中燃烧没有在纯氧中剧烈。 【过渡】硫、木炭等既可以在空气中燃烧也可以在氧气中燃烧,那铁丝会燃烧吗? 【实验3】铁丝分别在空气和氧气中点燃。 【学生活动】观察并描述铁丝分别在空气和氧气中点燃后的现象。 实验内容实验现象铁丝在空气中燃烧空气中持续加热发红,离火后变冷,不能燃烧铁丝在氧气中燃烧剧烈燃烧,火星四射,放出大量的热,生成黑色固体
【总结】在空气中加热铁丝时,铁丝只能发生红热现象,不能燃烧;但在氧气里点燃细铁丝可发生剧烈燃烧,火星四射。铁与氧气反应生成黑色的四氧化三铁,属于化学变化。反应的文字表达式:铁+氧气四氧化三铁。 【问题】 1.集气瓶底为什么要先放少量水? 2.铁丝在空气中加热不能燃烧,而在氧气里燃烧,这说明了什么? 【总结】 1.集气瓶底要先放少量水是防止熔融的生成物溅入集气瓶瓶底,使集气瓶炸裂。也可用细沙替代。 2.说明反应物的浓度不但会影响反应的剧烈程度,有时还会影响反应是否能够发生。 【讲解】通过上面的探究我们知道,氧气支持燃烧,能够与多种物质发生反应,且氧气的浓度会影响反应的剧烈程度,化学性质比较活泼。氧气常被用作助燃剂,如液氧与液氢联合被用于运载火箭的推进剂。氧气在生产和生活中的应用非常广泛。 【对应训练1】下列物质在空气中无法燃烧的是( ) A.硫 B.木炭 C.红磷 D.铁丝 【对应训练2】下列有关实验现象的描述不正确的是( ) A.木炭在氧气中燃烧,发出白光 B.硫在空气中燃烧,产生淡蓝色火焰 C.磷在空气中燃烧,产生大量白烟 D.铁丝在空气中燃烧,火星四射,生成黑色四氧化三铁固体 【对应训练3】下列关于氧气的说法正确的是( ) A.能使带火星的木条复燃 B.易溶于水 C.可用作火箭燃料 D.物质与氧气的反应都很剧烈 【答案】1.D 2.D 3.A 通过木炭、硫、铁丝分别在空气和氧气中反应的现象,对比分析氧气对物质燃烧时所起的作用,归纳氧气的化学性质,并让学生进一步理解氧气的浓度对物质燃烧的影响,培养学生根据实验探究物质性质的能力。
环节四:化合反应和氧化反应 【思考与讨论】分析下列四个化学反应,有什么共同的特点? 木炭+氧气二氧化碳 硫+氧气二氧化硫 铁+氧气四氧化三铁 红磷+氧气五氧化二磷 【总结】 1.反应物是两种,生成物是一种; 2.反应物中都有氧气。 …… 【讲解】 1.化合反应 (1)定义:有两种或两种以上的物质生成另一种新物质的反应。 (2)特点:“多变一”。 2.氧化反应和缓慢氧化 (1)氧化反应:物质跟氧气发生的反应都属于氧化反应。 (2)缓慢氧化:进行得很慢,不容易被察觉的氧化反应叫缓慢氧化。 【补充】物质在氧气中的燃烧是较剧烈的氧化反应,但并不是所有的氧化反应都像燃烧那样剧烈并发光、放热。有些氧化反应进行得很慢,甚至不容易被察觉,这种氧化叫做缓慢氧化。如动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥料的腐熟等都包含物质的缓慢氧化。 【对应训练1】下列反应中,既是化合反应又是氧化反应的是( ) A.蜡烛+氧气二氧化碳+水 B.碳酸钙 氧化钙+二氧化碳 C.碳+氧气二氧化碳 D.高锰酸钾 锰酸钾+二氧化锰+氧气 【对应训练2】下列变化不属于缓慢氧化的是( ) A.食物变质 B.金属锈蚀 C. 光合作用 D.呼吸作用 【答案】1.C 2.C 【总结】研究物质性质的一般思路与方法。 看到一种物质,我们本能地会去观察它,看它有什么特征,什么颜色、状态等等。对于物质性质的研究,也是如此,我们一般先运用观察法来研究物质的外观性质,如颜色、气味、状态等。然后再应用实验进一步探究物质的溶解性、可燃性等不能直接观察到的性质。在实验中也需要观察、对比、分类等方法。 通过分析、讨论多个化学反应,让学生自主发现问题并总结规律,有助于学生对概念的理解。
课堂总结
板书 设计 课题2 氧气 一、氧气的物理性质 无色、无味、气体、不易溶于水、密度比空气大 二、氧气的化学性质 氧气化学性质比较活泼,能支持燃烧,氧气含量越高,物质燃烧得越剧烈 碳+氧气二氧化碳 硫+氧气二氧化硫 铁+氧气四氧化三铁 三、化合反应、氧化反应 化合反应:多变一 氧化反应:与氧气反应
教学 反思 本题的重点是通过实验探究氧气的化学性质,引导学生观察并描述实验现象,并通过现象分析物质的变化和所具有的性质,有利于培养学生的语言表达能力和分析归纳能力。 这节课成功的要点是要调控好课堂氛围,调动学生的主动性和积极性。师生合作融洽,才能达到良好的教学效果。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
