4.2.1电解池原理 课件(共24张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1电解池原理 课件(共24张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-18 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第四章 化学反应与电能
第二节 电解池
第一课时 电解池原理
新课导入
新课导入
问:化学能直接转化为电能的装置叫原电池,那么是否有一种装置将电能直接转化成化学能了?
原电池
电解池
1800年,英国的尼科尔逊和卡里斯尔获得电解水的成功。
1807年,英国化学家戴维铂用电极电解熔融的氢氧化钾发现了钾元素,随后用电解法又相继发现了钠、钙、锶、钡等元素。
电能直接转化为化学能的装置—电解池
电解原理
【实验探究】课本实验4-2:电解CuCl2溶液
1.先观察两根石墨棒底部,再插入CuCl2溶液中,接通电源。
2.用镊子将碘化钾淀粉试纸湿润后,伸入与正极相连的U型管内部(不可接触溶液),约1-2分钟。
3.观察与正极相连的电极、与负极相连的电极上分别有什么现象?
4.断开电源,将两根石墨棒从溶液中取出,将蘸有氢氧化钠溶液的棉花团堵在和正极相连的U型管口,观察电极底部有什么变化?
操作步骤:
电解原理
电解原理
与正极相连的电极 与负极相连的电极
现象
判断产物
反应方程式 氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
CuCl2 === Cu + Cl2↑
通电
【实验现象】
C
CuCl2溶液
+
-
C
电解原理
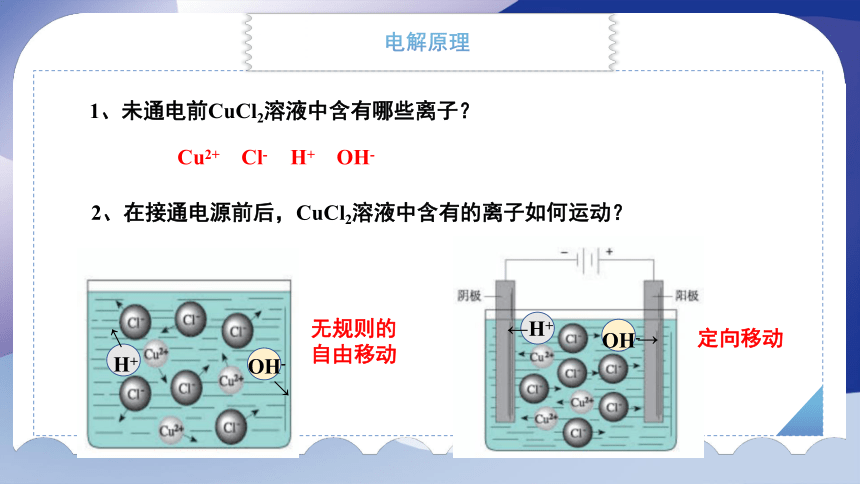
1、未通电前CuCl2溶液中含有哪些离子?
Cu2+ Cl- H+ OH-
2、在接通电源前后,CuCl2溶液中含有的离子如何运动?
OH-
H+
←
→
定向移动
无规则的自由移动
H+
←
OH-
→
电解原理
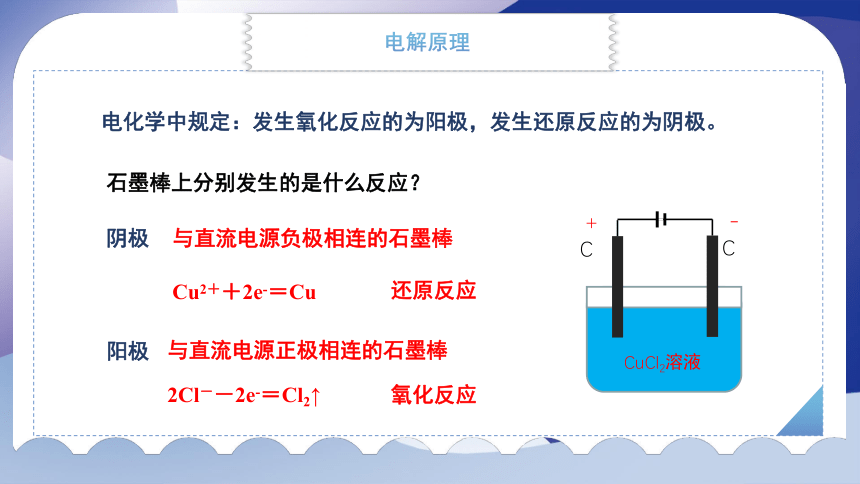
电化学中规定:发生氧化反应的为阳极,发生还原反应的为阴极。
与直流电源正极相连的石墨棒
石墨棒上分别发生的是什么反应?
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
阴极
阳极
还原反应
与直流电源负极相连的石墨棒
氧化反应
C
CuCl2溶液
+
-
C
电解原理
1、电解:让直流电通过电解质溶液(或熔融电解质),在阳极、阴极引起氧化还原反应的过程叫做电解。
2、放电:当离子到达电极时,失去/获得电子,发生氧化/还原反应的过程叫做放电。
3、电解池(电解槽):
(1)定义:把电能转化成化学能的装置。
(2)构成:
①直流电源
②阴、阳极
③电解质溶液或熔融电解质
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
电解原理
e-
e-
阳极
阴极
阳离子迁移方向
阴离子迁移方向
+ -
直流电源
发生氧化反应
发生还原反应
电极材料
电极反应
电子导体
离子导体
4. 电解池工作原理:
电解原理
5.电离与电解的比较
电离(物变) 电解(化变)
条件 电解质溶于水或受热融化状态 电解质电离后,再通直流电
过程 电解质电离成为自由移动的离子 阴阳离子定向移动,在两极上放电
举例 CuCl2=Cu2++2Cl-
CuCl2 = Cu+Cl2↑
特点 只产生自由移动的离子 发生氧化还原反应,形成新物质
联系 电解必须建立在电离的基础上
电解原理
6.放电顺序
电解原理
6.放电顺序
(1)阳极放电顺序
失电子—氧化反应
①活性金属电极(除Pt、Au外):
②惰性电极(Pt、Au、石墨):
金属电极优先失电子
阴离子失电子
问:金属单质与非金属阴离子失电子谁强?
S2->I->Br->Cl->OH->含氧酸根离子
电解原理
6.放电顺序
(2)阴极放电顺序
得电子—还原反应
阴极电极本身不参与反应
越活泼的金属,其阳离子越难得到电子
Ag+>Hg2+>Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
问:电极能得电子发生还原反应吗?
随堂训练
6.放电顺序
①水溶液中,K+、Na+、Mg2+、AI3+等离子不可能在阴极放电,即用电解相应水溶液的方法不可能得到K、Na、Mg、Al等活泼金属。
②电解池的阴极不管是惰性电极(Pt、石墨)还是活性电极,都是电解质溶液(或熔融电解质)中的阳离子放电,电极本身不可能溶解。
③若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH -放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。
④电解质溶液恢复原状的方法:少什么加什么,少多少加多少。
随堂训练
7.常见电解池类型
①电解电解质型
实质:电解质本身被电解
增大
通入HCl
溶液pH变化:
溶液复原方法:
电解盐酸:
无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2等)溶液的电解
阴极:2H+ + 2e-=H2↑
阳极:2Cl- -2e-=Cl2↑
总反应:2HCl = Cl2↑+H2↑
随堂训练
7.常见电解池类型
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
减小
阳极
阴极
氧气
铜
CuSO4溶液
总反应:2CuSO4+ 2H2O ===== 2Cu +O2 ↑+ 2H2SO4
电解
②放氧生酸型(放出氧气生成氢离子)
不活泼金属的含氧酸盐 (如CuSO4、AgNO3等)溶液的电解。
电解CuSO4溶液:
溶液浓度:
减小
加CuO
溶液pH变化:
溶液复原方法:
随堂训练
7.常见电解池类型
阳极
阴极
氯气
氢
气
NaCl溶液
③放氢生碱型(放出氢气生成碱)
活泼金属的无氧酸盐(如NaCl、K2S等)溶液的电解
阳极: 2Cl- - 2e- = Cl 2↑
阴极:2H ++ 2e- =H2 ↑
减小
电解NaCl溶液:
溶液浓度:
增大
加HCl
溶液pH变化:
溶液复原方法:
总反应:2NaCl+2H2O ==== 2NaOH+H2 ↑ + Cl2 ↑
电解
随堂训练
7.常见电解池类型
阳极
阴极
氧气
氢
气
Na2SO4溶液
④电解水型(电解质不反应)
含氧酸、强碱、活泼金属的含氧酸盐(如H2SO4、NaOH、Na2SO4 等)的电解。
阳极: 4OH- - 4e- =2H2O+O2↑
阴极:4H ++ 4e- = 2H2 ↑
变大
电解Na2SO4溶液:
溶液浓度:
减小
加H2O
溶液pH变化:
溶液复原方法:
总反应:2H2O ===== 2H2 ↑ + O2 ↑
电解
电解原理
电解池(电能转化为化学能)
原电池(化学能转化为电能 )
8.原电池和电解池的区别
随堂训练
1.下列属于原电池的是( ) 属于电解池的是( )
①③⑤
⑥⑦
随堂训练
2.某同学将电解池工作时电子、离子的移动方向及电极种类等信息表示在
下图中,下列有关分析完全正确的是( )
选项 A B C D
电极 阳极 阴极 阳极 阴极
电极 正极 正极 负极 负极
离子 阳离子 阳离子 阴离子 阴离子
B
随堂训练
3. 要实现反应:Cu+2HCl=CuCl2+H2↑,设计了下列四个实验,你认为可行的是( )
C
随堂训练
4.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:
Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
D
第四章 化学反应与电能
第二节 电解池
第一课时 电解池原理
新课导入
新课导入
问:化学能直接转化为电能的装置叫原电池,那么是否有一种装置将电能直接转化成化学能了?
原电池
电解池
1800年,英国的尼科尔逊和卡里斯尔获得电解水的成功。
1807年,英国化学家戴维铂用电极电解熔融的氢氧化钾发现了钾元素,随后用电解法又相继发现了钠、钙、锶、钡等元素。
电能直接转化为化学能的装置—电解池
电解原理
【实验探究】课本实验4-2:电解CuCl2溶液
1.先观察两根石墨棒底部,再插入CuCl2溶液中,接通电源。
2.用镊子将碘化钾淀粉试纸湿润后,伸入与正极相连的U型管内部(不可接触溶液),约1-2分钟。
3.观察与正极相连的电极、与负极相连的电极上分别有什么现象?
4.断开电源,将两根石墨棒从溶液中取出,将蘸有氢氧化钠溶液的棉花团堵在和正极相连的U型管口,观察电极底部有什么变化?
操作步骤:
电解原理
电解原理
与正极相连的电极 与负极相连的电极
现象
判断产物
反应方程式 氯气
铜
产生使湿润的碘化钾淀粉试纸变蓝的气体
有红色物质出现
CuCl2 === Cu + Cl2↑
通电
【实验现象】
C
CuCl2溶液
+
-
C
电解原理
1、未通电前CuCl2溶液中含有哪些离子?
Cu2+ Cl- H+ OH-
2、在接通电源前后,CuCl2溶液中含有的离子如何运动?
OH-
H+
←
→
定向移动
无规则的自由移动
H+
←
OH-
→
电解原理
电化学中规定:发生氧化反应的为阳极,发生还原反应的为阴极。
与直流电源正极相连的石墨棒
石墨棒上分别发生的是什么反应?
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
阴极
阳极
还原反应
与直流电源负极相连的石墨棒
氧化反应
C
CuCl2溶液
+
-
C
电解原理
1、电解:让直流电通过电解质溶液(或熔融电解质),在阳极、阴极引起氧化还原反应的过程叫做电解。
2、放电:当离子到达电极时,失去/获得电子,发生氧化/还原反应的过程叫做放电。
3、电解池(电解槽):
(1)定义:把电能转化成化学能的装置。
(2)构成:
①直流电源
②阴、阳极
③电解质溶液或熔融电解质
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
电解原理
e-
e-
阳极
阴极
阳离子迁移方向
阴离子迁移方向
+ -
直流电源
发生氧化反应
发生还原反应
电极材料
电极反应
电子导体
离子导体
4. 电解池工作原理:
电解原理
5.电离与电解的比较
电离(物变) 电解(化变)
条件 电解质溶于水或受热融化状态 电解质电离后,再通直流电
过程 电解质电离成为自由移动的离子 阴阳离子定向移动,在两极上放电
举例 CuCl2=Cu2++2Cl-
CuCl2 = Cu+Cl2↑
特点 只产生自由移动的离子 发生氧化还原反应,形成新物质
联系 电解必须建立在电离的基础上
电解原理
6.放电顺序
电解原理
6.放电顺序
(1)阳极放电顺序
失电子—氧化反应
①活性金属电极(除Pt、Au外):
②惰性电极(Pt、Au、石墨):
金属电极优先失电子
阴离子失电子
问:金属单质与非金属阴离子失电子谁强?
S2->I->Br->Cl->OH->含氧酸根离子
电解原理
6.放电顺序
(2)阴极放电顺序
得电子—还原反应
阴极电极本身不参与反应
越活泼的金属,其阳离子越难得到电子
Ag+>Hg2+>Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
问:电极能得电子发生还原反应吗?
随堂训练
6.放电顺序
①水溶液中,K+、Na+、Mg2+、AI3+等离子不可能在阴极放电,即用电解相应水溶液的方法不可能得到K、Na、Mg、Al等活泼金属。
②电解池的阴极不管是惰性电极(Pt、石墨)还是活性电极,都是电解质溶液(或熔融电解质)中的阳离子放电,电极本身不可能溶解。
③若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH -放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。
④电解质溶液恢复原状的方法:少什么加什么,少多少加多少。
随堂训练
7.常见电解池类型
①电解电解质型
实质:电解质本身被电解
增大
通入HCl
溶液pH变化:
溶液复原方法:
电解盐酸:
无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2等)溶液的电解
阴极:2H+ + 2e-=H2↑
阳极:2Cl- -2e-=Cl2↑
总反应:2HCl = Cl2↑+H2↑
随堂训练
7.常见电解池类型
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
减小
阳极
阴极
氧气
铜
CuSO4溶液
总反应:2CuSO4+ 2H2O ===== 2Cu +O2 ↑+ 2H2SO4
电解
②放氧生酸型(放出氧气生成氢离子)
不活泼金属的含氧酸盐 (如CuSO4、AgNO3等)溶液的电解。
电解CuSO4溶液:
溶液浓度:
减小
加CuO
溶液pH变化:
溶液复原方法:
随堂训练
7.常见电解池类型
阳极
阴极
氯气
氢
气
NaCl溶液
③放氢生碱型(放出氢气生成碱)
活泼金属的无氧酸盐(如NaCl、K2S等)溶液的电解
阳极: 2Cl- - 2e- = Cl 2↑
阴极:2H ++ 2e- =H2 ↑
减小
电解NaCl溶液:
溶液浓度:
增大
加HCl
溶液pH变化:
溶液复原方法:
总反应:2NaCl+2H2O ==== 2NaOH+H2 ↑ + Cl2 ↑
电解
随堂训练
7.常见电解池类型
阳极
阴极
氧气
氢
气
Na2SO4溶液
④电解水型(电解质不反应)
含氧酸、强碱、活泼金属的含氧酸盐(如H2SO4、NaOH、Na2SO4 等)的电解。
阳极: 4OH- - 4e- =2H2O+O2↑
阴极:4H ++ 4e- = 2H2 ↑
变大
电解Na2SO4溶液:
溶液浓度:
减小
加H2O
溶液pH变化:
溶液复原方法:
总反应:2H2O ===== 2H2 ↑ + O2 ↑
电解
电解原理
电解池(电能转化为化学能)
原电池(化学能转化为电能 )
8.原电池和电解池的区别
随堂训练
1.下列属于原电池的是( ) 属于电解池的是( )
①③⑤
⑥⑦
随堂训练
2.某同学将电解池工作时电子、离子的移动方向及电极种类等信息表示在
下图中,下列有关分析完全正确的是( )
选项 A B C D
电极 阳极 阴极 阳极 阴极
电极 正极 正极 负极 负极
离子 阳离子 阳离子 阴离子 阴离子
B
随堂训练
3. 要实现反应:Cu+2HCl=CuCl2+H2↑,设计了下列四个实验,你认为可行的是( )
C
随堂训练
4.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:
Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
D
