江苏省镇江市2023-2024学年高一下学期6月期末考试化学试题(PDF版含答案)
文档属性
| 名称 | 江苏省镇江市2023-2024学年高一下学期6月期末考试化学试题(PDF版含答案) |
|
|
| 格式 | |||
| 文件大小 | 571.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-18 16:11:17 | ||
图片预览



文档简介
镇江市 2023~2024学年第二学期高一期末质量监测
化学试卷 2024.06
注意事项:
1.本试卷分为选择题和非选择题两部分,共 100分,考试时间 75分钟。
2.将选择题的答案填涂在答题卡的对应位置上,非选择题的答案写在答题卡的指定栏目
内。
可能用到的相对原子质量:H1 O16 Na23 S32 Fe56 Cu64
一、单项选择题:共 13题,每题 3分,共 39分。每题只有一个选项最符合题意。
1.指南针是中国古代四大发明之一,由天然磁石制成,其主要成分为
A.Fe B.Fe3O4 C.FeO D.Fe2O3
△
2.反应 LiH + NH3 LiNH2 + H2可制备化工试剂 LiNH2。下列说法正确的是
A.LiH 属于共价晶体 B.NH3的电子式为
C.NH 2的 VSEPR 模型为正四面体形 D.H2分子含有 p p�键
3.实验室制取并验证 SO2性质,如图实验原理及装置不.能.达到实验目的的是
A.用装置甲制备 SO2 B.用装置乙验证 SO2的还原性和氧化性
C.用装置丙验证 SO2的漂白性 D.用装置丁吸收 SO2
4.NH4Al(SO4)2 12H2O 可用作净水剂、媒染剂等。下列说法正确的是
A.原子半径:�(Al) > �(N) B.电负性:�(N) > �(O)
C.第一电离能:�1(S) < �1(Al) D.热稳定性:H2S(g) > H2O(g)
阅读材料,完成 5~7题:
N、P 为第ⅤA族元素。NH3是氮的常见氢化物,液氨可部分电离产生 NH +2和 NH4,氨水与 Ag
+形成
Ag(NH3)2OH;NH3可转化为 NO、NO2、HNO3等。磷单质主要有红磷、白磷和黑磷,黑磷具有类似石墨的
片状结构,称之为“金属磷”;PCl5为离子晶体,其晶胞结构如图所示,PCl5溶于水生成两种常见的酸。
5.下列说法不.正.确.的是
A.NH+4键角约为 1���5�
B.液氨电离可表示为:2NH3 NH+4 +NH
2
C.PCl5晶胞中含有 PCl 6与 PCl
+
4两种离子 D.红磷、白磷、黑磷互为同分异构体
6.下列化学反应的表示不.正.确.的是
点燃
A.P 在 Cl2中完全燃烧:2P + 5Cl2 2PCl5
B.PCl5溶于水:PCl5 + 4H2O = H3PO4 + 5HCl
光照
C.HNO3见光分解:4HNO3 4NO2 ↑+ O2 ↑+ 2H2O
D.向 AgNO3溶液加入过量氨水:Ag+ + NH3 H2O = AgOH+ NH+4
7.下列物质结构与性质或性质与用途具有对应关系的是
A.黑磷具有类似石墨片层结构,可用于导电 B.NH3极易溶于水,液氨可用作制冷剂
C.NH4Cl 受热易分解,可用作氮肥 D.稀硝酸具有强氧化性,可用铁罐车运输
8.元素及其化合物的转化在工业上具有重要应用。下列涉及的物质转化正确的是
A.侯氏制碱:
B.制备硝酸:
C.制备硫酸:
D.制漂白粉:
9.X、Y、Z、M 为 4种原子序数逐渐增大的短周期元素。X 基态原子的核外电子只有 1种运动状态,Y 的
单质是空气中含量最多的物质,Z 最外层电子是其电子层数的 3倍,Z 与 M 上下相邻。下列说法正确的是
A.X 在化合物中均显+ 1 价 B.Y、M 的最高价氧化物对应的水化物均为强酸
C.X、Y 和 Z 不可能形成离子晶体 D.X 和 Z 形成的化合物不可能含有非极性键
10.根据海水综合利用的工业流程图,下列说法正确的是
A.试剂Ⅰ为 NaOH 溶液 B.操作Ⅰ为过滤、洗涤、干燥
C.步骤Ⅰ、Ⅱ的目的是富集 Br D.步骤Ⅲ的反应 Br + Cl2 = Br2 + Cl
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 用洁净的铂丝蘸取溶液进行焰色试验,火焰呈黄色 该溶液中含有 Na+,不含K+
B 向某溶液中加入盐酸酸化无现象,再加入 BaCl2溶液,产 该溶液中含有 SO2 4
生白色沉淀
C 某溶液中加入稀 NaOH 溶液,将湿润的红色石蕊试纸置 该溶液不含 NH+4
于试管口,试纸未变蓝色
D 向盛有淀粉、KI 的溶液中滴加 HNO3酸化的 Fe(NO3)3溶 Fe3+氧化性强于I2
液,振荡,溶液变蓝
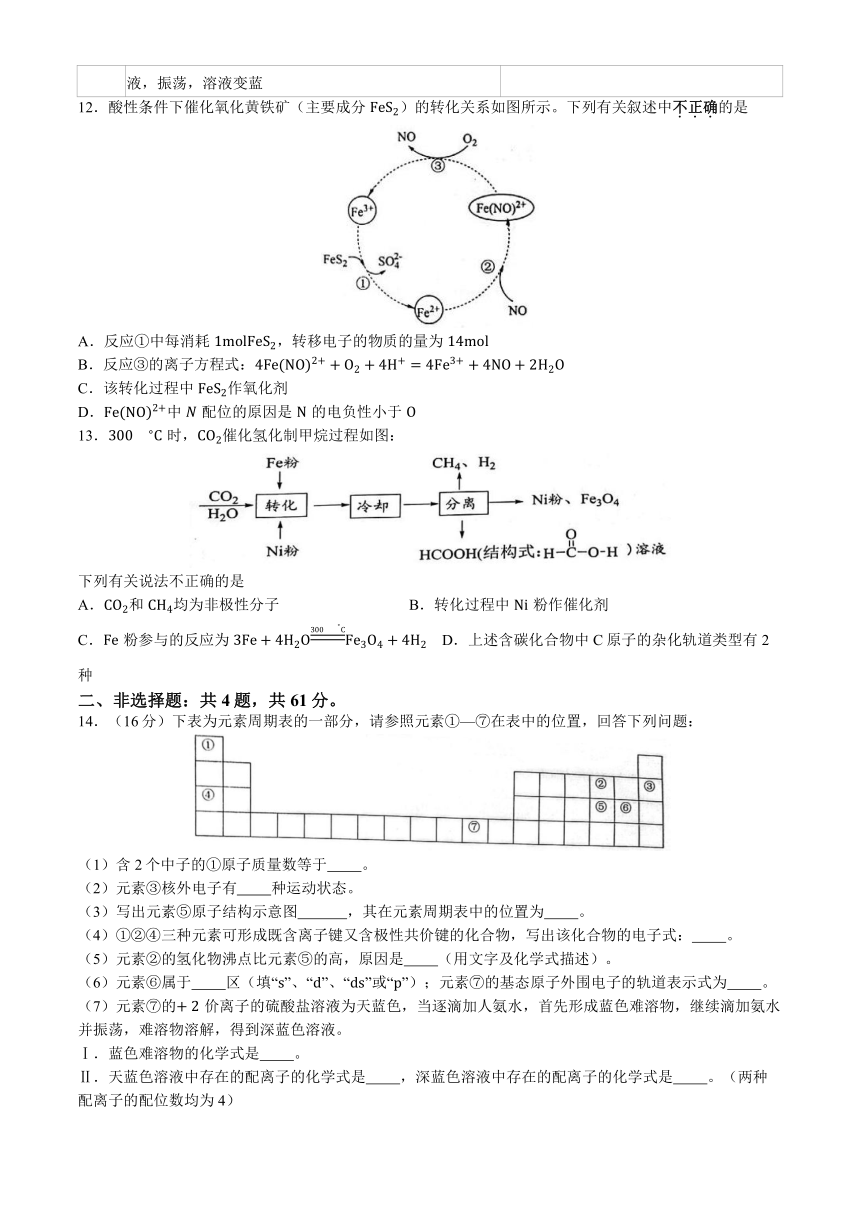
12.酸性条件下催化氧化黄铁矿(主要成分 FeS2)的转化关系如图所示。下列有关叙述中不.正.确.的是
A.反应①中每消耗 1molFeS2,转移电子的物质的量为 14mol
B.反应③的离子方程式:4Fe(NO)2+ + O2 + 4H+ = 4Fe3+ + 4NO+ 2H2O
C.该转化过程中 FeS2作氧化剂
D.Fe(NO)2+中 � 配位的原因是 N 的电负性小于 O
13.3��� C 时,CO2催化氢化制甲烷过程如图:
下列有关说法不正确的是
A.CO2和 CH4均为非极性分子 B.转化过程中 Ni 粉作催化剂
3�� C
C.Fe 粉参与的反应为 3Fe + 4H2O Fe3O4 + 4H2 D.上述含碳化合物中 C原子的杂化轨道类型有 2
种
二、非选择题:共 4题,共 61分。
14.(16分)下表为元素周期表的一部分,请参照元素①—⑦在表中的位置,回答下列问题:
(1)含 2个中子的①原子质量数等于 。
(2)元素③核外电子有 种运动状态。
(3)写出元素⑤原子结构示意图 ,其在元素周期表中的位置为 。
(4)①②④三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: 。
(5)元素②的氢化物沸点比元素⑤的高,原因是 (用文字及化学式描述)。
(6)元素⑥属于 区(填“s”、“d”、“ds”或“p”);元素⑦的基态原子外围电子的轨道表示式为 。
(7)元素⑦的+ 2 价离子的硫酸盐溶液为天蓝色,当逐滴加人氨水,首先形成蓝色难溶物,继续滴加氨水
并振荡,难溶物溶解,得到深蓝色溶液。
Ⅰ.蓝色难溶物的化学式是 。
Ⅱ.天蓝色溶液中存在的配离子的化学式是 ,深蓝色溶液中存在的配离子的化学式是 。(两种
配离子的配位数均为 4)
(8)若向元素⑦的+ 2 价离子的硫酸盐里逐滴加入氢氧化钠溶液,首先形成蓝色难溶物,最终得到绛蓝色
溶液(溶质为配位数为 4的配合物)。
Ⅰ.不考虑空间构型,画出该配合物的结构示意图 。
Ⅱ.写出向蓝色难溶物中继续滴入氢氧化钠溶液,最终得到绛蓝色溶液的离子方程式 。
15.(15分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其结构式为 。
(2)过量 NH3和F2在铜催化作用下反应生成 NF3,NH3中 N 原子的杂化方式为 ,NF3分子的空间构型
为 。
(3)NH3和 Fe 在 64�� C 可发生置换反应,产物之一的晶胞结构如图所示。晶胞中距离 Fe 最近的 Fe 原
子有 个,写出该反应的化学方程式: 。
(4)叠氮化钠(NaN3)分解反应为 2NaN3(s) = 2Na(l) + 3N2(g),下列有关说法正确的是 (填字
母)。
a.熔融态的 NaN3能导电
b.�� 属于金属晶体
c.常温下,N2很稳定,是因为 N 的电负性大
(5)CN 与 Mn2+、Co3+形成的配合物Mn3[Co(CN)6]2用作核磁共振的造影剂。
①Mn3[Co(CN)6]2中心离子是 ,配位数为 。
②CN 离子中π键和�键的个数比为 。
16.(16分)科技进步促进了铁盐系列水处理剂的发展。
(一)FeCl3是简单无机铁处理剂。
(1)与明矾净水原理相似,FeCl3净水的原理是 (用恰当文字回答),可用 实验来验证。
SOCl2
(2)由 FeCl3 6H2O 制备无水 FeCl3的过程为 FeCl3 6H O�2 FeCl3,SOCl2与H2O 反应生成两种有刺激性气
△
味的气体,写出该反应的化学方程式: 。
(二)K2FeO4(高铁酸钾)是多功能水处理剂。
(1)碱性条件下,FeCl3溶液与 KClO 溶液反应可得到高铁酸钾,该反应的离子方程式为 。
(2)已知K2FeO4水溶液放置过程中会放出无色无味气体、产生沉淀,且所得溶液呈强碱性。检验该沉淀
中金属元素的实验方案为 。(实验中必须使用的药品:稀盐酸、KSCN 溶液)
(三)[Fe2(OH)n(SO4)3 n/2]m(聚合硫酸铁 PFS)是新型无机高分子水处理剂。以 FeSO4溶液为原料,通
入空气氧化,再经水解、聚合反应可得 PFS。
(1)实验室配制 FeSO4溶液时常加入少量铁粉,其作用是 。
(2)用聚合硫酸铁 PFS 进行模拟净化高岭土废水(用高岭土与自来水配制而成,其质量浓度为 1��mg
L 1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及 pH 的影响如图-1和图-2所示:
可知聚合硫酸铁 PFS 最佳投加量是 ,最佳 pH 是 。
(3)已知:①聚合硫酸铁一级品质总铁含量性能指标要求:铁的质量分数大于 11��%。
②MnO 4 + 5Fe
2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取 1�5��g 该聚合硫酸铁样品溶于适量硫酸,配成 1�����mL 溶液 A。
b.准确量取 2����mL 溶液 A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤液合并配成溶液 B
c.用 ���1��mol L 1的酸性 KMnO4溶液滴加到溶液 B中至恰好反应完全,消耗酸性 KMnO4溶液
13�2�mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求。
17.(14分)氨氮(NH+4 )与硝氮(NO
3 )是含氮废水中常见的氮元素存在形态。
(一)除氨氮(NH+4 )
(1)沉淀法
Mg2+、PO3 4 氨氮生成 MgNH4PO4 6H2O 沉淀可达到去除氨氮的目的。
已知:ⅰ.磷酸根在 pH = 8 1� 时主要存在形式为 HPO2 4 ;
ⅱ.Mg3(PO4)2为沉淀
①请写出 pH = � 时,沉淀法去除 NH+4离子方程式为 。
②氨氮去除率与含磷微粒浓度随 pH 变化如图-1所示,解释 pH > 1� 时氨氮去除率随 pH 变化的原
因: 。
(2)氧化法
废水中加入适量的 NaClO 溶液,控制 pH 在 6 �,可将氨氮转化为无毒物质,该过程发生了 3个反应:
ⅰ.ClO + H+ = HClO
ⅱ.NH+4 + HClO = NH2Cl + H
+ + H2O(非氧化还原反应)
ⅲ.2NH2Cl + HClO = N + 2 + 3H + 3Cl + H2O
①为了完全从废水中去除氨氮,加入的 NaClO 与水体中 NH+4物质的量之比最小是 。
②已知:水体中以+ 1 价形式存在的氯元素有杀菌消毒的作用,被称为“余氯”,该水体中的“余氯”除 ClO
外还有 。(写.化.学.式.)
③为研究空气对 NaClO 氧化氨氮的影响,其他条件不变,增加单位时间内通入空气的量,发现氨氮去除率
几乎不变。其原因可能是 (填字母)。
a.O2的氧化性比 NaClO 弱 b.空气中的N2进入溶液中 c.O2在溶液中溶解度比较小
(二)除硝氮(NO 3 )
(3)催化还原法
在W Cu/Al2O3的催化条件下,使用H2作为还原剂,可将水中的 NO 3转化为N2。该反应机理分为三步,
如图-2所示:第一步:NO 在 Cu 表面被还原为 NO ,Cu 被氧化为 CuO;第二步:NO 2 2从 Cu 表面迁移至
W 的表面;
①第三步: 。(请描述虚框内的 2个反应机理,“W H”表示吸附在W 表面的活性 H 原子)
②若改用 Pd Cu/Al2O3作为还原硝酸盐过程的催化剂,其催化机理与W Cu/Al2O3相似。但还原过程中
检测到三种含氮化合物微粒,其浓度变化如图-3所示,在 1�5 2�5h 过程中,硝酸根(NO 3 )部分转化为
NH+4的可能原因是 。
化学试卷 2024.06
注意事项:
1.本试卷分为选择题和非选择题两部分,共 100分,考试时间 75分钟。
2.将选择题的答案填涂在答题卡的对应位置上,非选择题的答案写在答题卡的指定栏目
内。
可能用到的相对原子质量:H1 O16 Na23 S32 Fe56 Cu64
一、单项选择题:共 13题,每题 3分,共 39分。每题只有一个选项最符合题意。
1.指南针是中国古代四大发明之一,由天然磁石制成,其主要成分为
A.Fe B.Fe3O4 C.FeO D.Fe2O3
△
2.反应 LiH + NH3 LiNH2 + H2可制备化工试剂 LiNH2。下列说法正确的是
A.LiH 属于共价晶体 B.NH3的电子式为
C.NH 2的 VSEPR 模型为正四面体形 D.H2分子含有 p p�键
3.实验室制取并验证 SO2性质,如图实验原理及装置不.能.达到实验目的的是
A.用装置甲制备 SO2 B.用装置乙验证 SO2的还原性和氧化性
C.用装置丙验证 SO2的漂白性 D.用装置丁吸收 SO2
4.NH4Al(SO4)2 12H2O 可用作净水剂、媒染剂等。下列说法正确的是
A.原子半径:�(Al) > �(N) B.电负性:�(N) > �(O)
C.第一电离能:�1(S) < �1(Al) D.热稳定性:H2S(g) > H2O(g)
阅读材料,完成 5~7题:
N、P 为第ⅤA族元素。NH3是氮的常见氢化物,液氨可部分电离产生 NH +2和 NH4,氨水与 Ag
+形成
Ag(NH3)2OH;NH3可转化为 NO、NO2、HNO3等。磷单质主要有红磷、白磷和黑磷,黑磷具有类似石墨的
片状结构,称之为“金属磷”;PCl5为离子晶体,其晶胞结构如图所示,PCl5溶于水生成两种常见的酸。
5.下列说法不.正.确.的是
A.NH+4键角约为 1���5�
B.液氨电离可表示为:2NH3 NH+4 +NH
2
C.PCl5晶胞中含有 PCl 6与 PCl
+
4两种离子 D.红磷、白磷、黑磷互为同分异构体
6.下列化学反应的表示不.正.确.的是
点燃
A.P 在 Cl2中完全燃烧:2P + 5Cl2 2PCl5
B.PCl5溶于水:PCl5 + 4H2O = H3PO4 + 5HCl
光照
C.HNO3见光分解:4HNO3 4NO2 ↑+ O2 ↑+ 2H2O
D.向 AgNO3溶液加入过量氨水:Ag+ + NH3 H2O = AgOH+ NH+4
7.下列物质结构与性质或性质与用途具有对应关系的是
A.黑磷具有类似石墨片层结构,可用于导电 B.NH3极易溶于水,液氨可用作制冷剂
C.NH4Cl 受热易分解,可用作氮肥 D.稀硝酸具有强氧化性,可用铁罐车运输
8.元素及其化合物的转化在工业上具有重要应用。下列涉及的物质转化正确的是
A.侯氏制碱:
B.制备硝酸:
C.制备硫酸:
D.制漂白粉:
9.X、Y、Z、M 为 4种原子序数逐渐增大的短周期元素。X 基态原子的核外电子只有 1种运动状态,Y 的
单质是空气中含量最多的物质,Z 最外层电子是其电子层数的 3倍,Z 与 M 上下相邻。下列说法正确的是
A.X 在化合物中均显+ 1 价 B.Y、M 的最高价氧化物对应的水化物均为强酸
C.X、Y 和 Z 不可能形成离子晶体 D.X 和 Z 形成的化合物不可能含有非极性键
10.根据海水综合利用的工业流程图,下列说法正确的是
A.试剂Ⅰ为 NaOH 溶液 B.操作Ⅰ为过滤、洗涤、干燥
C.步骤Ⅰ、Ⅱ的目的是富集 Br D.步骤Ⅲ的反应 Br + Cl2 = Br2 + Cl
11.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 用洁净的铂丝蘸取溶液进行焰色试验,火焰呈黄色 该溶液中含有 Na+,不含K+
B 向某溶液中加入盐酸酸化无现象,再加入 BaCl2溶液,产 该溶液中含有 SO2 4
生白色沉淀
C 某溶液中加入稀 NaOH 溶液,将湿润的红色石蕊试纸置 该溶液不含 NH+4
于试管口,试纸未变蓝色
D 向盛有淀粉、KI 的溶液中滴加 HNO3酸化的 Fe(NO3)3溶 Fe3+氧化性强于I2
液,振荡,溶液变蓝
12.酸性条件下催化氧化黄铁矿(主要成分 FeS2)的转化关系如图所示。下列有关叙述中不.正.确.的是
A.反应①中每消耗 1molFeS2,转移电子的物质的量为 14mol
B.反应③的离子方程式:4Fe(NO)2+ + O2 + 4H+ = 4Fe3+ + 4NO+ 2H2O
C.该转化过程中 FeS2作氧化剂
D.Fe(NO)2+中 � 配位的原因是 N 的电负性小于 O
13.3��� C 时,CO2催化氢化制甲烷过程如图:
下列有关说法不正确的是
A.CO2和 CH4均为非极性分子 B.转化过程中 Ni 粉作催化剂
3�� C
C.Fe 粉参与的反应为 3Fe + 4H2O Fe3O4 + 4H2 D.上述含碳化合物中 C原子的杂化轨道类型有 2
种
二、非选择题:共 4题,共 61分。
14.(16分)下表为元素周期表的一部分,请参照元素①—⑦在表中的位置,回答下列问题:
(1)含 2个中子的①原子质量数等于 。
(2)元素③核外电子有 种运动状态。
(3)写出元素⑤原子结构示意图 ,其在元素周期表中的位置为 。
(4)①②④三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: 。
(5)元素②的氢化物沸点比元素⑤的高,原因是 (用文字及化学式描述)。
(6)元素⑥属于 区(填“s”、“d”、“ds”或“p”);元素⑦的基态原子外围电子的轨道表示式为 。
(7)元素⑦的+ 2 价离子的硫酸盐溶液为天蓝色,当逐滴加人氨水,首先形成蓝色难溶物,继续滴加氨水
并振荡,难溶物溶解,得到深蓝色溶液。
Ⅰ.蓝色难溶物的化学式是 。
Ⅱ.天蓝色溶液中存在的配离子的化学式是 ,深蓝色溶液中存在的配离子的化学式是 。(两种
配离子的配位数均为 4)
(8)若向元素⑦的+ 2 价离子的硫酸盐里逐滴加入氢氧化钠溶液,首先形成蓝色难溶物,最终得到绛蓝色
溶液(溶质为配位数为 4的配合物)。
Ⅰ.不考虑空间构型,画出该配合物的结构示意图 。
Ⅱ.写出向蓝色难溶物中继续滴入氢氧化钠溶液,最终得到绛蓝色溶液的离子方程式 。
15.(15分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其结构式为 。
(2)过量 NH3和F2在铜催化作用下反应生成 NF3,NH3中 N 原子的杂化方式为 ,NF3分子的空间构型
为 。
(3)NH3和 Fe 在 64�� C 可发生置换反应,产物之一的晶胞结构如图所示。晶胞中距离 Fe 最近的 Fe 原
子有 个,写出该反应的化学方程式: 。
(4)叠氮化钠(NaN3)分解反应为 2NaN3(s) = 2Na(l) + 3N2(g),下列有关说法正确的是 (填字
母)。
a.熔融态的 NaN3能导电
b.�� 属于金属晶体
c.常温下,N2很稳定,是因为 N 的电负性大
(5)CN 与 Mn2+、Co3+形成的配合物Mn3[Co(CN)6]2用作核磁共振的造影剂。
①Mn3[Co(CN)6]2中心离子是 ,配位数为 。
②CN 离子中π键和�键的个数比为 。
16.(16分)科技进步促进了铁盐系列水处理剂的发展。
(一)FeCl3是简单无机铁处理剂。
(1)与明矾净水原理相似,FeCl3净水的原理是 (用恰当文字回答),可用 实验来验证。
SOCl2
(2)由 FeCl3 6H2O 制备无水 FeCl3的过程为 FeCl3 6H O�2 FeCl3,SOCl2与H2O 反应生成两种有刺激性气
△
味的气体,写出该反应的化学方程式: 。
(二)K2FeO4(高铁酸钾)是多功能水处理剂。
(1)碱性条件下,FeCl3溶液与 KClO 溶液反应可得到高铁酸钾,该反应的离子方程式为 。
(2)已知K2FeO4水溶液放置过程中会放出无色无味气体、产生沉淀,且所得溶液呈强碱性。检验该沉淀
中金属元素的实验方案为 。(实验中必须使用的药品:稀盐酸、KSCN 溶液)
(三)[Fe2(OH)n(SO4)3 n/2]m(聚合硫酸铁 PFS)是新型无机高分子水处理剂。以 FeSO4溶液为原料,通
入空气氧化,再经水解、聚合反应可得 PFS。
(1)实验室配制 FeSO4溶液时常加入少量铁粉,其作用是 。
(2)用聚合硫酸铁 PFS 进行模拟净化高岭土废水(用高岭土与自来水配制而成,其质量浓度为 1��mg
L 1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及 pH 的影响如图-1和图-2所示:
可知聚合硫酸铁 PFS 最佳投加量是 ,最佳 pH 是 。
(3)已知:①聚合硫酸铁一级品质总铁含量性能指标要求:铁的质量分数大于 11��%。
②MnO 4 + 5Fe
2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取 1�5��g 该聚合硫酸铁样品溶于适量硫酸,配成 1�����mL 溶液 A。
b.准确量取 2����mL 溶液 A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤液合并配成溶液 B
c.用 ���1��mol L 1的酸性 KMnO4溶液滴加到溶液 B中至恰好反应完全,消耗酸性 KMnO4溶液
13�2�mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求。
17.(14分)氨氮(NH+4 )与硝氮(NO
3 )是含氮废水中常见的氮元素存在形态。
(一)除氨氮(NH+4 )
(1)沉淀法
Mg2+、PO3 4 氨氮生成 MgNH4PO4 6H2O 沉淀可达到去除氨氮的目的。
已知:ⅰ.磷酸根在 pH = 8 1� 时主要存在形式为 HPO2 4 ;
ⅱ.Mg3(PO4)2为沉淀
①请写出 pH = � 时,沉淀法去除 NH+4离子方程式为 。
②氨氮去除率与含磷微粒浓度随 pH 变化如图-1所示,解释 pH > 1� 时氨氮去除率随 pH 变化的原
因: 。
(2)氧化法
废水中加入适量的 NaClO 溶液,控制 pH 在 6 �,可将氨氮转化为无毒物质,该过程发生了 3个反应:
ⅰ.ClO + H+ = HClO
ⅱ.NH+4 + HClO = NH2Cl + H
+ + H2O(非氧化还原反应)
ⅲ.2NH2Cl + HClO = N + 2 + 3H + 3Cl + H2O
①为了完全从废水中去除氨氮,加入的 NaClO 与水体中 NH+4物质的量之比最小是 。
②已知:水体中以+ 1 价形式存在的氯元素有杀菌消毒的作用,被称为“余氯”,该水体中的“余氯”除 ClO
外还有 。(写.化.学.式.)
③为研究空气对 NaClO 氧化氨氮的影响,其他条件不变,增加单位时间内通入空气的量,发现氨氮去除率
几乎不变。其原因可能是 (填字母)。
a.O2的氧化性比 NaClO 弱 b.空气中的N2进入溶液中 c.O2在溶液中溶解度比较小
(二)除硝氮(NO 3 )
(3)催化还原法
在W Cu/Al2O3的催化条件下,使用H2作为还原剂,可将水中的 NO 3转化为N2。该反应机理分为三步,
如图-2所示:第一步:NO 在 Cu 表面被还原为 NO ,Cu 被氧化为 CuO;第二步:NO 2 2从 Cu 表面迁移至
W 的表面;
①第三步: 。(请描述虚框内的 2个反应机理,“W H”表示吸附在W 表面的活性 H 原子)
②若改用 Pd Cu/Al2O3作为还原硝酸盐过程的催化剂,其催化机理与W Cu/Al2O3相似。但还原过程中
检测到三种含氮化合物微粒,其浓度变化如图-3所示,在 1�5 2�5h 过程中,硝酸根(NO 3 )部分转化为
NH+4的可能原因是 。
同课章节目录
