云南省曲靖市2023-2024学年高一下学期期末考试 化学试题 (含解析)
文档属性
| 名称 | 云南省曲靖市2023-2024学年高一下学期期末考试 化学试题 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-21 06:43:52 | ||
图片预览



文档简介
曲靖市2023-2024学年高一下学期期末考试
化学试题
考生注意:
1.满分100分,考试时间90分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:人教版必修第二册。
可能用到的相对原子质量:H 1 C 12 O 16 S 32
一、选择题:本题共21小题,每小题2分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列关于“嫦娥五号”所用的材料中不属于新型无机非金属材料的是
A. 挖土铲——氮化碳特种钻 B. 国旗——复合纤维织物
C. 降落伞——氮化硼纤维 D. 望远镜——碳化硅特种陶瓷
2. 下列气体排放到空气中,会导致酸雨的是
A. B. C. D.
3. 下列过程放出热量的是
A. 中和反应 B. 碳酸钙分解 C. 干冰升华 D. 化学键断裂
4. 下列设备工作时,将化学能转化为电能的是
A B C D
锂离子电池 太阳能路灯 电动车电池充电 燃气灶
A. A B. B C. C D. D
5. 一定条件下,不能通过化合反应直接生成的物质是
A. B. C. D.
6. 下列物质常温下见光会分解的是
A B. C. 浓硝酸 D. 浓硫酸
7. 下列物质与用途对应不正确的是
A. 苯甲酸钠:食品防腐剂 B. 氧化钙:吸氧剂
C. 碳酸氢钠:膨松剂 D. 阿司匹林:解热镇痛药
8. 下列物质在一定条件下能够与硫黄发生反应,且硫做还原剂的是( )
A. O2 B. Fe C. H2 D. Zn
9. 立方烷是一种新合成的烷烃,其分子结构为 。下列有关它的说法错误的是
A. 分子式为 B. 能燃烧
C. 能发生取代反应 D. 一氯代物有2种
10. 现有下列5个转化,其中不可能通过一步反应实现的是
①;②;③;④
A. ①② B. ③④ C. ②③ D. ②③④
11. 设为阿伏加德罗常数的值。下列说法正确的是
A. 甲基中含电子数为
B. 标况下所含的氧原子数为
C. 聚乙烯中含碳碳双键数目为
D. 与在光照条件下充分反应,生成分子数为
12. 检验某溶液中是否含有SO步骤是先滴加稀盐酸,若无明显现象,再滴加BaCl2溶液,现象是
A. 产生蓝色沉淀 B. 产生黄色沉淀 C. 产生红棕色沉淀 D. 产生白色沉淀
13. 下列实验或叙述中不符合绿色化学理念的是
A. 用乙醇汽油代替普通汽油作汽车燃料
B. 用浓硝酸和Cu制取
C. 制时先将Cu氧化成CuO后再与稀硫酸反应
D. 采用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100%
14. 下列叙述中错误的是
A. 蔗糖与麦芽糖互为同分异构体
B. 向鸡蛋清溶液中加入饱和硫酸铵溶液,有固体析出
C. 氨基酸分子中既含有羧基又含有氨基
D. 天然油脂的主要成分是高级脂肪酸甘油酯,没有恒定的熔沸点,属于高分子化合物
15. 下列选项中,甲组为取代反应乙组为加成反应的是
选项 甲 乙
A 丙烯在空气中燃烧 乙酸和钠反应生成氢气
B 甲烷与氯气(光照)反应 乙烯与氢气反应生成乙烷
C 淀粉→麦芽糖 蛋白质→氨基酸
D 油脂的皂化反应 石油裂化
A. A B. B C. C D. D
16. 实验室常用如图所示装置制取乙酸乙酯。下列说法错误的是
A. 试管M中药品的添加顺序依次为浓硫酸、乙醇、乙酸
B. 试管N中盛放的试剂为饱和碳酸钠溶液
C. 反应过程中试管N内有油状液体生成
D. 装置中的长导管起导气、冷凝作用
17. 宏观辨识与微观探析是化学学科核心素养之一、下列离子方程式书写错误的是
A. 铜与溶液反应:
B. 向NaOH溶液中通入过量
C. 用食醋清洗水垢的原理:
D. 实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上:
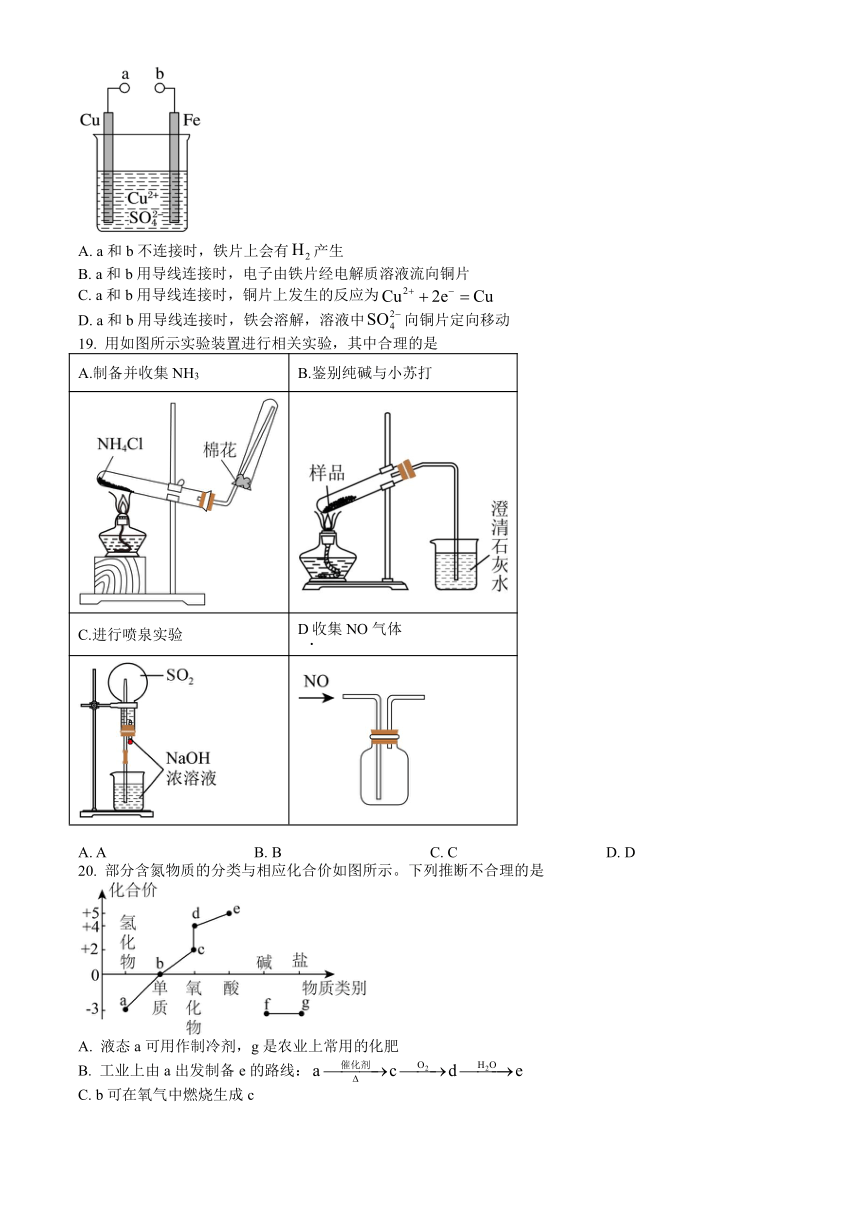
18. 某小组为研究原电池原理,设计如图装置。下列叙述正确的是
A. a和b不连接时,铁片上会有产生
B. a和b用导线连接时,电子由铁片经电解质溶液流向铜片
C. a和b用导线连接时,铜片上发生的反应为
D. a和b用导线连接时,铁会溶解,溶液中向铜片定向移动
19. 用如图所示实验装置进行相关实验,其中合理的是
A.制备并收集NH3 B.鉴别纯碱与小苏打
C.进行喷泉实验 D收集NO气体
A. A B. B C. C D. D
20. 部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是
A. 液态a可用作制冷剂,g是农业上常用的化肥
B. 工业上由a出发制备e的路线:
C. b可在氧气中燃烧生成c
D. 将分别蘸有e、f浓溶液的两根玻璃棒靠近时,可观察到白烟产生
21. 甲醛(HCHO)与在羟基磷灰石(HAP)表面发生反应的能量—历程关系如图。下列说法错误的是
A. 该反应为放热反应
B. 反应过程中,甲醛的C-H键断裂
C. 中氧原子全部来自
D. 化学方程式为
二、非选择题:本题共4小题,共58分。
22. ⅰ.某学习小组在实验室中利用下图装置制备并进行其相关性质的探究。
回答下列问题:
(1)装置C中的现象为___________;装置D中的现象为___________。
(2)装置A中发生反应的化学方程式为___________。
(3)装置E中___________(填现象)可说明具有还原性。
(4)装置F中过量的NaOH溶液吸收尾气,发生反应的离子方程式为___________。
ⅱ.某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略),已知在溶液中:(棕色),该反应可用于检验NO。
(5)实验开始前,需向装置中通入一段时间,目的是___________。
(6)写出装置E中发生反应的离子方程式:___________。
(7)若观察到装置H中红色粉末变黑,则NO与Cu发生反应,同时生成一种单质,写出该反应的化学方程式:___________。
23. 习总书记提出要构建美丽中国的伟大构想,要实现这个构想,必须解决环境污染问题。某科研小组拟综合处理含的废水和工业废气(主要含、、、CO、NO),处理流程如图:
回答下列问题:
(1)流程中“固体1”的主要成分是___________(填化学式,下同),捕获剂最终捕获的产物是___________。
(2)流程中“气体1”与适量反应的化学方程式为___________。
(3)写出该流程处理含废水时,发生反应的离子方程式:___________。
(4)写出一种检验废水中含的操作方法:___________。
(5)为了测定工业废气中含量,某同学将工业废气经过管道通入盛有200mL酸性溶液的密闭容器中,发生的离子反应为___________。若管道中工业废气流量为,经过5min溶液恰好褪色,假定样品中被充分吸收,该工业废气中的含量为___________。
24. 探究硫及其化合物的转化有重要的现实意义。如将、等污染物吸收和转化是保护环境和资源利用的有效措施。
(1)高温裂解转化为和硫蒸气(以形式存在),写出该反应的化学方程式:___________;写出一种能加快该反应速率的方法:___________。
(2)已知高温裂解是可逆反应,在恒温恒容密闭容器中,不能说明该反应已达到平衡状态的是___________(填标号)。
A. 生成1mol的同时生成1mol B. 容器中总压强不再改变
C. D. 混合气体的密度不再改变
(3)在2.0L恒容密闭容器中充入0.1mol,不同温度下测得的转化率与时间的关系如图所示。
①已知该反应的反应物总能量小于生成物的总能量,则该反应是___________(填“吸热”或“放热”)反应。
②图中P点处:___________(填“”或“”或“”)。
③950℃时,0~1.25s生成的平均反应速率为___________。
(4)写出的一项用途:___________。
25. 丙烯酸乙酯(C)是一种食品用合成香料,可以以乙烯、丙烯等石油化工产品为原料进行合成,其合成线路如下:
(1)乙烯和丙烯互为___________(填“同分异构体”或“同系物”)。
(2)A的分子式是___________,写出A的另一种同分异构体的结构简式:___________。
(3)C中含有的官能团是___________(写名称)。
(4)下列试剂不可用于鉴别A和B的是___________(填标号)。
a.氯化钠溶液 b.溴的四氯化碳溶液 c.碳酸钠溶液
(5)A与B合成C的化学方程式为___________,该反应的类型是___________。
(6)久置的丙烯酸乙酯自身会发生聚合反应,该反应的化学方程式为___________。
参考答案与解析
1. B
【解析】A.氮化碳特种钻属于新型无机非金属材料,故A不符合题意;
B.复合纤维织物属于新型有机材料,故B符合题意;
C.氮化硼纤维属于新型无机非金属材料,故C不符合题意;
D.碳化硅特种陶瓷属于新型无机非金属材料,故D不符合题意;
2. C
【解析】A.的大量排放会形成温室效应,A不符合;
B.属于碱性气体,不会形成酸雨,B不符合;
C.与水反应生成硝酸,能形成酸雨,C符合;
D.是空气的主要成分,不会形成酸雨,D不符合;
3. A
【解析】A.中和反应属于放热反应,A正确;
B.碳酸钙分解属于吸热反应,B错误;
C.干冰升华是固态二氧化碳变为气态二氧化碳,其过程需要吸收热量,C错误;
D.化学键断裂需要吸收能量,D错误;
4. A
【解析】A.锂离子电池属于化学电源,工作时将化学能转化为电能,故选A;
B.太阳能路灯,工作时将太阳能转化为电能,故不选B;
C.电动车电池充电时,将电能转化为化学能,故不选C;
D.燃气灶,工作时将化学能转化为热能,故不选D;
5. B
【解析】A.氮气和氢气在一定条件下化合反应生成,故A不符合题意;
B.二氧化硅和水不能通过化合反应生成,故B符合题意;
C.一氧化氮和氧气化合反应生成,故C不符合题意;
D.二氧化硫和氧气在催化剂加热条件下化合反应生成,故D不符合题意。
6. C
【解析】A.加热反应生成碳酸钠、二氧化碳和水,故A不符合题意;
B.加热反应生成氨气和氯化氢,故B不符合题意;
C.浓硝酸见光分解生成二氧化氮、氧气和水,故C符合题意;
D.浓硫酸见光和受热都不分解,故D不符合题意。
7. B
【解析】A.苯甲酸钠可防止食品变质,延长保质期,是常用的食品防腐剂,故A正确;
B.氧化钙不和氧气反应,不能作吸氧剂,氧化钙能吸收水,常用作干燥剂,故B错误;
C.碳酸氢钠加热分解产生二氧化碳,常用作膨松剂,故C正确;
D.阿司匹林是常用的解热镇痛药,故D正确;
8. A
【解析】A.硫与氧气反应,S元素的化合价升高,则硫作还原剂,选项A选;
B.Fe与S反应,Fe元素的化合价升高,S元素的化合价降低,硫作氧化剂,选项B不选;
C.氢气与硫反应,硫元素的化合价降低,硫作氧化剂,选项C不选;
D.Zn与S反应,Zn元素的化合价升高,S元素的化合价降低,硫作氧化剂,选项D不选;
9. D
【解析】A.由结构简式可知,分子式为,A正确;
B.该物质属于烷烃,能燃烧,B正确;
C.烷烃中碳原子上含有氢,可以发生取代反应,C正确;
D.该分子中只有1中情况的氢,一氯代物有1种,D错误;
10. C
【解析】①SiO2与氢氧化钠溶液反应可生成Na2SiO3;
②S与氧气反应能生成SO2,SO2与氧气反应能生成SO3;
③CuO先与酸反应可得到铜盐,铜盐再与碱溶液反应可生成Cu(OH)2;
④Na2O2与水反应可生成NaOH;
综上所述,②③不能一步反应,答案选C。
11. A
【解析】A.甲基中含9个电子,甲基中含个电子, A正确;
B.标况下乙醇为液体,不能根据气体摩尔体积来计算其物质的量,B错误;
C.聚乙烯中不含碳碳双键,聚乙烯中含碳碳双键数目为0,C错误;
D.甲烷和氯气的反应为连锁反应,与在光照条件下充分反应,除了生成一氯甲烷,还生成二氯甲烷、三氯甲烷和四氯化碳,故生成分子数小于, D错误;
12. D
【解析】欲检验某溶液中是否含有硫酸根离子,先滴加稀盐酸,无明显现象,证明原溶液中无碳酸根离子、亚硫酸根离子,银离子等,再滴加氯化钡溶液,产生白色沉淀为硫酸钡,即可证明原溶液中存在硫酸根离子,故答案选D。
13. B
【解析】A.用乙醇代替汽油作汽车燃料,能够减少有害气体排放,有利于环境保护,符合绿色化学的理念,故A不符合题意;
B.用稀硝酸和Cu制取Cu(NO3)2,反应生成有毒气体NO,不符合绿色化学的理念,故B符合题意;
C.制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应,不会产生有毒气体,消耗的硫酸的量少,符合绿色化学理念,故C不符合题意;
D.原子利用率100%,原料中的原子全部转变成所需要的产物,不产生副产物,无污染,符合绿色化学理念,故D不符合题意;
14. D
【解析】A.蔗糖与麦芽糖分子式都是C12H22O11,但结构不同,因此互为同分异构体,故A正确;
B.向鸡蛋清溶液中加入饱和硫酸铵溶液,蛋白质的溶解度减小,会发生盐析而析出蛋白质固体,故B正确;
C.氨基酸分子中含有羧基也含有氨基,属于两性化合物,故C正确;
D.天然油脂的相对分子质量小于一万,不是高分子化合物,故D错误;
15. B
【解析】A.丙烯在空气中燃烧为丙烯和氧气的氧化反应;乙酸和钠反应生成氢气和乙酸钠,为置换反应,A不符合题意;
B.甲烷与氯气(光照)反应生成氯化氢和卤代烃,为取代反应;乙烯与氢气发生加成反应生成乙烷,为加成反应,B符合题意;
C.淀粉→麦芽糖、蛋白质→氨基酸均为水解反应,均属于取代反应,C不符合题意;
D.油脂的皂化反应为酯的碱性水解生成羧酸盐和水;石油裂化得到不饱和烃类不是加成反应,D不符合题意;
16. A
【解析】A.药品的添加顺序应为向乙醇中加入浓硫酸,故A错误;
B.试管N中盛放的试剂为饱和碳酸钠溶液,用于吸收挥发出来的乙酸和乙醇,便于酯分层,故B正确;
C.反应生成的乙酸乙酯不溶于饱和碳酸钠溶液,试管N内有油状液体生成,故C正确;
D.装置中的长导管起导气冷凝挥发物的作用,故D正确;
17. B
【解析】A.铜与溶液发生氧化还原反应:,A正确;
B.向NaOH溶液中通入过量生成酸式盐:,B错误;
C.用食醋清洗水垢的原理为强酸制弱酸,离子方程式为:,C正确;
D.实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上,玻璃中主要成分二氧化硅与氢氧化钠反应生成硅酸钠:,D正确;
18. C
【解析】A.a和b不连接时,铁片与铜离子发生置换反应,铁片表面有铜生成,A错误;
B.a和b用导线连接时构成原电池装置,铁为负极,铜为正极,电子由铁流出经导线流向铜片,B错误;
C.a和b用导线连接时构成原电池装置,铁为负极,铜为正极,正极的反应为:铜离子得电子生成铜单质,C正确;
D.a和b用导线连接时,铁为负极,铜为正极,铁会溶解,溶液中向铁片定向移动,D错误;
19. C
【解析】A.NH4Cl加热分解产生NH3和HCl,NH3和HCl遇冷又生成NH4Cl,不能用加热NH4Cl的方法制备氨气,故A错误;
B.纯碱是Na2CO3,小苏打是NaHCO3,NaHCO3不稳定受热分解产生CO2,CO2能使澄清石灰水变浑浊,Na2CO3受热不分解,可以通过加热的方法鉴别纯碱与小苏打,但加热固体时,试管应该略向下倾斜,故B错误;
C.SO2可以和NaOH溶液反应,向圆底烧瓶中挤入NaOH溶液,可以引发喷泉实验,故C正确;
B.NO在空气中易被氧化成NO2,不能通过排空气法收集,故B错误;
20. C
【解析】A.由图可知,a为NH3,液氨可用作制冷剂,g为铵盐,是农业上常用的化肥,A项正确;
B.工业上由制备的流程为:,B项正确;
C.b为,在自然界中比较稳定,在氧气中不燃烧,C项错误;
D.e、f分别为硝酸和一水合氨,浓氨水与浓硝酸均易挥发,用分别蘸有浓氨水与浓硝酸的两根玻璃棒靠近时,氨水与硝酸反应生成硝酸铵固体,即可观察到白烟产生,D项正确;
21. C
【解析】A.根据图示,反应物总能量大于生成物总能量,该反应为放热反应,故A正确;
B.根据图示,甲醛和氧气反应生成二氧化碳和水,反应过程中,甲醛的键断裂,故B正确;
C.根据图示,中有1个氧原子来自,故C错误;
D.甲醛和氧气在羟基磷灰石()表面反应生成二氧化碳和水,化学方程式为,故D正确;
22. (1) ①. 品红溶液由红色褪为无色 ②. 溴水褪色
(2)(浓)
(3)酸性溶液紫红色变浅甚至褪去
(4)
(5)排尽装置中的空气,防止生成的NO被氧气氧化
(6)
(7)
【解析】(1)装置C中是SO2与品红溶液反应,使品红溶液褪色;装置D中是SO2将溴水还原,使溴水褪色;
(2)装置A中利用浓硫酸与亚硫酸钠反应生成二氧化硫,发生反应的化学方程式为:(浓);
(3)装置E中高锰酸钾具有强氧化性,二氧化硫具有还原性,故观察到溶液的紫色褪去,即可说明具有还原性;
(4)F中的NaOH溶液吸收二氧化硫生成亚硫酸钠;故答案为:;
(5)NO很容易与氧气反应生成NO2,所以反应开始前先通入一段时间氮气,排除装置中的空气,防止生成的NO被氧气氧化;
(6)装置E中铜与稀硝酸反应生成NO,离子方程式为;
(7)装置H中红色粉末为Cu,生成的黑色物质为CuO,同时还生成一种单质,应为N2,化学方程式为。
23. (1) ①. CaCO3、CaSO3 ②. CO
(2)2NO+O2=2NO2
(3)NH+NO=N2↑+2H2O
(4)取待检溶液1-2mL与小试管中,加入过量的NaOH溶液并加热,现象:,若能产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在
(5) ①. :2MnO+5SO2+2H2O=5SO+2Mn2++4H+ ②.
【解析】
(1)CO2、SO2与氢氧化钙反应生成碳酸钙和亚硫酸钙沉淀,即固体1为CaCO3、CaSO3;由以上分析可知捕获剂所捕获的产物是CO;
(2)气体1为N2、CO、NO的混合气体,其中NO能与氧气反应生成二氧化氮,反应方程式为:2NO+O2=2NO2;
(3)亚硝酸钠与铵根离子反应生成无污染的氮气,根据得失电子守恒可得反应离子方程式:NH+NO=N2↑+2H2O;
(4)取待检溶液1-2mL与小试管中,加入过量NaOH溶液并加热,现象:,若能产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在;
(5)通入酸性溶液中发生氧化还原反应,离子反应为:2MnO+5SO2+2H2O=5SO+2Mn2++4H+;200mL0.1mol/L酸性KMnO4溶液中含高锰酸钾0.02mol,根据反应可知吸收的二氧化硫的物质的量为:0.05mol,质量为3.2g;空气流量为2L/min,时间5min,则空气的质量为2×5L,该空气样品中SO2的含量为= g/L。
24. (1) ①. ②. 选择适用的催化剂 (2)AB
(3) ①. 吸热 ②. > ③. 0.008
(4)有机溶剂及冷冻剂、作为工业生产原料、熏蒸剂、防腐剂、消毒剂、还原剂、还原性漂白剂、用作农药、人造纤维、染料等(任写一种)
【解析】(1)高温裂解转化为和硫蒸气反应为:,加快该反应速率的方法为选择适用的催化剂,故答案为:;选择适用的催化剂。
(2)A.生成为正反应方向,生成为逆反应方向,且符合计量数之比,说明反应平衡,故A正确;
B.在恒温恒容密闭容器中,根据反应方程式可知,正反应压强变大,当容器中总压强不再改变时,说明各组分分压不变,即浓度保持不变,反应平衡,故B正确;
C.正逆反应速率相等时,反应达到平衡,当,即,反应达到平衡,故C错误;
D.在恒温恒容密闭容器中,反应前后都为气体,总质量不变,体积不变,密度一直不变,D错误;
故答案选AB。
(3)①已知该反应的反应物总能量小于生成物的总能量,则该反应是吸热反应,故答案为:吸热;
②图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大,反应向正反应方向进行,所以>;
③,在2.0L恒容密闭容器中充入0.1molH2S,此时硫化氢的转化率为:20%,则氢气的变化量为:0.1×0.2=0.02mol,所以;
(4)二氧化硫的常见用途包括:用作有机溶剂及冷冻剂,并用于精制各种润滑油;用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也用作熏蒸剂、防腐剂、消毒剂、还原剂等;用作还原性漂白剂等;用作农药、人造纤维、染料等工业部门;用于生产硫以及作为杀虫剂、杀菌剂等,故答案为:有机溶剂及冷冻剂、作为工业生产原料、熏蒸剂、防腐剂、消毒剂、还原剂、还原性漂白剂、用作农药、人造纤维、染料等(任写一种)。
25. (1)同系物 (2) ①. C2H6O ②.
(3)碳碳双键、酯基 (4)BC
(5) ①. ②. 酯化反应(取代反应)
(6)
【解析】(1)乙烯和丙烯均为单烯烃,结构相似,组成上相差1个CH2,互为同系物;
(2)A的分子式是:C2H6O;同C数目的醇和醚互为同分异构体,A的另一种同分异构体的结构简式:;
(3)中含有的官能团是:碳碳双键、酯基;
(4)A为CH3CH2OH,B为CH2=CHCOOH;
a.A和B均不和氯化钠溶液反应且均可溶解,不能鉴别,A不选;
b.B可以和溴的四氯化碳溶液发生加成反应使其褪色,A不和溴的四氯化碳溶液反应,可以鉴别,B选;
c.B含有羧基,和碳酸钠溶液反应生成CO2气体,A和碳酸钠溶液不反应,可以鉴别,C选;
故选BC;
(5)A和B发生酯化反应(取代反应)生成丙烯酸乙酯,A与B合成丙烯酸乙酯的化学方程式为;该反应的类型是酯化反应(取代反应);
(6)丙烯酸乙酯自身发生聚合反应化学方程式为 ;
化学试题
考生注意:
1.满分100分,考试时间90分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:人教版必修第二册。
可能用到的相对原子质量:H 1 C 12 O 16 S 32
一、选择题:本题共21小题,每小题2分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列关于“嫦娥五号”所用的材料中不属于新型无机非金属材料的是
A. 挖土铲——氮化碳特种钻 B. 国旗——复合纤维织物
C. 降落伞——氮化硼纤维 D. 望远镜——碳化硅特种陶瓷
2. 下列气体排放到空气中,会导致酸雨的是
A. B. C. D.
3. 下列过程放出热量的是
A. 中和反应 B. 碳酸钙分解 C. 干冰升华 D. 化学键断裂
4. 下列设备工作时,将化学能转化为电能的是
A B C D
锂离子电池 太阳能路灯 电动车电池充电 燃气灶
A. A B. B C. C D. D
5. 一定条件下,不能通过化合反应直接生成的物质是
A. B. C. D.
6. 下列物质常温下见光会分解的是
A B. C. 浓硝酸 D. 浓硫酸
7. 下列物质与用途对应不正确的是
A. 苯甲酸钠:食品防腐剂 B. 氧化钙:吸氧剂
C. 碳酸氢钠:膨松剂 D. 阿司匹林:解热镇痛药
8. 下列物质在一定条件下能够与硫黄发生反应,且硫做还原剂的是( )
A. O2 B. Fe C. H2 D. Zn
9. 立方烷是一种新合成的烷烃,其分子结构为 。下列有关它的说法错误的是
A. 分子式为 B. 能燃烧
C. 能发生取代反应 D. 一氯代物有2种
10. 现有下列5个转化,其中不可能通过一步反应实现的是
①;②;③;④
A. ①② B. ③④ C. ②③ D. ②③④
11. 设为阿伏加德罗常数的值。下列说法正确的是
A. 甲基中含电子数为
B. 标况下所含的氧原子数为
C. 聚乙烯中含碳碳双键数目为
D. 与在光照条件下充分反应,生成分子数为
12. 检验某溶液中是否含有SO步骤是先滴加稀盐酸,若无明显现象,再滴加BaCl2溶液,现象是
A. 产生蓝色沉淀 B. 产生黄色沉淀 C. 产生红棕色沉淀 D. 产生白色沉淀
13. 下列实验或叙述中不符合绿色化学理念的是
A. 用乙醇汽油代替普通汽油作汽车燃料
B. 用浓硝酸和Cu制取
C. 制时先将Cu氧化成CuO后再与稀硫酸反应
D. 采用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100%
14. 下列叙述中错误的是
A. 蔗糖与麦芽糖互为同分异构体
B. 向鸡蛋清溶液中加入饱和硫酸铵溶液,有固体析出
C. 氨基酸分子中既含有羧基又含有氨基
D. 天然油脂的主要成分是高级脂肪酸甘油酯,没有恒定的熔沸点,属于高分子化合物
15. 下列选项中,甲组为取代反应乙组为加成反应的是
选项 甲 乙
A 丙烯在空气中燃烧 乙酸和钠反应生成氢气
B 甲烷与氯气(光照)反应 乙烯与氢气反应生成乙烷
C 淀粉→麦芽糖 蛋白质→氨基酸
D 油脂的皂化反应 石油裂化
A. A B. B C. C D. D
16. 实验室常用如图所示装置制取乙酸乙酯。下列说法错误的是
A. 试管M中药品的添加顺序依次为浓硫酸、乙醇、乙酸
B. 试管N中盛放的试剂为饱和碳酸钠溶液
C. 反应过程中试管N内有油状液体生成
D. 装置中的长导管起导气、冷凝作用
17. 宏观辨识与微观探析是化学学科核心素养之一、下列离子方程式书写错误的是
A. 铜与溶液反应:
B. 向NaOH溶液中通入过量
C. 用食醋清洗水垢的原理:
D. 实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上:
18. 某小组为研究原电池原理,设计如图装置。下列叙述正确的是
A. a和b不连接时,铁片上会有产生
B. a和b用导线连接时,电子由铁片经电解质溶液流向铜片
C. a和b用导线连接时,铜片上发生的反应为
D. a和b用导线连接时,铁会溶解,溶液中向铜片定向移动
19. 用如图所示实验装置进行相关实验,其中合理的是
A.制备并收集NH3 B.鉴别纯碱与小苏打
C.进行喷泉实验 D收集NO气体
A. A B. B C. C D. D
20. 部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是
A. 液态a可用作制冷剂,g是农业上常用的化肥
B. 工业上由a出发制备e的路线:
C. b可在氧气中燃烧生成c
D. 将分别蘸有e、f浓溶液的两根玻璃棒靠近时,可观察到白烟产生
21. 甲醛(HCHO)与在羟基磷灰石(HAP)表面发生反应的能量—历程关系如图。下列说法错误的是
A. 该反应为放热反应
B. 反应过程中,甲醛的C-H键断裂
C. 中氧原子全部来自
D. 化学方程式为
二、非选择题:本题共4小题,共58分。
22. ⅰ.某学习小组在实验室中利用下图装置制备并进行其相关性质的探究。
回答下列问题:
(1)装置C中的现象为___________;装置D中的现象为___________。
(2)装置A中发生反应的化学方程式为___________。
(3)装置E中___________(填现象)可说明具有还原性。
(4)装置F中过量的NaOH溶液吸收尾气,发生反应的离子方程式为___________。
ⅱ.某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略),已知在溶液中:(棕色),该反应可用于检验NO。
(5)实验开始前,需向装置中通入一段时间,目的是___________。
(6)写出装置E中发生反应的离子方程式:___________。
(7)若观察到装置H中红色粉末变黑,则NO与Cu发生反应,同时生成一种单质,写出该反应的化学方程式:___________。
23. 习总书记提出要构建美丽中国的伟大构想,要实现这个构想,必须解决环境污染问题。某科研小组拟综合处理含的废水和工业废气(主要含、、、CO、NO),处理流程如图:
回答下列问题:
(1)流程中“固体1”的主要成分是___________(填化学式,下同),捕获剂最终捕获的产物是___________。
(2)流程中“气体1”与适量反应的化学方程式为___________。
(3)写出该流程处理含废水时,发生反应的离子方程式:___________。
(4)写出一种检验废水中含的操作方法:___________。
(5)为了测定工业废气中含量,某同学将工业废气经过管道通入盛有200mL酸性溶液的密闭容器中,发生的离子反应为___________。若管道中工业废气流量为,经过5min溶液恰好褪色,假定样品中被充分吸收,该工业废气中的含量为___________。
24. 探究硫及其化合物的转化有重要的现实意义。如将、等污染物吸收和转化是保护环境和资源利用的有效措施。
(1)高温裂解转化为和硫蒸气(以形式存在),写出该反应的化学方程式:___________;写出一种能加快该反应速率的方法:___________。
(2)已知高温裂解是可逆反应,在恒温恒容密闭容器中,不能说明该反应已达到平衡状态的是___________(填标号)。
A. 生成1mol的同时生成1mol B. 容器中总压强不再改变
C. D. 混合气体的密度不再改变
(3)在2.0L恒容密闭容器中充入0.1mol,不同温度下测得的转化率与时间的关系如图所示。
①已知该反应的反应物总能量小于生成物的总能量,则该反应是___________(填“吸热”或“放热”)反应。
②图中P点处:___________(填“”或“”或“”)。
③950℃时,0~1.25s生成的平均反应速率为___________。
(4)写出的一项用途:___________。
25. 丙烯酸乙酯(C)是一种食品用合成香料,可以以乙烯、丙烯等石油化工产品为原料进行合成,其合成线路如下:
(1)乙烯和丙烯互为___________(填“同分异构体”或“同系物”)。
(2)A的分子式是___________,写出A的另一种同分异构体的结构简式:___________。
(3)C中含有的官能团是___________(写名称)。
(4)下列试剂不可用于鉴别A和B的是___________(填标号)。
a.氯化钠溶液 b.溴的四氯化碳溶液 c.碳酸钠溶液
(5)A与B合成C的化学方程式为___________,该反应的类型是___________。
(6)久置的丙烯酸乙酯自身会发生聚合反应,该反应的化学方程式为___________。
参考答案与解析
1. B
【解析】A.氮化碳特种钻属于新型无机非金属材料,故A不符合题意;
B.复合纤维织物属于新型有机材料,故B符合题意;
C.氮化硼纤维属于新型无机非金属材料,故C不符合题意;
D.碳化硅特种陶瓷属于新型无机非金属材料,故D不符合题意;
2. C
【解析】A.的大量排放会形成温室效应,A不符合;
B.属于碱性气体,不会形成酸雨,B不符合;
C.与水反应生成硝酸,能形成酸雨,C符合;
D.是空气的主要成分,不会形成酸雨,D不符合;
3. A
【解析】A.中和反应属于放热反应,A正确;
B.碳酸钙分解属于吸热反应,B错误;
C.干冰升华是固态二氧化碳变为气态二氧化碳,其过程需要吸收热量,C错误;
D.化学键断裂需要吸收能量,D错误;
4. A
【解析】A.锂离子电池属于化学电源,工作时将化学能转化为电能,故选A;
B.太阳能路灯,工作时将太阳能转化为电能,故不选B;
C.电动车电池充电时,将电能转化为化学能,故不选C;
D.燃气灶,工作时将化学能转化为热能,故不选D;
5. B
【解析】A.氮气和氢气在一定条件下化合反应生成,故A不符合题意;
B.二氧化硅和水不能通过化合反应生成,故B符合题意;
C.一氧化氮和氧气化合反应生成,故C不符合题意;
D.二氧化硫和氧气在催化剂加热条件下化合反应生成,故D不符合题意。
6. C
【解析】A.加热反应生成碳酸钠、二氧化碳和水,故A不符合题意;
B.加热反应生成氨气和氯化氢,故B不符合题意;
C.浓硝酸见光分解生成二氧化氮、氧气和水,故C符合题意;
D.浓硫酸见光和受热都不分解,故D不符合题意。
7. B
【解析】A.苯甲酸钠可防止食品变质,延长保质期,是常用的食品防腐剂,故A正确;
B.氧化钙不和氧气反应,不能作吸氧剂,氧化钙能吸收水,常用作干燥剂,故B错误;
C.碳酸氢钠加热分解产生二氧化碳,常用作膨松剂,故C正确;
D.阿司匹林是常用的解热镇痛药,故D正确;
8. A
【解析】A.硫与氧气反应,S元素的化合价升高,则硫作还原剂,选项A选;
B.Fe与S反应,Fe元素的化合价升高,S元素的化合价降低,硫作氧化剂,选项B不选;
C.氢气与硫反应,硫元素的化合价降低,硫作氧化剂,选项C不选;
D.Zn与S反应,Zn元素的化合价升高,S元素的化合价降低,硫作氧化剂,选项D不选;
9. D
【解析】A.由结构简式可知,分子式为,A正确;
B.该物质属于烷烃,能燃烧,B正确;
C.烷烃中碳原子上含有氢,可以发生取代反应,C正确;
D.该分子中只有1中情况的氢,一氯代物有1种,D错误;
10. C
【解析】①SiO2与氢氧化钠溶液反应可生成Na2SiO3;
②S与氧气反应能生成SO2,SO2与氧气反应能生成SO3;
③CuO先与酸反应可得到铜盐,铜盐再与碱溶液反应可生成Cu(OH)2;
④Na2O2与水反应可生成NaOH;
综上所述,②③不能一步反应,答案选C。
11. A
【解析】A.甲基中含9个电子,甲基中含个电子, A正确;
B.标况下乙醇为液体,不能根据气体摩尔体积来计算其物质的量,B错误;
C.聚乙烯中不含碳碳双键,聚乙烯中含碳碳双键数目为0,C错误;
D.甲烷和氯气的反应为连锁反应,与在光照条件下充分反应,除了生成一氯甲烷,还生成二氯甲烷、三氯甲烷和四氯化碳,故生成分子数小于, D错误;
12. D
【解析】欲检验某溶液中是否含有硫酸根离子,先滴加稀盐酸,无明显现象,证明原溶液中无碳酸根离子、亚硫酸根离子,银离子等,再滴加氯化钡溶液,产生白色沉淀为硫酸钡,即可证明原溶液中存在硫酸根离子,故答案选D。
13. B
【解析】A.用乙醇代替汽油作汽车燃料,能够减少有害气体排放,有利于环境保护,符合绿色化学的理念,故A不符合题意;
B.用稀硝酸和Cu制取Cu(NO3)2,反应生成有毒气体NO,不符合绿色化学的理念,故B符合题意;
C.制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应,不会产生有毒气体,消耗的硫酸的量少,符合绿色化学理念,故C不符合题意;
D.原子利用率100%,原料中的原子全部转变成所需要的产物,不产生副产物,无污染,符合绿色化学理念,故D不符合题意;
14. D
【解析】A.蔗糖与麦芽糖分子式都是C12H22O11,但结构不同,因此互为同分异构体,故A正确;
B.向鸡蛋清溶液中加入饱和硫酸铵溶液,蛋白质的溶解度减小,会发生盐析而析出蛋白质固体,故B正确;
C.氨基酸分子中含有羧基也含有氨基,属于两性化合物,故C正确;
D.天然油脂的相对分子质量小于一万,不是高分子化合物,故D错误;
15. B
【解析】A.丙烯在空气中燃烧为丙烯和氧气的氧化反应;乙酸和钠反应生成氢气和乙酸钠,为置换反应,A不符合题意;
B.甲烷与氯气(光照)反应生成氯化氢和卤代烃,为取代反应;乙烯与氢气发生加成反应生成乙烷,为加成反应,B符合题意;
C.淀粉→麦芽糖、蛋白质→氨基酸均为水解反应,均属于取代反应,C不符合题意;
D.油脂的皂化反应为酯的碱性水解生成羧酸盐和水;石油裂化得到不饱和烃类不是加成反应,D不符合题意;
16. A
【解析】A.药品的添加顺序应为向乙醇中加入浓硫酸,故A错误;
B.试管N中盛放的试剂为饱和碳酸钠溶液,用于吸收挥发出来的乙酸和乙醇,便于酯分层,故B正确;
C.反应生成的乙酸乙酯不溶于饱和碳酸钠溶液,试管N内有油状液体生成,故C正确;
D.装置中的长导管起导气冷凝挥发物的作用,故D正确;
17. B
【解析】A.铜与溶液发生氧化还原反应:,A正确;
B.向NaOH溶液中通入过量生成酸式盐:,B错误;
C.用食醋清洗水垢的原理为强酸制弱酸,离子方程式为:,C正确;
D.实验室若用磨砂玻璃塞盖在了盛放NaOH溶液的试剂瓶上,玻璃中主要成分二氧化硅与氢氧化钠反应生成硅酸钠:,D正确;
18. C
【解析】A.a和b不连接时,铁片与铜离子发生置换反应,铁片表面有铜生成,A错误;
B.a和b用导线连接时构成原电池装置,铁为负极,铜为正极,电子由铁流出经导线流向铜片,B错误;
C.a和b用导线连接时构成原电池装置,铁为负极,铜为正极,正极的反应为:铜离子得电子生成铜单质,C正确;
D.a和b用导线连接时,铁为负极,铜为正极,铁会溶解,溶液中向铁片定向移动,D错误;
19. C
【解析】A.NH4Cl加热分解产生NH3和HCl,NH3和HCl遇冷又生成NH4Cl,不能用加热NH4Cl的方法制备氨气,故A错误;
B.纯碱是Na2CO3,小苏打是NaHCO3,NaHCO3不稳定受热分解产生CO2,CO2能使澄清石灰水变浑浊,Na2CO3受热不分解,可以通过加热的方法鉴别纯碱与小苏打,但加热固体时,试管应该略向下倾斜,故B错误;
C.SO2可以和NaOH溶液反应,向圆底烧瓶中挤入NaOH溶液,可以引发喷泉实验,故C正确;
B.NO在空气中易被氧化成NO2,不能通过排空气法收集,故B错误;
20. C
【解析】A.由图可知,a为NH3,液氨可用作制冷剂,g为铵盐,是农业上常用的化肥,A项正确;
B.工业上由制备的流程为:,B项正确;
C.b为,在自然界中比较稳定,在氧气中不燃烧,C项错误;
D.e、f分别为硝酸和一水合氨,浓氨水与浓硝酸均易挥发,用分别蘸有浓氨水与浓硝酸的两根玻璃棒靠近时,氨水与硝酸反应生成硝酸铵固体,即可观察到白烟产生,D项正确;
21. C
【解析】A.根据图示,反应物总能量大于生成物总能量,该反应为放热反应,故A正确;
B.根据图示,甲醛和氧气反应生成二氧化碳和水,反应过程中,甲醛的键断裂,故B正确;
C.根据图示,中有1个氧原子来自,故C错误;
D.甲醛和氧气在羟基磷灰石()表面反应生成二氧化碳和水,化学方程式为,故D正确;
22. (1) ①. 品红溶液由红色褪为无色 ②. 溴水褪色
(2)(浓)
(3)酸性溶液紫红色变浅甚至褪去
(4)
(5)排尽装置中的空气,防止生成的NO被氧气氧化
(6)
(7)
【解析】(1)装置C中是SO2与品红溶液反应,使品红溶液褪色;装置D中是SO2将溴水还原,使溴水褪色;
(2)装置A中利用浓硫酸与亚硫酸钠反应生成二氧化硫,发生反应的化学方程式为:(浓);
(3)装置E中高锰酸钾具有强氧化性,二氧化硫具有还原性,故观察到溶液的紫色褪去,即可说明具有还原性;
(4)F中的NaOH溶液吸收二氧化硫生成亚硫酸钠;故答案为:;
(5)NO很容易与氧气反应生成NO2,所以反应开始前先通入一段时间氮气,排除装置中的空气,防止生成的NO被氧气氧化;
(6)装置E中铜与稀硝酸反应生成NO,离子方程式为;
(7)装置H中红色粉末为Cu,生成的黑色物质为CuO,同时还生成一种单质,应为N2,化学方程式为。
23. (1) ①. CaCO3、CaSO3 ②. CO
(2)2NO+O2=2NO2
(3)NH+NO=N2↑+2H2O
(4)取待检溶液1-2mL与小试管中,加入过量的NaOH溶液并加热,现象:,若能产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在
(5) ①. :2MnO+5SO2+2H2O=5SO+2Mn2++4H+ ②.
【解析】
(1)CO2、SO2与氢氧化钙反应生成碳酸钙和亚硫酸钙沉淀,即固体1为CaCO3、CaSO3;由以上分析可知捕获剂所捕获的产物是CO;
(2)气体1为N2、CO、NO的混合气体,其中NO能与氧气反应生成二氧化氮,反应方程式为:2NO+O2=2NO2;
(3)亚硝酸钠与铵根离子反应生成无污染的氮气,根据得失电子守恒可得反应离子方程式:NH+NO=N2↑+2H2O;
(4)取待检溶液1-2mL与小试管中,加入过量NaOH溶液并加热,现象:,若能产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在;
(5)通入酸性溶液中发生氧化还原反应,离子反应为:2MnO+5SO2+2H2O=5SO+2Mn2++4H+;200mL0.1mol/L酸性KMnO4溶液中含高锰酸钾0.02mol,根据反应可知吸收的二氧化硫的物质的量为:0.05mol,质量为3.2g;空气流量为2L/min,时间5min,则空气的质量为2×5L,该空气样品中SO2的含量为= g/L。
24. (1) ①. ②. 选择适用的催化剂 (2)AB
(3) ①. 吸热 ②. > ③. 0.008
(4)有机溶剂及冷冻剂、作为工业生产原料、熏蒸剂、防腐剂、消毒剂、还原剂、还原性漂白剂、用作农药、人造纤维、染料等(任写一种)
【解析】(1)高温裂解转化为和硫蒸气反应为:,加快该反应速率的方法为选择适用的催化剂,故答案为:;选择适用的催化剂。
(2)A.生成为正反应方向,生成为逆反应方向,且符合计量数之比,说明反应平衡,故A正确;
B.在恒温恒容密闭容器中,根据反应方程式可知,正反应压强变大,当容器中总压强不再改变时,说明各组分分压不变,即浓度保持不变,反应平衡,故B正确;
C.正逆反应速率相等时,反应达到平衡,当,即,反应达到平衡,故C错误;
D.在恒温恒容密闭容器中,反应前后都为气体,总质量不变,体积不变,密度一直不变,D错误;
故答案选AB。
(3)①已知该反应的反应物总能量小于生成物的总能量,则该反应是吸热反应,故答案为:吸热;
②图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大,反应向正反应方向进行,所以>;
③,在2.0L恒容密闭容器中充入0.1molH2S,此时硫化氢的转化率为:20%,则氢气的变化量为:0.1×0.2=0.02mol,所以;
(4)二氧化硫的常见用途包括:用作有机溶剂及冷冻剂,并用于精制各种润滑油;用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也用作熏蒸剂、防腐剂、消毒剂、还原剂等;用作还原性漂白剂等;用作农药、人造纤维、染料等工业部门;用于生产硫以及作为杀虫剂、杀菌剂等,故答案为:有机溶剂及冷冻剂、作为工业生产原料、熏蒸剂、防腐剂、消毒剂、还原剂、还原性漂白剂、用作农药、人造纤维、染料等(任写一种)。
25. (1)同系物 (2) ①. C2H6O ②.
(3)碳碳双键、酯基 (4)BC
(5) ①. ②. 酯化反应(取代反应)
(6)
【解析】(1)乙烯和丙烯均为单烯烃,结构相似,组成上相差1个CH2,互为同系物;
(2)A的分子式是:C2H6O;同C数目的醇和醚互为同分异构体,A的另一种同分异构体的结构简式:;
(3)中含有的官能团是:碳碳双键、酯基;
(4)A为CH3CH2OH,B为CH2=CHCOOH;
a.A和B均不和氯化钠溶液反应且均可溶解,不能鉴别,A不选;
b.B可以和溴的四氯化碳溶液发生加成反应使其褪色,A不和溴的四氯化碳溶液反应,可以鉴别,B选;
c.B含有羧基,和碳酸钠溶液反应生成CO2气体,A和碳酸钠溶液不反应,可以鉴别,C选;
故选BC;
(5)A和B发生酯化反应(取代反应)生成丙烯酸乙酯,A与B合成丙烯酸乙酯的化学方程式为;该反应的类型是酯化反应(取代反应);
(6)丙烯酸乙酯自身发生聚合反应化学方程式为 ;
同课章节目录
