【核心素养目标】人教版(2019)高一化学必修第一册 1.3 氧化还原反应(第2课时 氧化剂和还原剂)(共23张PPT)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 1.3 氧化还原反应(第2课时 氧化剂和还原剂)(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览








文档简介
(共23张PPT)
第三节 氧化还原反应
第2课时 氧化剂和还原剂
人教版必修第一册
榆次一中 李金虎
学习目标
1.知道常见的氧化剂和还原剂。
2.根据氧化还原反应原理预物质的化学性质和变化。
3.会用“双线桥”法描述电子转移的方向与数目。
学习目标
1.理解物质氧化性、还原性强弱与价态及电子转移的关系。培养学生“宏观辨识与微观探析”的核心素养。
2.掌握物质氧化性、还原性强弱判断方法,培养学生“证据推理与模型认知”的核心素养。
3.会用“双线桥”法描述电子转移的方向与数目,培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
维生素C是常见的还原剂,具有抗氧化性,可以保护膳食中其它抗氧化物和脂肪中的不饱和脂肪酸,是一种减缓氧化的强力抗氧化剂。
情境引入
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
焦亚硫酸钾是用来代替二氧化硫的一种抗氧化剂
抗氧化剂就是还原剂
教学过程
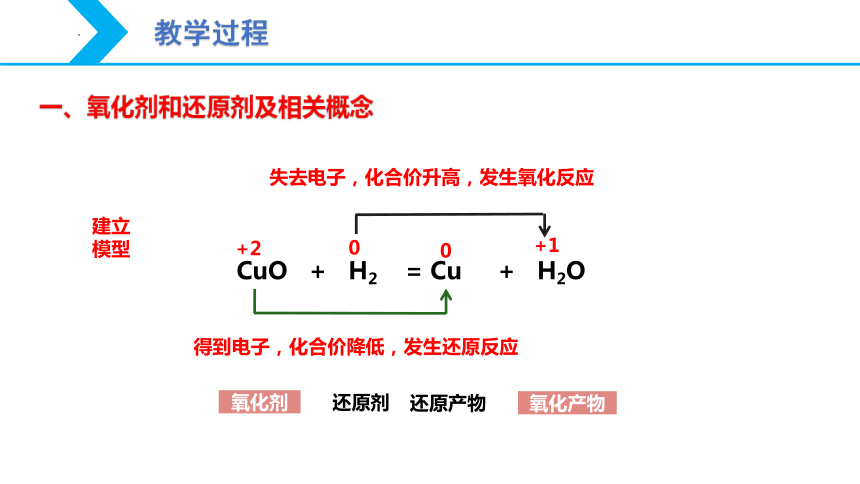
一、氧化剂和还原剂及相关概念
还原剂
氧化产物
氧化剂
CuO + H2 = Cu + H2O
+2
0
0
+1
得到电子,化合价降低,发生还原反应
失去电子,化合价升高,发生氧化反应
还原产物
建立模型
教学过程
一、氧化剂和还原剂及相关概念
氧化剂:得到电子的物质,元素的化合价降低
还原剂:失去电子的物质,元素的化合价升高
反应物
生成物
氧化产物:还原剂被氧化后的生成物。
还原产物:氧化剂被还原后的生成物。
1、概念
教学过程
注意:在有些反应中,氧化剂和还原剂可能是同一种物质,氧化产物和还原产物也可能是同一种物质。
判断下列反应的氧化剂和还原剂:
① Fe + CuSO4 == Cu + FeSO4
② MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③ 3NO2+H2O == 2HNO3+NO
④ 2KMnO4 K2MnO4+MnO2+O2↑
氧化产物
某种物质没有“身份”
某种物质有两种“身份”
还原剂
氧化剂
还原产物
氧化剂
还原剂
还原剂
氧化剂
还原产物
还原产物
氧化产物
某些物质“身份”相同
还原剂
氧化剂
氧化产物
还原产物
还原产物
氧化产物
教学过程
(2)常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3等。
③过氧化物:如Na2O2、H2O2等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
高锰酸钾
漂白粉
过氧化钠
过氧化氢(双氧水)
教学过程
教学过程
(3) 常见的还原剂
① 金属单质,如 Na,K,Zn,Fe 等。
② 某些非金属单质,如 H2,C,Si等。
③ 元素处于低化合价时的氧化物,如 CO,SO2 等。
④ 元素处于低化合价时的酸,如 HCl (浓),HBr,HI,H2S 等。
⑤ 元素处于低化合价时的盐,如 Na2SO3,FeSO4 等。
还原铁粉
硫黄
浓盐酸
教学过程
二、氧化还原反应电子转移的表示方法
1.双线桥法:
箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子,在线上要标明“失去”或“得到”的电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
教学过程
二、氧化还原反应电子转移的表示方法
注意事项
(1)箭头、箭尾必须对应化合价变化的同种元素的原子;
(2)必须注明“得到”或“失去”;
(3)电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。
(4)被还原的物质和被氧化的物质得、失电子数守恒。
教学过程
例:用双线桥法表示下列反应的电子转移的方向与数目。
教学过程
2.单线桥法:
在氧化剂和还原剂之间表示电子的转移关系,在线上标出电子转移总数,箭头指出转移的方向。
典例1.
汽车尾气转化反应之一是2CO +2NO N2+2CO2,有关该反应的说法正确的是( )
A.CO是氧化剂 B.NO被氧化
C.CO得到电子 D.NO发生还原反应
课堂练习
【答案】D
【解析】CO在反应中失去电子,化合价升高,被氧化,是还原剂;NO是氧化剂,被还原,发生还原反应;故选D
教学过程
下列标明电子转移的方向和数目的化学方程式中正确的是( )
典例2.
【答案】B
【解析】A项,锌元素失去电子,氢元素得到电子,错误;B项,氯酸钾中氯元素由+5价降低到0价,得到5个电子,HCl中氯元素由-1价升高到0价,共失去5个电子,正确;C项,2 个铁原子失去6 个电子,3个氯气分子得到6 个电子,错误;D项,1 个铜原子失去2 个电子,硝酸中的氮原子得到2 个电子,错误。
典例3.
《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。K2Cr2O7是火柴工业用作制造火柴头的氧化剂。
在下列反应中:K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的HCl中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 。
(4)该反应中每生成3分子Cl2转移电子数为 个。
课堂练习
课堂小结
【答案】(1)氯 K2Cr2O7 (2)Cl2 HCl (3) 3∶4 (4)6
【解析】(1)反应中氯元素的化合价由-1价升高到0价,被氧化;K2Cr2O7中铬元素的化合价由+6价降低到+3价,被还原,K2Cr2O7作氧化剂。(2)HCl→Cl2,氯元素化合价升高,发生氧化反应,Cl2为氧化产物。(3)14个HCl分子参加反应,有6个HCl分子被氧化,生成3个Cl2分子,另外8个HCl分子起酸性作用,所以起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为6∶8=3∶4。(4)氯元素的化合价由-1价变到0价,故生成3分子Cl2转移电子数为3×2×[0-(-1)]=6个。
典例4.
汽车尾气转化反应之一是2CO +2NO N2+2CO2,有关该反应的说法正确的是( )
A.CO是氧化剂 B.NO被氧化
C.CO得到电子 D.NO发生还原反应
课堂练习
【答案】D
【解析】CO在反应中失去电子,化合价升高,被氧化,是还原剂;NO是氧化剂,被还原,发生还原反应;故选D
典例4.
碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。
我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)上述反应中,氧化剂、还原剂、氧化产物、还原产物分别是什么物质?
(2)上述反应中,氧化产物与还原产物的质量比是多少?
(3)请分别用双线桥法和单线桥法标出该反应中电子转移的方向和数目。
课堂练习
课堂小结
【答案】 (1)氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2。
(2)5∶1。
(3)双线桥:
课堂小结
感 谢 倾 听
第三节 氧化还原反应
第2课时 氧化剂和还原剂
人教版必修第一册
榆次一中 李金虎
学习目标
1.知道常见的氧化剂和还原剂。
2.根据氧化还原反应原理预物质的化学性质和变化。
3.会用“双线桥”法描述电子转移的方向与数目。
学习目标
1.理解物质氧化性、还原性强弱与价态及电子转移的关系。培养学生“宏观辨识与微观探析”的核心素养。
2.掌握物质氧化性、还原性强弱判断方法,培养学生“证据推理与模型认知”的核心素养。
3.会用“双线桥”法描述电子转移的方向与数目,培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
维生素C是常见的还原剂,具有抗氧化性,可以保护膳食中其它抗氧化物和脂肪中的不饱和脂肪酸,是一种减缓氧化的强力抗氧化剂。
情境引入
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
焦亚硫酸钾是用来代替二氧化硫的一种抗氧化剂
抗氧化剂就是还原剂
教学过程
一、氧化剂和还原剂及相关概念
还原剂
氧化产物
氧化剂
CuO + H2 = Cu + H2O
+2
0
0
+1
得到电子,化合价降低,发生还原反应
失去电子,化合价升高,发生氧化反应
还原产物
建立模型
教学过程
一、氧化剂和还原剂及相关概念
氧化剂:得到电子的物质,元素的化合价降低
还原剂:失去电子的物质,元素的化合价升高
反应物
生成物
氧化产物:还原剂被氧化后的生成物。
还原产物:氧化剂被还原后的生成物。
1、概念
教学过程
注意:在有些反应中,氧化剂和还原剂可能是同一种物质,氧化产物和还原产物也可能是同一种物质。
判断下列反应的氧化剂和还原剂:
① Fe + CuSO4 == Cu + FeSO4
② MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③ 3NO2+H2O == 2HNO3+NO
④ 2KMnO4 K2MnO4+MnO2+O2↑
氧化产物
某种物质没有“身份”
某种物质有两种“身份”
还原剂
氧化剂
还原产物
氧化剂
还原剂
还原剂
氧化剂
还原产物
还原产物
氧化产物
某些物质“身份”相同
还原剂
氧化剂
氧化产物
还原产物
还原产物
氧化产物
教学过程
(2)常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3等。
③过氧化物:如Na2O2、H2O2等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
高锰酸钾
漂白粉
过氧化钠
过氧化氢(双氧水)
教学过程
教学过程
(3) 常见的还原剂
① 金属单质,如 Na,K,Zn,Fe 等。
② 某些非金属单质,如 H2,C,Si等。
③ 元素处于低化合价时的氧化物,如 CO,SO2 等。
④ 元素处于低化合价时的酸,如 HCl (浓),HBr,HI,H2S 等。
⑤ 元素处于低化合价时的盐,如 Na2SO3,FeSO4 等。
还原铁粉
硫黄
浓盐酸
教学过程
二、氧化还原反应电子转移的表示方法
1.双线桥法:
箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子,在线上要标明“失去”或“得到”的电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
教学过程
二、氧化还原反应电子转移的表示方法
注意事项
(1)箭头、箭尾必须对应化合价变化的同种元素的原子;
(2)必须注明“得到”或“失去”;
(3)电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。
(4)被还原的物质和被氧化的物质得、失电子数守恒。
教学过程
例:用双线桥法表示下列反应的电子转移的方向与数目。
教学过程
2.单线桥法:
在氧化剂和还原剂之间表示电子的转移关系,在线上标出电子转移总数,箭头指出转移的方向。
典例1.
汽车尾气转化反应之一是2CO +2NO N2+2CO2,有关该反应的说法正确的是( )
A.CO是氧化剂 B.NO被氧化
C.CO得到电子 D.NO发生还原反应
课堂练习
【答案】D
【解析】CO在反应中失去电子,化合价升高,被氧化,是还原剂;NO是氧化剂,被还原,发生还原反应;故选D
教学过程
下列标明电子转移的方向和数目的化学方程式中正确的是( )
典例2.
【答案】B
【解析】A项,锌元素失去电子,氢元素得到电子,错误;B项,氯酸钾中氯元素由+5价降低到0价,得到5个电子,HCl中氯元素由-1价升高到0价,共失去5个电子,正确;C项,2 个铁原子失去6 个电子,3个氯气分子得到6 个电子,错误;D项,1 个铜原子失去2 个电子,硝酸中的氮原子得到2 个电子,错误。
典例3.
《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。K2Cr2O7是火柴工业用作制造火柴头的氧化剂。
在下列反应中:K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
(1) 元素被氧化, 是氧化剂。
(2) 是氧化产物, 发生氧化反应。
(3)在参加反应的HCl中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 。
(4)该反应中每生成3分子Cl2转移电子数为 个。
课堂练习
课堂小结
【答案】(1)氯 K2Cr2O7 (2)Cl2 HCl (3) 3∶4 (4)6
【解析】(1)反应中氯元素的化合价由-1价升高到0价,被氧化;K2Cr2O7中铬元素的化合价由+6价降低到+3价,被还原,K2Cr2O7作氧化剂。(2)HCl→Cl2,氯元素化合价升高,发生氧化反应,Cl2为氧化产物。(3)14个HCl分子参加反应,有6个HCl分子被氧化,生成3个Cl2分子,另外8个HCl分子起酸性作用,所以起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为6∶8=3∶4。(4)氯元素的化合价由-1价变到0价,故生成3分子Cl2转移电子数为3×2×[0-(-1)]=6个。
典例4.
汽车尾气转化反应之一是2CO +2NO N2+2CO2,有关该反应的说法正确的是( )
A.CO是氧化剂 B.NO被氧化
C.CO得到电子 D.NO发生还原反应
课堂练习
【答案】D
【解析】CO在反应中失去电子,化合价升高,被氧化,是还原剂;NO是氧化剂,被还原,发生还原反应;故选D
典例4.
碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。
我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)上述反应中,氧化剂、还原剂、氧化产物、还原产物分别是什么物质?
(2)上述反应中,氧化产物与还原产物的质量比是多少?
(3)请分别用双线桥法和单线桥法标出该反应中电子转移的方向和数目。
课堂练习
课堂小结
【答案】 (1)氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2。
(2)5∶1。
(3)双线桥:
课堂小结
感 谢 倾 听
