【核心素养目标】人教版(2019)高一化学必修第一册 2.1 钠及其化合物(第2课时 钠的氧化物)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 2.1 钠及其化合物(第2课时 钠的氧化物) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 00:00:00 | ||
图片预览






文档简介
第一节 钠及其化合物
第2课时 钠的氧化物
人教版必修第一册
榆次一中 李金虎
学习目标
1.通过对比学习氧化钠、过氧化钠的物理、化学性质。
2.了解钠氧化物的用途。
学习目标
1.结合真实情境或实验,了解钠的氧化物的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠的氧化物的应用,培养学生“科学态度与社会责任”的核心素养。
素养目标
情境引入
潜水艇中通常用过氧化钠作为供氧剂,你知道这是为什么吗?
教学过程
2. 化学性质:氧化钠是碱性氧化物,具有碱性氧化物的通性,如能与水、酸、酸性氧化物等反应。
(1)与水反应:__________________________________
(2)与盐酸反应:________________________________
(3)与CO2反应:________________________________
Na2O+H2O=2NaOH
Na2O+2HCl=2NaCl+H2O
Na2O+CO2=Na2CO3
一、氧化钠的性质
1. 物理性质:氧化钠是一种白色固体。
教学过程
1. 物理性质:过氧化钠是一种淡黄色固体。
二、过氧化钠的性质
2. 化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性。
思考:Na2O2中阴、阳离子数之比是多少呢?
注意:Na2O2中阴、阳离子数之比是1∶2,而不是1∶1
教学过程
过氧化钠和水的反应
教学过程
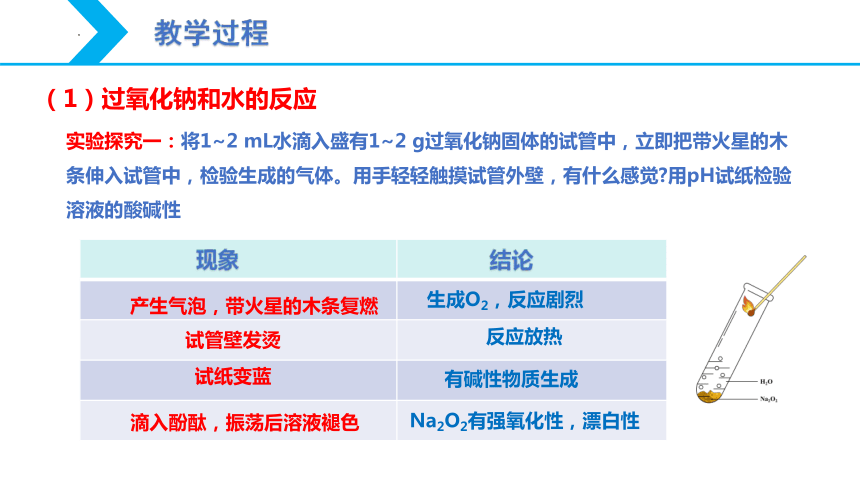
实验探究一:将1~2 mL水滴入盛有1~2 g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
(1)过氧化钠和水的反应
产生气泡,带火星的木条复燃
生成O2,反应剧烈
反应放热
试管壁发烫
试纸变蓝
有碱性物质生成
滴入酚酞,振荡后溶液褪色
Na2O2有强氧化性,漂白性
现象
结论
教学过程
现象
结论
得 2 × e-
2Na2O2 +2H2O
失 2 × e-
-1 -2 -2 0
Na2O2既是氧化剂,又是还原剂
= 4NaOH + O2↑
(1)过氧化钠和水的反应
教学过程
Na2O2为什么会使酚酞先变红后褪色?
思考:
将 Na2O2 投入滴有酚酞的水中, Na2O2 与水反应生成 NaOH,使酚酞先变红;同时,Na2O2与水反应过程中,还生成了不是很稳定的中间产物H2O2,具有漂白性,使变色后的酚酞氧化褪色。
2Na2O2+2H2O = 4NaOH+H2O2
2H2O2 = 2H2O+O2 ↑
第一步:
第二步:
教学过程
现象
结论
得 2 × e-
2Na2O2 +2CO2
失 2 × e-
-1 -2 -2 0
Na2O2既是氧化剂,又是还原剂
= 4NaCO3 + O2
(2)过氧化钠和CO2的反应
应用:Na2O2做呼吸面具、潜水艇的供氧剂。
教学过程
(2)过氧化钠和CO2的反应
吹气生火
教学过程
(3)过氧化钠和HCl的反应
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
过氧化钠是碱性氧化物吗?
Na2O2不是碱性氧化物,是过氧化物。
思考:
教学过程
知识拓展——过氧化钠的强氧化性与还原性
Na2O2中氧元素为-1价,处于中间价态,既有氧化性又有还原性。Na2O2主要表现较强的氧化性:
(1)Na2O2与SO2反应:Na2O2+SO2= Na2SO4
(2)Na2O2投入Na2SO3溶液中,可将SO32?氧化成SO42?
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(5)Na2O2 投入品红溶液中,可使品红溶液褪色
(6)Na2O2能使酚酞试液先变红后褪色
Na2O2也有还原性,如遇KMnO4等强氧化剂时,被氧化成O2。
?
教学过程
?
Na2O
Na2O2
颜色
白色
淡黄色
阴阳离子个数比
1∶2
1∶2
氧元素的化合价
-2
-1
是否为碱性氧化物
是
否
与H2O反应
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
与CO2反应
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
与盐酸反应
Na2O + 2HCl = 2NaCl + H2O
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
氧化性/漂白性
无
有
主要用途
制备NaOH
强氧化剂、漂白剂、供氧剂
归纳总结——氧化钠与过氧化钠
典例1.
下列叙述中正确的是( )
A.过氧化钠是淡黄色固体,久置于空气中变成白色氢氧化钠固体
B.过氧化钠中阴、阳离子比例为1∶2
C.用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色
D.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
课堂练习
【答案】B
【解析】过氧化钠久置于空气中变成白色碳酸钠固体,A错误;过氧化钠漂白是由于它的氧化性将有色物质永久漂白,C错误;碱性氧化物与酸反应生成盐和水,Na2O2与酸反应生成盐、水和氧气,不是碱性氧化物,属于过氧化物,D错误。。
典例2.
下列叙述中正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A.都正确 B.②③④⑤ C. ②③⑤ D.④⑤
课堂练习
【答案】D 【解析】Na2O是NaOH的碱性氧化物,但Na2O2与水反应时还生成O2,不是碱性氧化物;Na2O2与CO2的反应不符合置换反应的特点;Na2O2有强氧化性,因其中-1价O易得电子变为其稳定价态-2价,而Na2O的氧化性、还原性都很弱。
课堂小结
感 谢 倾 听
第2课时 钠的氧化物
人教版必修第一册
榆次一中 李金虎
学习目标
1.通过对比学习氧化钠、过氧化钠的物理、化学性质。
2.了解钠氧化物的用途。
学习目标
1.结合真实情境或实验,了解钠的氧化物的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠的氧化物的应用,培养学生“科学态度与社会责任”的核心素养。
素养目标
情境引入
潜水艇中通常用过氧化钠作为供氧剂,你知道这是为什么吗?
教学过程
2. 化学性质:氧化钠是碱性氧化物,具有碱性氧化物的通性,如能与水、酸、酸性氧化物等反应。
(1)与水反应:__________________________________
(2)与盐酸反应:________________________________
(3)与CO2反应:________________________________
Na2O+H2O=2NaOH
Na2O+2HCl=2NaCl+H2O
Na2O+CO2=Na2CO3
一、氧化钠的性质
1. 物理性质:氧化钠是一种白色固体。
教学过程
1. 物理性质:过氧化钠是一种淡黄色固体。
二、过氧化钠的性质
2. 化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性。
思考:Na2O2中阴、阳离子数之比是多少呢?
注意:Na2O2中阴、阳离子数之比是1∶2,而不是1∶1
教学过程
过氧化钠和水的反应
教学过程
实验探究一:将1~2 mL水滴入盛有1~2 g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
(1)过氧化钠和水的反应
产生气泡,带火星的木条复燃
生成O2,反应剧烈
反应放热
试管壁发烫
试纸变蓝
有碱性物质生成
滴入酚酞,振荡后溶液褪色
Na2O2有强氧化性,漂白性
现象
结论
教学过程
现象
结论
得 2 × e-
2Na2O2 +2H2O
失 2 × e-
-1 -2 -2 0
Na2O2既是氧化剂,又是还原剂
= 4NaOH + O2↑
(1)过氧化钠和水的反应
教学过程
Na2O2为什么会使酚酞先变红后褪色?
思考:
将 Na2O2 投入滴有酚酞的水中, Na2O2 与水反应生成 NaOH,使酚酞先变红;同时,Na2O2与水反应过程中,还生成了不是很稳定的中间产物H2O2,具有漂白性,使变色后的酚酞氧化褪色。
2Na2O2+2H2O = 4NaOH+H2O2
2H2O2 = 2H2O+O2 ↑
第一步:
第二步:
教学过程
现象
结论
得 2 × e-
2Na2O2 +2CO2
失 2 × e-
-1 -2 -2 0
Na2O2既是氧化剂,又是还原剂
= 4NaCO3 + O2
(2)过氧化钠和CO2的反应
应用:Na2O2做呼吸面具、潜水艇的供氧剂。
教学过程
(2)过氧化钠和CO2的反应
吹气生火
教学过程
(3)过氧化钠和HCl的反应
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑
过氧化钠是碱性氧化物吗?
Na2O2不是碱性氧化物,是过氧化物。
思考:
教学过程
知识拓展——过氧化钠的强氧化性与还原性
Na2O2中氧元素为-1价,处于中间价态,既有氧化性又有还原性。Na2O2主要表现较强的氧化性:
(1)Na2O2与SO2反应:Na2O2+SO2= Na2SO4
(2)Na2O2投入Na2SO3溶液中,可将SO32?氧化成SO42?
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(5)Na2O2 投入品红溶液中,可使品红溶液褪色
(6)Na2O2能使酚酞试液先变红后褪色
Na2O2也有还原性,如遇KMnO4等强氧化剂时,被氧化成O2。
?
教学过程
?
Na2O
Na2O2
颜色
白色
淡黄色
阴阳离子个数比
1∶2
1∶2
氧元素的化合价
-2
-1
是否为碱性氧化物
是
否
与H2O反应
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
与CO2反应
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
与盐酸反应
Na2O + 2HCl = 2NaCl + H2O
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
氧化性/漂白性
无
有
主要用途
制备NaOH
强氧化剂、漂白剂、供氧剂
归纳总结——氧化钠与过氧化钠
典例1.
下列叙述中正确的是( )
A.过氧化钠是淡黄色固体,久置于空气中变成白色氢氧化钠固体
B.过氧化钠中阴、阳离子比例为1∶2
C.用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色
D.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
课堂练习
【答案】B
【解析】过氧化钠久置于空气中变成白色碳酸钠固体,A错误;过氧化钠漂白是由于它的氧化性将有色物质永久漂白,C错误;碱性氧化物与酸反应生成盐和水,Na2O2与酸反应生成盐、水和氧气,不是碱性氧化物,属于过氧化物,D错误。。
典例2.
下列叙述中正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A.都正确 B.②③④⑤ C. ②③⑤ D.④⑤
课堂练习
【答案】D 【解析】Na2O是NaOH的碱性氧化物,但Na2O2与水反应时还生成O2,不是碱性氧化物;Na2O2与CO2的反应不符合置换反应的特点;Na2O2有强氧化性,因其中-1价O易得电子变为其稳定价态-2价,而Na2O的氧化性、还原性都很弱。
课堂小结
感 谢 倾 听
