【核心素养目标】人教版(2019)高一化学必修第一册 2.2 氯及其化合物(第2课时 氯气与碱的反应 氯离子的检验)(共20张PPT)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 2.2 氯及其化合物(第2课时 氯气与碱的反应 氯离子的检验)(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览






文档简介
(共20张PPT)
第二节 氯及其化合物
第2课时 氯气与碱的反应 氯离子的检验
人教版必修第一册
榆次一中 李金虎
学习目标
1.掌握氯气与碱反应及相关的生活生产应用。
2.掌握氯离子的检验方法。
学习目标
1.能通过实验探究次氯酸盐的性质,培养学生“实验探究与证据推理”的核心素养。
2.建立含氯元素的物质间的转化关系,培养学生“变化观念与模型认知”的核心素养。
素养目标
情境引入
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上,人们制得了次氯酸钠(NaClO) 、次氯酸钙[Ca(ClO)2]等具有漂白作用的次氯酸盐。
教学过程
一、氯气与碱的反应
1.与氢氧化钠溶液反应——制取漂白液
(1)化学方程式:_____________________________________。
(2)离子方程式:_____________________________________。
(3)漂白液的主要成分是_______________,有效成分是_______。
NaClO、NaCl
NaClO
Cl2 + 2NaOH === NaCl + NaClO + H2O
Cl2 + 2OH- === Cl- + ClO- + H2O
常温下,将Cl2通入NaOH溶液中,即可得到漂白液
教学过程
(4)氯气与碱的反应
2.与石灰乳反应——制取漂白粉
Ca(ClO)2、CaCl2
将Cl2通入冷的石灰乳[Ca(OH)2]中,即可得到漂白粉(精)
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
(2)漂白粉的主要成分是 ,有效成分是_______。
漂白精的有效成分是___________
Ca(ClO)2
漂白液、漂白粉和漂粉精既可作漂白剂又可作消毒剂
(1)化学方程式:_____________________________________。
教学过程
二、漂白原理
使用说明
【主要成分】次氯酸钙、氯化钙
【用途用量】取漂白粉2至3g,水1000g,配成溶液,将衣物等浸泡其中5至10分钟。如需要,浓度可提高,时间可延长。
【注意事项】密封避光保存于阴凉处,随配随用,有腐蚀性,少与手接触。
浸泡过程中,漂白液,漂白粉(精)溶于水后与空气中CO2充分接触生成了HClO,从而可以用来漂白衣物
教学过程
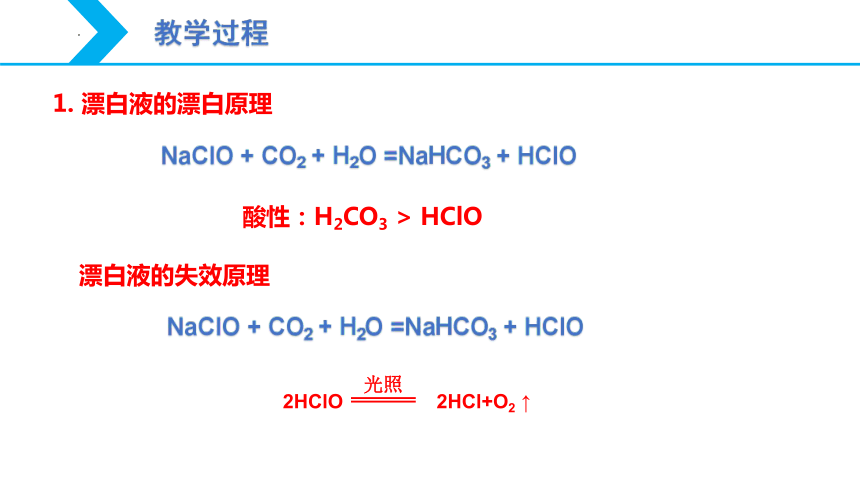
NaClO + CO2 + H2O =NaHCO3 + HClO
NaClO + CO2 + H2O =NaHCO3 + HClO
漂白液的失效原理
酸性:H2CO3 > HClO
1. 漂白液的漂白原理
2HClO 2HCl+O2 ↑
光照
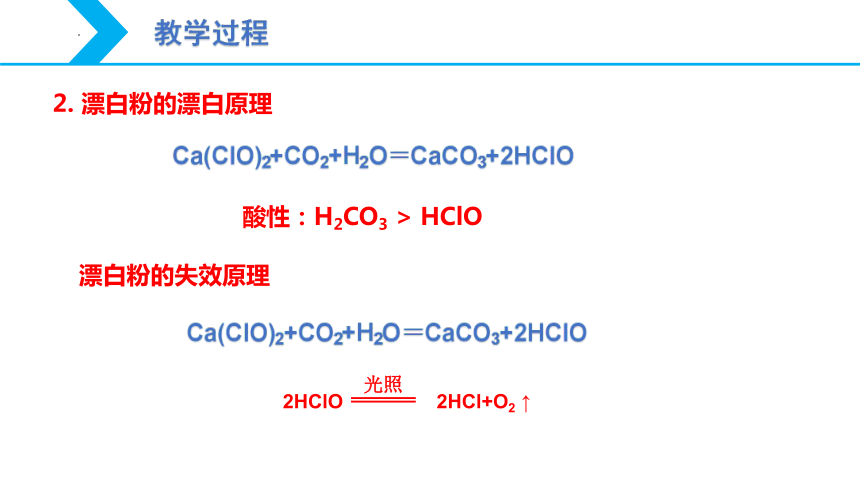
教学过程
漂白粉的失效原理
酸性:H2CO3 > HClO
2. 漂白粉的漂白原理
2HClO 2HCl+O2 ↑
光照
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
教学过程
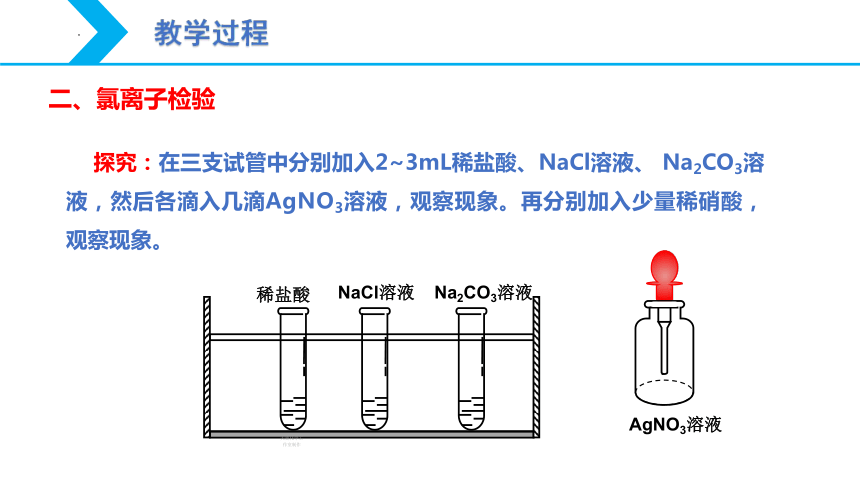
二、氯离子检验
探究:在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、 Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
稀盐酸
NaCl溶液
Na2CO3溶液
大鹿化学工作室制作
AgNO3溶液
教学过程
教学过程
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸 ①稀盐酸
②氯化钠溶液
③碳酸钠溶液
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀溶解,
有气泡产生
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
CO32-+2Ag+=Ag2CO3↓
实验现象
教学过程
二、氯离子的检验
1. 检验原理:__________________________________。
2. 检验步骤:取少量待测液于试管中,加入_______酸化的_______溶液,若____________,说明溶液中含有Cl-。
注意:加稀硝酸酸化的目的是排除CO32-等的干扰,因为Ag2CO3可溶于稀硝酸,而AgCl不溶
Ag++Cl-===AgCl↓
稀硝酸
AgNO3
产生白色沉淀
产生白色沉淀
典例1.
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
课堂练习
【答案】C
【解析】A项操作不正确,不能排除CO的干扰;B项操作不正确,因为Ag2CO3跟HCl反应时,生成的AgCl仍是白色沉淀;D项操作不正确,用盐酸酸化引入了Cl-,不能确定原溶液中是否有Cl-。
典例2.
用Cl2与消石灰充分反应可以制取漂白粉。使用漂白粉作漂白剂比使用氯水更好的理由是( )
A.转变为易与水反应的物质
B.转变为较为稳定、便于贮存的物质
C.Ca(ClO)2比HClO漂白效果快
D.提高氯的质量分数
课堂练习
【答案】B
【解析】氯水不稳定,不易贮存,而漂白粉稳定,易于贮存。
典例3.
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
课堂练习
【答案】C
【解析】A项操作不正确,不能排除CO的干扰;B项操作不正确,因为Ag2CO3跟HCl反应时,生成的AgCl仍是白色沉淀;D项操作不正确,用盐酸酸化引入了Cl-,不能确定原溶液中是否有Cl-。
典例4.
在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-、 SO42- B.Cl-、 NO3-
C.Cl-、 CO32- D.Cl-、OH-
课堂练习
【答案】C
典例5.
NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
A.25 ℃时,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.上图所示转化反应都是氧化还原反应
课堂练习
【答案】B
课堂小结
课后小任务
含氯消毒剂能杀灭新型冠状病毒,常用的含氯消毒剂有漂白粉、“84”消毒液、二氧化氯等。“84”消毒液的主要成分是什么?“84”消毒液能否与洁厕灵(主要成分是盐酸)混合使用?
“84”消毒液的主要成分是NaClO
“84”消毒液能与洁厕灵会产生有毒气体Cl2,NaClO+2HCl = NaCl+Cl2↑+H2O,不能混用。
×
感 谢 倾 听
第二节 氯及其化合物
第2课时 氯气与碱的反应 氯离子的检验
人教版必修第一册
榆次一中 李金虎
学习目标
1.掌握氯气与碱反应及相关的生活生产应用。
2.掌握氯离子的检验方法。
学习目标
1.能通过实验探究次氯酸盐的性质,培养学生“实验探究与证据推理”的核心素养。
2.建立含氯元素的物质间的转化关系,培养学生“变化观念与模型认知”的核心素养。
素养目标
情境引入
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上,人们制得了次氯酸钠(NaClO) 、次氯酸钙[Ca(ClO)2]等具有漂白作用的次氯酸盐。
教学过程
一、氯气与碱的反应
1.与氢氧化钠溶液反应——制取漂白液
(1)化学方程式:_____________________________________。
(2)离子方程式:_____________________________________。
(3)漂白液的主要成分是_______________,有效成分是_______。
NaClO、NaCl
NaClO
Cl2 + 2NaOH === NaCl + NaClO + H2O
Cl2 + 2OH- === Cl- + ClO- + H2O
常温下,将Cl2通入NaOH溶液中,即可得到漂白液
教学过程
(4)氯气与碱的反应
2.与石灰乳反应——制取漂白粉
Ca(ClO)2、CaCl2
将Cl2通入冷的石灰乳[Ca(OH)2]中,即可得到漂白粉(精)
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
(2)漂白粉的主要成分是 ,有效成分是_______。
漂白精的有效成分是___________
Ca(ClO)2
漂白液、漂白粉和漂粉精既可作漂白剂又可作消毒剂
(1)化学方程式:_____________________________________。
教学过程
二、漂白原理
使用说明
【主要成分】次氯酸钙、氯化钙
【用途用量】取漂白粉2至3g,水1000g,配成溶液,将衣物等浸泡其中5至10分钟。如需要,浓度可提高,时间可延长。
【注意事项】密封避光保存于阴凉处,随配随用,有腐蚀性,少与手接触。
浸泡过程中,漂白液,漂白粉(精)溶于水后与空气中CO2充分接触生成了HClO,从而可以用来漂白衣物
教学过程
NaClO + CO2 + H2O =NaHCO3 + HClO
NaClO + CO2 + H2O =NaHCO3 + HClO
漂白液的失效原理
酸性:H2CO3 > HClO
1. 漂白液的漂白原理
2HClO 2HCl+O2 ↑
光照
教学过程
漂白粉的失效原理
酸性:H2CO3 > HClO
2. 漂白粉的漂白原理
2HClO 2HCl+O2 ↑
光照
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
教学过程
二、氯离子检验
探究:在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、 Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
稀盐酸
NaCl溶液
Na2CO3溶液
大鹿化学工作室制作
AgNO3溶液
教学过程
教学过程
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸 ①稀盐酸
②氯化钠溶液
③碳酸钠溶液
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀溶解,
有气泡产生
Cl-+Ag+= AgCl↓
Cl-+Ag+= AgCl↓
Ag2CO3+2H+= 2Ag++CO2↑+H2O
CO32-+2Ag+=Ag2CO3↓
实验现象
教学过程
二、氯离子的检验
1. 检验原理:__________________________________。
2. 检验步骤:取少量待测液于试管中,加入_______酸化的_______溶液,若____________,说明溶液中含有Cl-。
注意:加稀硝酸酸化的目的是排除CO32-等的干扰,因为Ag2CO3可溶于稀硝酸,而AgCl不溶
Ag++Cl-===AgCl↓
稀硝酸
AgNO3
产生白色沉淀
产生白色沉淀
典例1.
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
课堂练习
【答案】C
【解析】A项操作不正确,不能排除CO的干扰;B项操作不正确,因为Ag2CO3跟HCl反应时,生成的AgCl仍是白色沉淀;D项操作不正确,用盐酸酸化引入了Cl-,不能确定原溶液中是否有Cl-。
典例2.
用Cl2与消石灰充分反应可以制取漂白粉。使用漂白粉作漂白剂比使用氯水更好的理由是( )
A.转变为易与水反应的物质
B.转变为较为稳定、便于贮存的物质
C.Ca(ClO)2比HClO漂白效果快
D.提高氯的质量分数
课堂练习
【答案】B
【解析】氯水不稳定,不易贮存,而漂白粉稳定,易于贮存。
典例3.
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
课堂练习
【答案】C
【解析】A项操作不正确,不能排除CO的干扰;B项操作不正确,因为Ag2CO3跟HCl反应时,生成的AgCl仍是白色沉淀;D项操作不正确,用盐酸酸化引入了Cl-,不能确定原溶液中是否有Cl-。
典例4.
在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-、 SO42- B.Cl-、 NO3-
C.Cl-、 CO32- D.Cl-、OH-
课堂练习
【答案】C
典例5.
NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法中正确的是( )
A.25 ℃时,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.上图所示转化反应都是氧化还原反应
课堂练习
【答案】B
课堂小结
课后小任务
含氯消毒剂能杀灭新型冠状病毒,常用的含氯消毒剂有漂白粉、“84”消毒液、二氧化氯等。“84”消毒液的主要成分是什么?“84”消毒液能否与洁厕灵(主要成分是盐酸)混合使用?
“84”消毒液的主要成分是NaClO
“84”消毒液能与洁厕灵会产生有毒气体Cl2,NaClO+2HCl = NaCl+Cl2↑+H2O,不能混用。
×
感 谢 倾 听
