【核心素养目标】人教版(2019)高一化学必修第一册 2.1 钠及其化合物(第3课时 碳酸钠和碳酸氢钠)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 2.1 钠及其化合物(第3课时 碳酸钠和碳酸氢钠) |

|
|
| 格式 | pptx | ||
| 文件大小 | 170.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览






文档简介
(共27张PPT)
第一节 钠及其化合物
第3课时 碳酸钠与碳酸氢钠
人教版必修第一册
榆次一中 李金虎
学习目标
1.通过对比学习碳酸钠、碳酸氢钠的物理、化学性质。
2.了解钠碳酸钠、碳酸氢钠的用途。
学习目标
1.结合真实情境或实验,了解碳酸钠、碳酸氢钠的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解碳酸钠、碳酸氢钠的应用,培养学生“科学态度与社会责任”的核心素养。
素养目标
情境引入
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
教学过程
教学过程
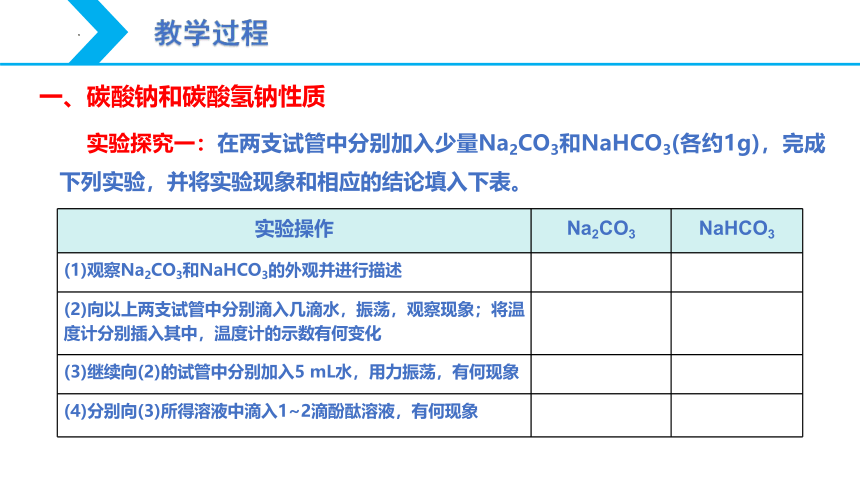
一、碳酸钠和碳酸氢钠性质
实验探究一:在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
实验操作 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
教学过程
教学过程
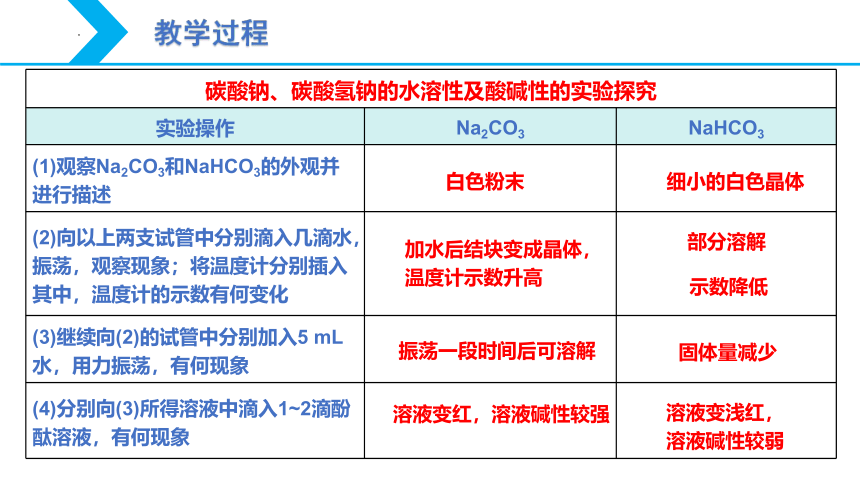
碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究 实验操作 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
细小的白色晶体
白色粉末
加水后结块变成晶体,温度计示数升高
振荡一段时间后可溶解
固体量减少
溶液变红,溶液碱性较强
溶液变浅红,
溶液碱性较弱
部分溶解
示数降低
教学过程
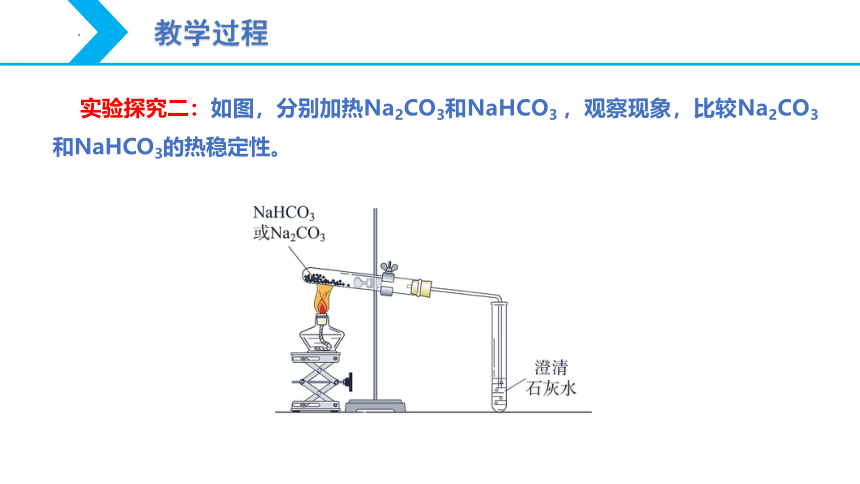
实验探究二:如图,分别加热Na2CO3和NaHCO3 ,观察现象,比较Na2CO3和NaHCO3的热稳定性。
教学过程
教学过程
实验操作 实验现象 实验结论
澄清石灰水
澄清石灰水
化学方程式:
不变浑浊
Na2CO3很稳定,受热不易发生分解
变浑浊
NaHCO3不稳定,受热容易分解
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
总结归纳
Na2CO3 NaHCO3
俗名
颜色状态
溶解性 水溶液的碱性 热稳定性 用途
纯碱、苏打
小苏打
白色粉末
细小白色晶体
都易溶于水,相同温度下,溶解度:Na2CO3 > NaHCO3
浓度相同时,碱性:Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
NaHCO3受热分解:
纺织、造纸、合成洗涤剂、制玻璃等
发酵粉、灭火剂、治疗胃酸过多
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
HCl少量:________________________________
HCl过量:________________________________
Na2CO3:
NaHCO3 :
Na2CO3 + HCl= NaHCO3 +NaCl
Na2CO3 + 2HCl=2NaCl+H2O +CO2↑
NaHCO3 +HCl=NaCl+H2O+CO2↑
Na2CO3:不反应
NaHCO3 :
NaHCO3 + NaOH = Na2CO3 + H2O
一、碳酸钠和碳酸氢钠性质
1. 盐酸
2. 氢氧化钠
教学过程
NaHCO3少量:__________________________________________
NaHCO3过量:__________________________________________
Na2CO3:
NaHCO3 :
Na2CO3:
NaHCO3 :不反应
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
Ca2++OH-+HCO3- = CaCO3↓+H2O
Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32-
Na2CO3 + CO2 + H2O = 2NaHCO3
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
一、碳酸钠和碳酸氢钠性质
3. Ca(OH)2
4. CO2
5. BaCl2
教学过程
二、碳酸钠、碳酸氢钠的鉴别
物质 操作 Na2CO3 NaHCO3
固体加热
无明显现象
有气体产生,且使澄清石灰水变浑浊
加BaCl2(CaCl2)溶液
白色沉淀
无明显现象
滴加少量盐酸
开始无气泡
开始有气泡
能否用Ba(OH)2或Ca(OH)2溶液鉴别 Na2CO3 和 NaHCO3?
思考:
教学过程
(1)利用热稳定性不同
(2)相同条件下利用反应速率不同
思维建模
1.鉴别
(3)利用阴离子不同
(4)利用溶液的碱性不同
教学过程
2.相互转化
(1)Na2CO3溶液→NaHCO3溶液:Na2CO3+H2O+CO2=2NaHCO3。
(2)NaHCO3→Na2CO3:
① (固体物质)
② (溶液中) NaHCO3+NaOH=Na2CO3+H2O。
Na2CO3 NaHCO3
CO2+H2O
加热或NaOH
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
三、焰色试验
1. 定义
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
教学过程
洗
烧
蘸
用盐酸洗净铂丝(或光洁无锈的铁丝)
将洗净的铂丝在火焰上灼烧至与原火焰颜色相同
蘸取待测物质
烧
在酒精灯上灼烧,并观察火焰的颜色
洗
2. 实验操作
用盐酸洗净铂丝(或光洁无锈的铁丝)
教学过程
教学过程
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
典例1.
下列关于Na2CO3和NaHCO3性质的说法,正确的是 ( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3C.与稀盐酸反应生成CO2的速率:NaHCO3D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
课堂练习
【答案】B
【解析】 A项,在水中的溶解度:NaHCO3Na2CO3;D项,NaHCO3与Na2CO3之间可以相互转化。
典例2.
焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
课堂练习
【答案】C
典例3.
用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
课堂练习
【答案】 (1)H2O CO2 (2)> (3)不能;因为大试管中加热温度高,而小试管中温度低,NaHCO3受热分解的原因也可能是温度高造成的。
课堂小结
课后小任务
阅读材料,查阅资料,比较索尔维法和侯氏制碱法。
课后小任务
优缺点:氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。索尔维制碱法的缺点,主要在于原料中各有一半的比分没有利用上,只用了食盐中的钠和石灰中的碳酸根,二者结合才生成了纯碱。食盐中另一半的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
优点:CO2、饱和食盐水能循环使用,体现绿色化学思想,能充分利用食盐中的钠和氯,避免产生大量的氯化钙废液和废渣,并可节省一些设备。
索尔维法
侯氏制碱法
感 谢 倾 听
第一节 钠及其化合物
第3课时 碳酸钠与碳酸氢钠
人教版必修第一册
榆次一中 李金虎
学习目标
1.通过对比学习碳酸钠、碳酸氢钠的物理、化学性质。
2.了解钠碳酸钠、碳酸氢钠的用途。
学习目标
1.结合真实情境或实验,了解碳酸钠、碳酸氢钠的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解碳酸钠、碳酸氢钠的应用,培养学生“科学态度与社会责任”的核心素养。
素养目标
情境引入
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
教学过程
教学过程
一、碳酸钠和碳酸氢钠性质
实验探究一:在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。
实验操作 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
教学过程
教学过程
碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究 实验操作 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
细小的白色晶体
白色粉末
加水后结块变成晶体,温度计示数升高
振荡一段时间后可溶解
固体量减少
溶液变红,溶液碱性较强
溶液变浅红,
溶液碱性较弱
部分溶解
示数降低
教学过程
实验探究二:如图,分别加热Na2CO3和NaHCO3 ,观察现象,比较Na2CO3和NaHCO3的热稳定性。
教学过程
教学过程
实验操作 实验现象 实验结论
澄清石灰水
澄清石灰水
化学方程式:
不变浑浊
Na2CO3很稳定,受热不易发生分解
变浑浊
NaHCO3不稳定,受热容易分解
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
总结归纳
Na2CO3 NaHCO3
俗名
颜色状态
溶解性 水溶液的碱性 热稳定性 用途
纯碱、苏打
小苏打
白色粉末
细小白色晶体
都易溶于水,相同温度下,溶解度:Na2CO3 > NaHCO3
浓度相同时,碱性:Na2CO3 > NaHCO3
Na2CO3 > NaHCO3
NaHCO3受热分解:
纺织、造纸、合成洗涤剂、制玻璃等
发酵粉、灭火剂、治疗胃酸过多
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
HCl少量:________________________________
HCl过量:________________________________
Na2CO3:
NaHCO3 :
Na2CO3 + HCl= NaHCO3 +NaCl
Na2CO3 + 2HCl=2NaCl+H2O +CO2↑
NaHCO3 +HCl=NaCl+H2O+CO2↑
Na2CO3:不反应
NaHCO3 :
NaHCO3 + NaOH = Na2CO3 + H2O
一、碳酸钠和碳酸氢钠性质
1. 盐酸
2. 氢氧化钠
教学过程
NaHCO3少量:__________________________________________
NaHCO3过量:__________________________________________
Na2CO3:
NaHCO3 :
Na2CO3:
NaHCO3 :不反应
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
Ca2++OH-+HCO3- = CaCO3↓+H2O
Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32-
Na2CO3 + CO2 + H2O = 2NaHCO3
Na2CO3:
NaHCO3 :不反应
Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl
一、碳酸钠和碳酸氢钠性质
3. Ca(OH)2
4. CO2
5. BaCl2
教学过程
二、碳酸钠、碳酸氢钠的鉴别
物质 操作 Na2CO3 NaHCO3
固体加热
无明显现象
有气体产生,且使澄清石灰水变浑浊
加BaCl2(CaCl2)溶液
白色沉淀
无明显现象
滴加少量盐酸
开始无气泡
开始有气泡
能否用Ba(OH)2或Ca(OH)2溶液鉴别 Na2CO3 和 NaHCO3?
思考:
教学过程
(1)利用热稳定性不同
(2)相同条件下利用反应速率不同
思维建模
1.鉴别
(3)利用阴离子不同
(4)利用溶液的碱性不同
教学过程
2.相互转化
(1)Na2CO3溶液→NaHCO3溶液:Na2CO3+H2O+CO2=2NaHCO3。
(2)NaHCO3→Na2CO3:
① (固体物质)
② (溶液中) NaHCO3+NaOH=Na2CO3+H2O。
Na2CO3 NaHCO3
CO2+H2O
加热或NaOH
2NaHCO3 Na2CO3 + H2O + CO2↑
教学过程
三、焰色试验
1. 定义
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
教学过程
洗
烧
蘸
用盐酸洗净铂丝(或光洁无锈的铁丝)
将洗净的铂丝在火焰上灼烧至与原火焰颜色相同
蘸取待测物质
烧
在酒精灯上灼烧,并观察火焰的颜色
洗
2. 实验操作
用盐酸洗净铂丝(或光洁无锈的铁丝)
教学过程
教学过程
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
典例1.
下列关于Na2CO3和NaHCO3性质的说法,正确的是 ( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3
课堂练习
【答案】B
【解析】 A项,在水中的溶解度:NaHCO3
典例2.
焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
课堂练习
【答案】C
典例3.
用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
课堂练习
【答案】 (1)H2O CO2 (2)> (3)不能;因为大试管中加热温度高,而小试管中温度低,NaHCO3受热分解的原因也可能是温度高造成的。
课堂小结
课后小任务
阅读材料,查阅资料,比较索尔维法和侯氏制碱法。
课后小任务
优缺点:氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。索尔维制碱法的缺点,主要在于原料中各有一半的比分没有利用上,只用了食盐中的钠和石灰中的碳酸根,二者结合才生成了纯碱。食盐中另一半的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
优点:CO2、饱和食盐水能循环使用,体现绿色化学思想,能充分利用食盐中的钠和氯,避免产生大量的氯化钙废液和废渣,并可节省一些设备。
索尔维法
侯氏制碱法
感 谢 倾 听
