【核心素养目标】人教版(2019)高一化学必修第一册 3.1 铁及其化合物(第2课时 铁的重要化合物)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 3.1 铁及其化合物(第2课时 铁的重要化合物) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
第一节 铁及其化合物
第2课时 铁的重要化合物
人教版必修第一册
榆次一中 李金虎
学习目标
1.了解铁及其重要化合物的重要性质及实验现象。
2.了解Fe(OH)2 、Fe(OH)3的制备方法。
学习目标
1.能用氧化还原反应原理认识铁及其化合物的化学性质,培养学生“实验探究与证据推理”的核心素养。
2.根据物质的分类和实验事实,了解铁的氧化物和氢氧化物的主要性质,培养“宏观辨识与微观探析”的核心素养。
素养目标
情境引入
Fe2O3 可作外墙涂料
Fe3O4 是一种常用的磁性材料?
情境引入
丹霞地貌的岩层因含(Fe2O3)而呈红色
丹霞地貌在我国广泛分布,如:四川的蜀南竹海、七洞沟;贵州赤水;广东丹霞山;江西龙虎山等。
教学过程
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名
矿石
颜色状态 ____色粉末 ____色粉末 ____色晶体
化合价
溶解性 用途
铁红
磁性氧化铁
赤铁矿
磁铁矿
+2
+3
+2,+3
不溶于水
红色油漆和涂料
炼铁原料
黑
红棕
黑
教学过程
2.化学性质
①稳定性
FeO不稳定,在空气中受热:
Fe2O3和 Fe3O4很稳定。
6 FeO + O2 ==== 2 Fe3O4
△
②与非氧化性酸(如稀盐酸、稀硫酸)反应
FeO和Fe2O3属于碱性氧化物,与非氧化性酸反应生成亚铁盐和铁盐
与稀盐酸反应(化学方程式) 与稀盐酸反应(离子方程式)
FeO
Fe2O3
Fe3O4
FeO+2HCl===FeCl2+H2O
FeO + 2H+ === Fe2+ + H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3 + 6H+ === 2Fe3+ + 3H2O
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O
Fe3O4 + 8H+ === Fe2+ + 2Fe3+ + 4H2O
教学过程
二、铁的氢氧化物
1.物理性质
化学式 Fe(OH)2 Fe(OH)3
颜色状态 ____色固体 ____色固体
化合价 +2 +3
溶解性 难溶于水 白
红褐
教学过程
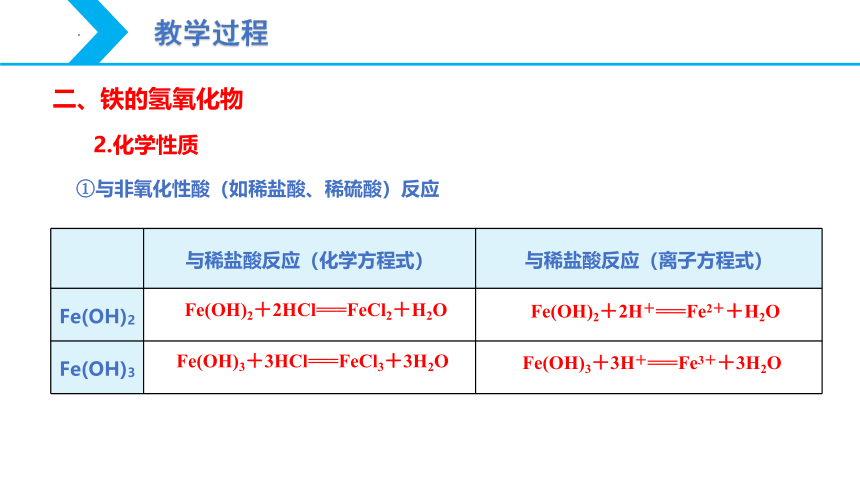
二、铁的氢氧化物
2.化学性质
与稀盐酸反应(化学方程式) 与稀盐酸反应(离子方程式)
Fe(OH)2
Fe(OH)3
①与非氧化性酸(如稀盐酸、稀硫酸)反应
Fe(OH)2+2HCl===FeCl2+H2O
Fe(OH)2+2H+===Fe2++H2O
Fe(OH)3+3HCl===FeCl3+3H2O
Fe(OH)3+3H+===Fe3++3H2O
教学过程
②热稳定性
Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物
Fe(OH)2:__________________________________
Fe(OH)3:__________________________________
Fe(OH)2 === FeO+H2O
△
2Fe(OH)3 === Fe2O3 + 3H2O
△
教学过程
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
Fe(OH)3
Fe(OH)2
实验探究
教学过程
教学过程
现象:_________________,
离子方程式:________________________。
现象:_________________________,
离子方程式:________________________,
________________________________________。
实验室制备氢氧化铁和氢氧化亚铁如图所示:
有红褐色沉淀生成
Fe3++3OH-=Fe(OH)3↓
白色沉淀 灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
教学过程
1.Fe2+极易被氧化,所以FeSO4溶液要现用现配。
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
2.为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
3.为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
4.为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
三、Fe(OH)2制备
教学过程
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过 ,目的是: 。
(2)在FeSO4溶液表面覆盖一层苯,作用是: 。
【例1】氢氧化亚铁制备实验的改进
加热煮沸
赶走溶解的氧气
隔绝空气中的氧气
教学过程
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是 。
(4)在试管Ⅱ里加入的试剂是 。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_____________________________________________________________________。
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
_______________________________________________________________。
稀H2SO4、铁屑
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
教学过程
铁及其化合物 价类二维图
典例1.
“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能是( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖瓦则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
课堂练习
【答案】D
典例2.
铁有+2价和+3价两种价态。下列有关反应中不涉及铁元素价态变化的是( )
A.铁粉溶于稀硫酸
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
课堂练习
【答案】D
典例3.
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时提供的试剂有铁屑及6.00 mol·L-1的硫酸,NaOH溶液,下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭活塞E,使A中溶液压入B中
D.取下装置B中的橡胶塞,使空气进入,有关反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3
课堂练习
【答案】B
课堂小结
课后小任务
红砖的成分是粘土(主要是硅酸盐),红色来自于三氧化二铁。其中的主要反应是焦炭和水在高温下反应生成一氧化碳和氢气(又叫水煤气),两种气体都有还原性,在高温下将三价铁还原成二价得到氧化亚铁是黑色的——是青砖。出窑前不加水则得到三价铁的氧化物是红棕色的——是红砖。
红砖青砖知多少
感 谢 倾 听
第一节 铁及其化合物
第2课时 铁的重要化合物
人教版必修第一册
榆次一中 李金虎
学习目标
1.了解铁及其重要化合物的重要性质及实验现象。
2.了解Fe(OH)2 、Fe(OH)3的制备方法。
学习目标
1.能用氧化还原反应原理认识铁及其化合物的化学性质,培养学生“实验探究与证据推理”的核心素养。
2.根据物质的分类和实验事实,了解铁的氧化物和氢氧化物的主要性质,培养“宏观辨识与微观探析”的核心素养。
素养目标
情境引入
Fe2O3 可作外墙涂料
Fe3O4 是一种常用的磁性材料?
情境引入
丹霞地貌的岩层因含(Fe2O3)而呈红色
丹霞地貌在我国广泛分布,如:四川的蜀南竹海、七洞沟;贵州赤水;广东丹霞山;江西龙虎山等。
教学过程
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名
矿石
颜色状态 ____色粉末 ____色粉末 ____色晶体
化合价
溶解性 用途
铁红
磁性氧化铁
赤铁矿
磁铁矿
+2
+3
+2,+3
不溶于水
红色油漆和涂料
炼铁原料
黑
红棕
黑
教学过程
2.化学性质
①稳定性
FeO不稳定,在空气中受热:
Fe2O3和 Fe3O4很稳定。
6 FeO + O2 ==== 2 Fe3O4
△
②与非氧化性酸(如稀盐酸、稀硫酸)反应
FeO和Fe2O3属于碱性氧化物,与非氧化性酸反应生成亚铁盐和铁盐
与稀盐酸反应(化学方程式) 与稀盐酸反应(离子方程式)
FeO
Fe2O3
Fe3O4
FeO+2HCl===FeCl2+H2O
FeO + 2H+ === Fe2+ + H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3 + 6H+ === 2Fe3+ + 3H2O
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O
Fe3O4 + 8H+ === Fe2+ + 2Fe3+ + 4H2O
教学过程
二、铁的氢氧化物
1.物理性质
化学式 Fe(OH)2 Fe(OH)3
颜色状态 ____色固体 ____色固体
化合价 +2 +3
溶解性 难溶于水 白
红褐
教学过程
二、铁的氢氧化物
2.化学性质
与稀盐酸反应(化学方程式) 与稀盐酸反应(离子方程式)
Fe(OH)2
Fe(OH)3
①与非氧化性酸(如稀盐酸、稀硫酸)反应
Fe(OH)2+2HCl===FeCl2+H2O
Fe(OH)2+2H+===Fe2++H2O
Fe(OH)3+3HCl===FeCl3+3H2O
Fe(OH)3+3H+===Fe3++3H2O
教学过程
②热稳定性
Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物
Fe(OH)2:__________________________________
Fe(OH)3:__________________________________
Fe(OH)2 === FeO+H2O
△
2Fe(OH)3 === Fe2O3 + 3H2O
△
教学过程
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
Fe(OH)3
Fe(OH)2
实验探究
教学过程
教学过程
现象:_________________,
离子方程式:________________________。
现象:_________________________,
离子方程式:________________________,
________________________________________。
实验室制备氢氧化铁和氢氧化亚铁如图所示:
有红褐色沉淀生成
Fe3++3OH-=Fe(OH)3↓
白色沉淀 灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
教学过程
1.Fe2+极易被氧化,所以FeSO4溶液要现用现配。
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
2.为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
3.为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
4.为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
三、Fe(OH)2制备
教学过程
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过 ,目的是: 。
(2)在FeSO4溶液表面覆盖一层苯,作用是: 。
【例1】氢氧化亚铁制备实验的改进
加热煮沸
赶走溶解的氧气
隔绝空气中的氧气
教学过程
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是 。
(4)在试管Ⅱ里加入的试剂是 。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_____________________________________________________________________。
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
_______________________________________________________________。
稀H2SO4、铁屑
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
教学过程
铁及其化合物 价类二维图
典例1.
“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能是( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖瓦则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
课堂练习
【答案】D
典例2.
铁有+2价和+3价两种价态。下列有关反应中不涉及铁元素价态变化的是( )
A.铁粉溶于稀硫酸
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
课堂练习
【答案】D
典例3.
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时提供的试剂有铁屑及6.00 mol·L-1的硫酸,NaOH溶液,下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭活塞E,使A中溶液压入B中
D.取下装置B中的橡胶塞,使空气进入,有关反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3
课堂练习
【答案】B
课堂小结
课后小任务
红砖的成分是粘土(主要是硅酸盐),红色来自于三氧化二铁。其中的主要反应是焦炭和水在高温下反应生成一氧化碳和氢气(又叫水煤气),两种气体都有还原性,在高温下将三价铁还原成二价得到氧化亚铁是黑色的——是青砖。出窑前不加水则得到三价铁的氧化物是红棕色的——是红砖。
红砖青砖知多少
感 谢 倾 听
