【核心素养目标】人教版(2019)高一化学必修第一册 3.2 金属材料(第3课时 物质的量在化学方程式中的应用)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 3.2 金属材料(第3课时 物质的量在化学方程式中的应用) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览







文档简介
(共20张PPT)
第二节 金属材料
第3课时 物质的量在化学方程式计算中的应用
人教版必修第一册
榆次一中 李金虎
学习目标
掌握物质的量在化学方程式中的计算
学习目标
掌握运用物质的量及相关物理量根据化学方程式进行有关物理量的计算。培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
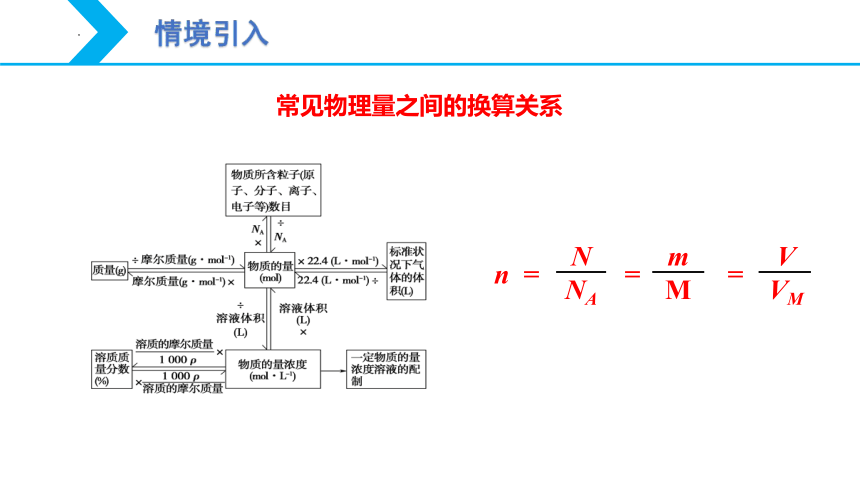
n =
m
M
N
NA
=
=
V
VM
常见物理量之间的换算关系
教学过程
物质是由原子、分子、离子等粒子构成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的。
那么,化学方程式中的计量数表示的是什么量的关系?
一、化学方程式中的定量关系
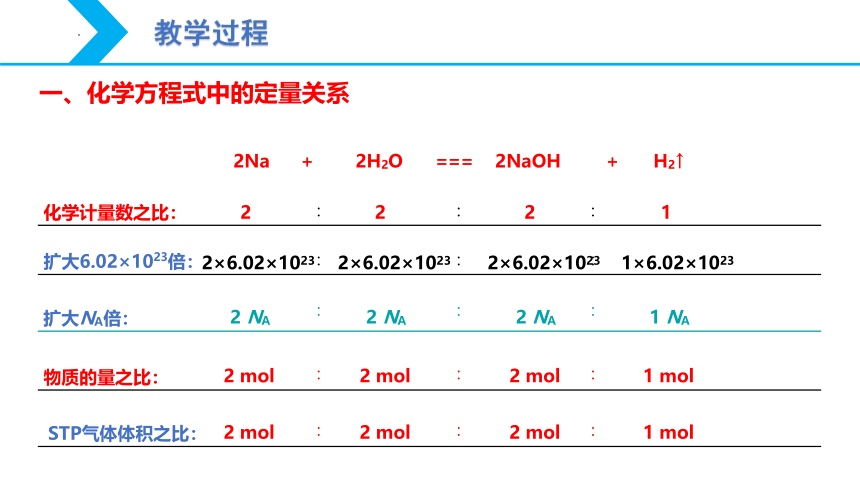
2Na+2H2O = 2NaOH+H2↑
请说出下面方程式的微观意义
教学过程
一、化学方程式中的定量关系
2Na + 2H2O === 2NaOH + H2↑
2
∶
∶
∶
2
2
1
化学计量数之比:
2 mol
物质的量之比:
∶
∶
∶
2 mol
2 mol
1 mol
2 NA
扩大NA倍:
∶
∶
∶
2 NA
2 NA
1 NA
∶
∶
∶
扩大6.02×1023倍:
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
2 mol
STP气体体积之比:
∶
∶
∶
2 mol
2 mol
1 mol
教学过程
1. 化学方程式中各物质的化学计量数之比等于其物质的量之比,等于其粒子数目之比。
2. 对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其体积之比。
结论:
教学过程
二、物质的量在化学方程中的计算步骤
教学过程
(1)书写格式规范化:各物理量、物质的名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:一般来说,在一个题目中如果都用统一的单位,不会出现错误,但如果题目所给的两个量单位不一致,若换算成同一个单位,有时显得很繁琐,这时只要做到两个量的单位“上下一致,左右对应”即可。
(3)各种符号的书写要规范,大写字母与小写字母的含义各不相同。如“M”表示摩尔质量,“m”表示质量,“N”表示微粒数目,而“n”表示物质的量。
注意事项:
教学过程
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
n(Fe)=0.50 mol
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
V(H2)=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L
例1:
教学过程
根据题目,相关物理量可以设 n、m、V 等
也可以统一先求n
教学过程
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe),生成H2的物质的量为n(H2)
Fe + H2SO4 === FeSO4+H2↑
1 1 1
n(Fe) 0.50 mol n(H2)
n(Fe)=0.50 mol,n(H2)=0.50 mol
V(H2)=0.50 mol×22.4L/mol=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2体积在标准状况下为11.2L
例题:
教学过程
例2:向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
(1)参加反应的Al的物质的量。
(2)所得溶液的物质的量浓度(反应前后溶液体积不变)。
(3)生成H2的体积(标准状况)(写出解题步骤)。
教学过程
三、常用计算方法
1.关系式法
关系式法就是根据化学式、化学方程式和溶质质量分数等概念所包含的各种比例关系,找出已知量与未知量之间的比例关系式直接列比例式进行计算的方法。关系式法抓住已知量与未知量之间的内在关系,建立关系式,化繁为简,减少计算误差,是化学计算常用方法之一。
教学过程
例3: 把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
解析 (1)根据化学方程式确定关系:
CO2+Ca(OH)2=CaCO3↓+H2O
则关系式为3CO~3CO2~3CaCO3
即CO~CaCO3
(2)利用关系式进行计算
CO ~ CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
三、常用计算方法
1.关系式法
教学过程
利用化学反应前后某些量之间的等量关系,推理得出正确答案的方法称为守恒法。仔细挖题目中隐含的等量关系是守恒法解题的关键。
①质量守恒法
宏观特征:反应前后质量守恒;
微观特征:反应前后各元素的原子个数守恒。
②电荷守恒法
溶液中阴、阳离子个数不一定相等,但正负电荷总数相等。离子方程式中,反应物所带电荷总数与生成物所带电荷总数相同且电性相同。
③得失电子守恒
氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等
。
2.守恒法
教学过程
例4: 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
解析 钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
本题用了关系式法和守恒法
典例1.
甲、乙两烧杯中各盛有100 mL 3 mol·L-1 的盐酸和氢氧化钠溶液中,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入的铝粉质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
课堂练习
【答案】A
典例2.
将铁加入到100 mL某浓度的盐酸中恰好完全反应,反应后生成的气体为V L(标准状况),将铝加入到100 mL、2 mol·L-1 的NaOH溶液中恰好完全反应,充分反应后生成的气体为3V L。下列说法正确的是( )
A.原铁和铝的物质的量相等
B.原盐酸的浓度为2 mol·L-1
C.铁加入盐酸中的离子方程式为2Fe+6H+= 2Fe3++3H2↑
D.盐酸与氢氧化钠的物质的量浓度之比为1∶3
课堂练习
【答案】B
课堂小结
感 谢 倾 听
第二节 金属材料
第3课时 物质的量在化学方程式计算中的应用
人教版必修第一册
榆次一中 李金虎
学习目标
掌握物质的量在化学方程式中的计算
学习目标
掌握运用物质的量及相关物理量根据化学方程式进行有关物理量的计算。培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
n =
m
M
N
NA
=
=
V
VM
常见物理量之间的换算关系
教学过程
物质是由原子、分子、离子等粒子构成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的。
那么,化学方程式中的计量数表示的是什么量的关系?
一、化学方程式中的定量关系
2Na+2H2O = 2NaOH+H2↑
请说出下面方程式的微观意义
教学过程
一、化学方程式中的定量关系
2Na + 2H2O === 2NaOH + H2↑
2
∶
∶
∶
2
2
1
化学计量数之比:
2 mol
物质的量之比:
∶
∶
∶
2 mol
2 mol
1 mol
2 NA
扩大NA倍:
∶
∶
∶
2 NA
2 NA
1 NA
∶
∶
∶
扩大6.02×1023倍:
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
2 mol
STP气体体积之比:
∶
∶
∶
2 mol
2 mol
1 mol
教学过程
1. 化学方程式中各物质的化学计量数之比等于其物质的量之比,等于其粒子数目之比。
2. 对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其体积之比。
结论:
教学过程
二、物质的量在化学方程中的计算步骤
教学过程
(1)书写格式规范化:各物理量、物质的名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:一般来说,在一个题目中如果都用统一的单位,不会出现错误,但如果题目所给的两个量单位不一致,若换算成同一个单位,有时显得很繁琐,这时只要做到两个量的单位“上下一致,左右对应”即可。
(3)各种符号的书写要规范,大写字母与小写字母的含义各不相同。如“M”表示摩尔质量,“m”表示质量,“N”表示微粒数目,而“n”表示物质的量。
注意事项:
教学过程
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
n(Fe)=0.50 mol
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
V(H2)=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L
例1:
教学过程
根据题目,相关物理量可以设 n、m、V 等
也可以统一先求n
教学过程
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe),生成H2的物质的量为n(H2)
Fe + H2SO4 === FeSO4+H2↑
1 1 1
n(Fe) 0.50 mol n(H2)
n(Fe)=0.50 mol,n(H2)=0.50 mol
V(H2)=0.50 mol×22.4L/mol=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2体积在标准状况下为11.2L
例题:
教学过程
例2:向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
(1)参加反应的Al的物质的量。
(2)所得溶液的物质的量浓度(反应前后溶液体积不变)。
(3)生成H2的体积(标准状况)(写出解题步骤)。
教学过程
三、常用计算方法
1.关系式法
关系式法就是根据化学式、化学方程式和溶质质量分数等概念所包含的各种比例关系,找出已知量与未知量之间的比例关系式直接列比例式进行计算的方法。关系式法抓住已知量与未知量之间的内在关系,建立关系式,化繁为简,减少计算误差,是化学计算常用方法之一。
教学过程
例3: 把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,得10 g沉淀,那么参加反应的CO的质量是 g。
解析 (1)根据化学方程式确定关系:
CO2+Ca(OH)2=CaCO3↓+H2O
则关系式为3CO~3CO2~3CaCO3
即CO~CaCO3
(2)利用关系式进行计算
CO ~ CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
三、常用计算方法
1.关系式法
教学过程
利用化学反应前后某些量之间的等量关系,推理得出正确答案的方法称为守恒法。仔细挖题目中隐含的等量关系是守恒法解题的关键。
①质量守恒法
宏观特征:反应前后质量守恒;
微观特征:反应前后各元素的原子个数守恒。
②电荷守恒法
溶液中阴、阳离子个数不一定相等,但正负电荷总数相等。离子方程式中,反应物所带电荷总数与生成物所带电荷总数相同且电性相同。
③得失电子守恒
氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等
。
2.守恒法
教学过程
例4: 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
解析 钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
本题用了关系式法和守恒法
典例1.
甲、乙两烧杯中各盛有100 mL 3 mol·L-1 的盐酸和氢氧化钠溶液中,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入的铝粉质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
课堂练习
【答案】A
典例2.
将铁加入到100 mL某浓度的盐酸中恰好完全反应,反应后生成的气体为V L(标准状况),将铝加入到100 mL、2 mol·L-1 的NaOH溶液中恰好完全反应,充分反应后生成的气体为3V L。下列说法正确的是( )
A.原铁和铝的物质的量相等
B.原盐酸的浓度为2 mol·L-1
C.铁加入盐酸中的离子方程式为2Fe+6H+= 2Fe3++3H2↑
D.盐酸与氢氧化钠的物质的量浓度之比为1∶3
课堂练习
【答案】B
课堂小结
感 谢 倾 听
