【核心素养目标】人教版(2019)高一化学必修第一册 4.1 原子结构与元素同期表(第1课时 原子结构)(共21张PPT)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 4.1 原子结构与元素同期表(第1课时 原子结构)(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 13:04:53 | ||
图片预览






文档简介
(共21张PPT)
第一节 原子结构与元素周期表
第1课时 原子结构
人教版必修第一册
榆次一中 李金虎
学习目标
1.从微观角度认识原子的构成,了解原子核外电子排布规律。
2.能画出核电荷数为1~20号元素的原子结构示意图,能根据原子的结构特征确定元素。
3.了解质量数的含义。
学习目标
1.通过了解原子的结构及构成原子的粒子间的关系;根据原子核外电子排布规律,能画出1~20号元素的原子结构示意图。培养学生“微观探析与证据推理”的核心素养。
2.了解预测、假设、模型等方法在研究原子结构中的作用,培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
丰富多彩的物质世界是由一百多种元素组成的。那么,这些元素之间有什么内在联系吗?它们是如何相互结合形成多种多样的物质呢?
随着元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,人们从微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念
情境引入
元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。元素周期表的建立成为化学发展史上的重要里程碑之一。20世纪初,原子结构的奥秘被揭示之后, 人们对元素周期表的认识更加完善。那么,原子结构与元素周期表之间有怎样的关系呢?
教学过程
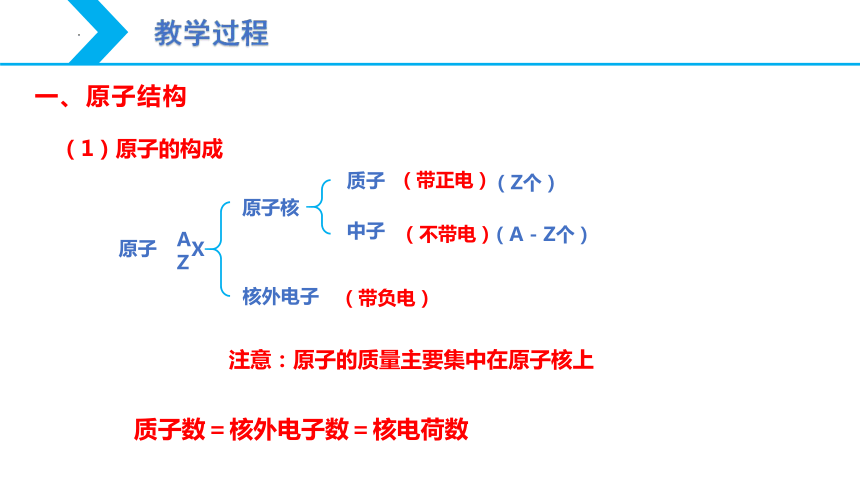
原子核
核外电子
质子
中子
原子
X
A
Z
(Z个)
(带正电)
(A - Z个)
(不带电)
(带负电)
一、原子结构
(1)原子的构成
注意:原子的质量主要集中在原子核上
质子数=核外电子数=核电荷数
教学过程
质量数(A)= 质子数(Z)+ 中子数(N)≈ 相对原子质量
如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
一、原子结构
(2)质量数
(质子和中子的相对质量都近似为1)
教学过程
一、原子结构
(3)符号 中各个字母的含义
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
教学过程
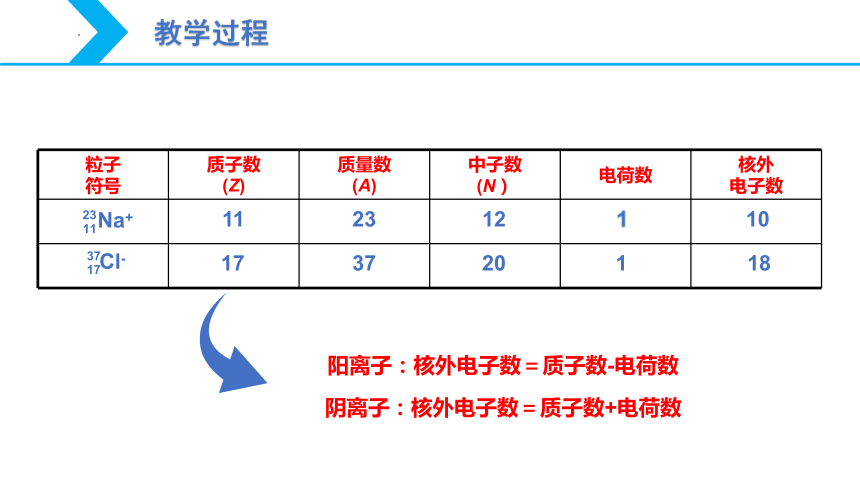
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
17
37
20
11
23
12
1
18
1
10
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
教学过程
二、原子的核外电子排布
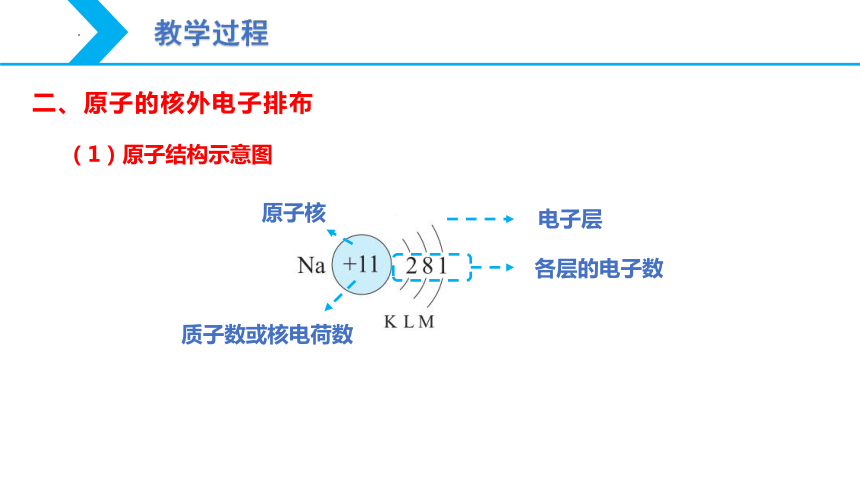
原子核
质子数或核电荷数
电子层
各层的电子数
(1)原子结构示意图
教学过程
二、原子的核外电子排布
(2)电子层的表示方法
电子按照能量高低在核外分层进行运动能量低离核近,能量高离核远
核外电子的运动区域由内到外依次为第一至七层
电子的运动规律:
电子层:
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
离核距离: 近 → 远
电子能量: 低 → 高
教学过程
二、原子的核外电子排布
(3)核外电子排布规律
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
右表是稀有气体元素原子的电子层排布,从中你能发现什么规律?请思考并讨论下列问题。
思考与讨论
教学过程
(1)当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
(2)次外层最多能容纳的电子数是多少?
(3)你能归纳出第n层最多能容纳的电子数吗?
(4)请你根据所归纳的规律,用原子结构示意图表示核电荷数为1 ~ 20号元素原子的核外电子排布。
思考与讨论
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
(1)各电子层最多容纳_______个电子
(2)最外层电子数不超过_____个
(K层为最外层时不超过______个)
(3)次外层电子数不超过_____个
(当K层为次外层时不超过___个)
(4)倒数第三层电子数不超过 个
教学过程
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
2n2
8
2
18
2
32
思考与讨论
课堂练习
(1)电子层数与最外层电子数相等的元素有___________;
(2)最外层电子数是电子层数2倍的元素有___________;
(3)最外层电子数是电子层数3倍的元素有___________;
(4)最外层电子数与次外层电子数相等的元素有________;
(5)最外层电子数是次外层电子数2倍的元素是_________;
(6)最外层电子数是次外层电子数3倍的元素是_________;
(7)次外层电子数是最外层电子数2倍的元素有_________;
(8)内层电子总数是最外层电子数2倍的元素有_________;
C
H、
Be、
Al
He、
S
O
典例1.
Be、
Ar
C
O
Li、
Si
Li、
P
典例2.
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重元素。该元素原子核内中子数与核外电子数之差是( )
A.47 B.57 C.61 D.293
课堂练习
【答案】B
典例3.
不符合原子核外电子排布基本规律的是( )
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
课堂练习
【答案】D
典例4.
有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为( )
A.a-n-3 B.a+n+3
C.a+n-3 D.a-n+3
课堂练习
【答案】B
典例5.
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒具有与氩原子相同的电子数,回答下列问题:
(1)上述四种元素的名称分别是:A________;B_________;C________;D________。
(2)画出A离子、C原子的结构示意图:___________,________。
课堂练习
答案:(1)铝 氯 硫 钾
课堂小结
课后小任务
查阅资料,了解原子结构的演变
感 谢 倾 听
第一节 原子结构与元素周期表
第1课时 原子结构
人教版必修第一册
榆次一中 李金虎
学习目标
1.从微观角度认识原子的构成,了解原子核外电子排布规律。
2.能画出核电荷数为1~20号元素的原子结构示意图,能根据原子的结构特征确定元素。
3.了解质量数的含义。
学习目标
1.通过了解原子的结构及构成原子的粒子间的关系;根据原子核外电子排布规律,能画出1~20号元素的原子结构示意图。培养学生“微观探析与证据推理”的核心素养。
2.了解预测、假设、模型等方法在研究原子结构中的作用,培养学生“证据推理与模型认知”的核心素养。
素养目标
情境引入
丰富多彩的物质世界是由一百多种元素组成的。那么,这些元素之间有什么内在联系吗?它们是如何相互结合形成多种多样的物质呢?
随着元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,人们从微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念
情境引入
元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。元素周期表的建立成为化学发展史上的重要里程碑之一。20世纪初,原子结构的奥秘被揭示之后, 人们对元素周期表的认识更加完善。那么,原子结构与元素周期表之间有怎样的关系呢?
教学过程
原子核
核外电子
质子
中子
原子
X
A
Z
(Z个)
(带正电)
(A - Z个)
(不带电)
(带负电)
一、原子结构
(1)原子的构成
注意:原子的质量主要集中在原子核上
质子数=核外电子数=核电荷数
教学过程
质量数(A)= 质子数(Z)+ 中子数(N)≈ 相对原子质量
如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
一、原子结构
(2)质量数
(质子和中子的相对质量都近似为1)
教学过程
一、原子结构
(3)符号 中各个字母的含义
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
教学过程
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
17
37
20
11
23
12
1
18
1
10
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
教学过程
二、原子的核外电子排布
原子核
质子数或核电荷数
电子层
各层的电子数
(1)原子结构示意图
教学过程
二、原子的核外电子排布
(2)电子层的表示方法
电子按照能量高低在核外分层进行运动能量低离核近,能量高离核远
核外电子的运动区域由内到外依次为第一至七层
电子的运动规律:
电子层:
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
离核距离: 近 → 远
电子能量: 低 → 高
教学过程
二、原子的核外电子排布
(3)核外电子排布规律
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
右表是稀有气体元素原子的电子层排布,从中你能发现什么规律?请思考并讨论下列问题。
思考与讨论
教学过程
(1)当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
(2)次外层最多能容纳的电子数是多少?
(3)你能归纳出第n层最多能容纳的电子数吗?
(4)请你根据所归纳的规律,用原子结构示意图表示核电荷数为1 ~ 20号元素原子的核外电子排布。
思考与讨论
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
(1)各电子层最多容纳_______个电子
(2)最外层电子数不超过_____个
(K层为最外层时不超过______个)
(3)次外层电子数不超过_____个
(当K层为次外层时不超过___个)
(4)倒数第三层电子数不超过 个
教学过程
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
2n2
8
2
18
2
32
思考与讨论
课堂练习
(1)电子层数与最外层电子数相等的元素有___________;
(2)最外层电子数是电子层数2倍的元素有___________;
(3)最外层电子数是电子层数3倍的元素有___________;
(4)最外层电子数与次外层电子数相等的元素有________;
(5)最外层电子数是次外层电子数2倍的元素是_________;
(6)最外层电子数是次外层电子数3倍的元素是_________;
(7)次外层电子数是最外层电子数2倍的元素有_________;
(8)内层电子总数是最外层电子数2倍的元素有_________;
C
H、
Be、
Al
He、
S
O
典例1.
Be、
Ar
C
O
Li、
Si
Li、
P
典例2.
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重元素。该元素原子核内中子数与核外电子数之差是( )
A.47 B.57 C.61 D.293
课堂练习
【答案】B
典例3.
不符合原子核外电子排布基本规律的是( )
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
课堂练习
【答案】D
典例4.
有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为( )
A.a-n-3 B.a+n+3
C.a+n-3 D.a-n+3
课堂练习
【答案】B
典例5.
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒具有与氩原子相同的电子数,回答下列问题:
(1)上述四种元素的名称分别是:A________;B_________;C________;D________。
(2)画出A离子、C原子的结构示意图:___________,________。
课堂练习
答案:(1)铝 氯 硫 钾
课堂小结
课后小任务
查阅资料,了解原子结构的演变
感 谢 倾 听
