【核心素养目标】人教版(2019)高一化学必修第一册 4.3 化学键(第1课时 离子键)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 4.3 化学键(第1课时 离子键) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览






文档简介
(共22张PPT)
第三节 化学键
第1课时 离子键
人教版必修第一册
榆次一中 李金虎
学习目标
1.理解离子键的含义。
2.了解常见的离子化合物
3.能用电子式表示简单离子化合物的形成过程。
4.认识化学键的含义,能从化学键的角度理解化学反应的实质。
学习目标
1.通过离子键的学习,培养学生“宏观辨识与微观探析”学科核心素养。
2.通过电子式的学习,培养学生“证据推理和模型认知”的学科核心素养。
3.了解化学键的概念及化学反应的实质,培养学生“宏观辨识与微观探析”的学科核心素养。
素养目标
情境引入
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?让我们走进微观世界,探索其中的奥秘。
教学过程
思考与讨论:
1mol H2O(l) H2O(g) 吸收 44 KJ热量
1mol H2O(l) H2 +(1/2)O2(g) 吸收 286 KJ热量
100℃
2000℃
1. 为什么水沸腾只需要加热到100℃,而使水分解却需要加热到2000℃以上?
已知:
2. 为什么1mol H2O气化只需要吸收44KJ热量,而1mol H2O分解却需要吸收286 KJ热量?
教学过程
水分解是化学变化,化学反应的本质是分子破裂为原子,原子再重新组合成新的分子,说明水分子中各原子间存在强烈的相互作用力。化学上把这种强烈的作用力称为化学键。
液态水变为气态水是物理变化 ,由于温度升高,水分子间的距离增大,克服了水分子间的作用力。分子间的作用力比较弱。
教学过程
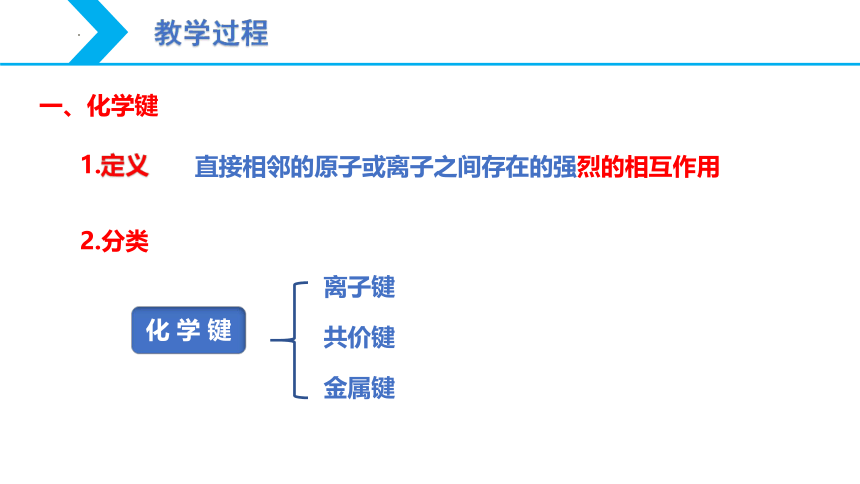
一、化学键
直接相邻的原子或离子之间存在的强烈的相互作用
1.定义
2.分类
化 学 键
离子键
共价键
金属键
教学过程
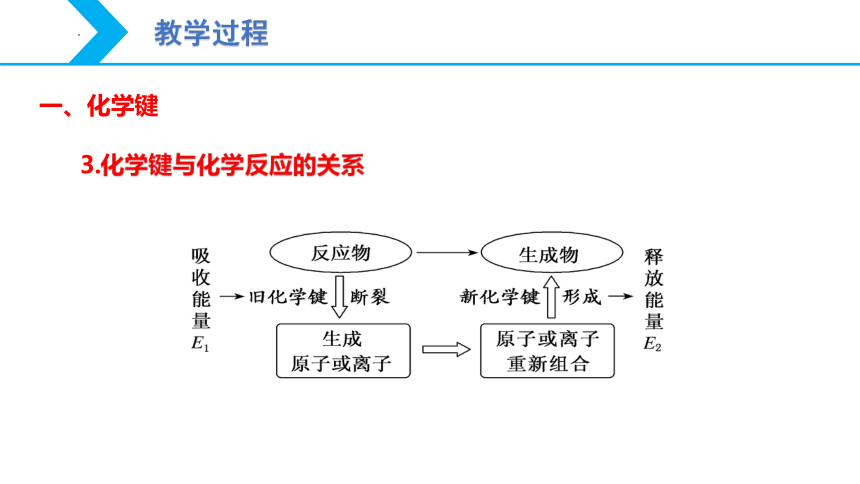
一、化学键
3.化学键与化学反应的关系
教学过程
氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
二、离子键
教学过程
从微观角度理解氯化钠的形成过程
钠原子的最外层有1个电子,氯原子的最外层有7个电子,两者都不稳定;
当钠与氯气反应时,钠原子失去电子,把最外层的1个电子转移到氯原子的最外层上,两者都形成相对稳定的结构;
带相反电荷的Na+ 与Cl- 相互作用,形成了更稳定的NaCl。
教学过程
1. 定义:带相反电荷离子之间的相互作用叫做离子键。
2. 成键微粒:阴离子、阳离子。
3. 成键实质:阴、阳离子之间的静电作用(包括静电引力和静电斥力)。
二、离子键
Na+和Cl-间 相互吸引
Na+
Cl-
电子间、原子核间的相互排斥
平衡
静电引力
静电斥力
4. 成键条件
① 活泼金属(IA,IIA) + 活泼非金属(VIA,VIIA)
② 金属阳离子(含NH4+)+ 酸根阴离子
教学过程
三、离子化合物
1. 定义:由离子键构成的化合物叫做离子化合物。
2. 常见类型
① 强碱,如NaOH、KOH等;
② 活泼金属氧化物,如Na2O、K2O、CaO、MgO等;
③ 绝大多数盐类,如NaCl、NH4Cl、BaSO4等。
3. 特点
①熔、沸点较高,硬度较大;
②通常呈固态,固态不导电,熔融态或溶于水后导电。
AlCl3除外
教学过程
练习1:下列哪些物质中含有离子键?
(1) NaBr (2) HCl (3) MgO (4) CO2
(5) BaCl2 (6) H2O (7) AlCl3 (8) SO3
(9) NH4Cl (10) NaOH (11) Na2O2 (12) NaH
判断关键:含活泼金属元素 或 NH4+
(1)NaBr
(3)MgO
(5)BaCl2
(9)NH4Cl
(10)NaOH
(11)Na2O2 (12)NaH
教学过程
1. 定义
在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
原子 书写 规则 将原子的最外层电子写在元素符号的上、下、左、右四个位置上 示例
四、电子式
2.电子式的书写
教学过程
简单 离子 书写 规则 示例
①简单阳离子是原子失去最外层电子后形成的,其电子式就是阳离子;
②简单阴离子得到电子后最外层一般为8电子结构,在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数
Na+ Mg2+ Al3+
2.电子式的书写
教学过程
2.电子式的书写
离子 化合物 书写 规则 示例
离子化合物的电子式由阴、阳离子的电子式组成,相同的离子不合并,阴阳离子间隔排列
教学过程
(1)反应物是原子的电子式, 生成物是离子化合物的电子式
(2)用“ ”表示电子转移
(3)反应物和生成物之间用“ → ”连接。
3. 用电子式表示离子化合物的形成过程
教学过程
1、 用电子式表示氧化镁的形成过程
2、用电子式表示溴化镁的形成过程
练习2:
典例1.
下列关于离子键的说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠离子与氯离子可以形成离子键
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
课堂练习
【答案】C
典例2.
下列性质中,可以证明某化合物中一定存在离子键的是( )
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态下能导电
课堂练习
【答案】D
典例3.
下列各式为用电子式表示的物质的形成过程,其中正确的是( )
A.
B.
C.
D.
课堂练习
答案:D
课堂小结
感 谢 倾 听
第三节 化学键
第1课时 离子键
人教版必修第一册
榆次一中 李金虎
学习目标
1.理解离子键的含义。
2.了解常见的离子化合物
3.能用电子式表示简单离子化合物的形成过程。
4.认识化学键的含义,能从化学键的角度理解化学反应的实质。
学习目标
1.通过离子键的学习,培养学生“宏观辨识与微观探析”学科核心素养。
2.通过电子式的学习,培养学生“证据推理和模型认知”的学科核心素养。
3.了解化学键的概念及化学反应的实质,培养学生“宏观辨识与微观探析”的学科核心素养。
素养目标
情境引入
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?让我们走进微观世界,探索其中的奥秘。
教学过程
思考与讨论:
1mol H2O(l) H2O(g) 吸收 44 KJ热量
1mol H2O(l) H2 +(1/2)O2(g) 吸收 286 KJ热量
100℃
2000℃
1. 为什么水沸腾只需要加热到100℃,而使水分解却需要加热到2000℃以上?
已知:
2. 为什么1mol H2O气化只需要吸收44KJ热量,而1mol H2O分解却需要吸收286 KJ热量?
教学过程
水分解是化学变化,化学反应的本质是分子破裂为原子,原子再重新组合成新的分子,说明水分子中各原子间存在强烈的相互作用力。化学上把这种强烈的作用力称为化学键。
液态水变为气态水是物理变化 ,由于温度升高,水分子间的距离增大,克服了水分子间的作用力。分子间的作用力比较弱。
教学过程
一、化学键
直接相邻的原子或离子之间存在的强烈的相互作用
1.定义
2.分类
化 学 键
离子键
共价键
金属键
教学过程
一、化学键
3.化学键与化学反应的关系
教学过程
氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
二、离子键
教学过程
从微观角度理解氯化钠的形成过程
钠原子的最外层有1个电子,氯原子的最外层有7个电子,两者都不稳定;
当钠与氯气反应时,钠原子失去电子,把最外层的1个电子转移到氯原子的最外层上,两者都形成相对稳定的结构;
带相反电荷的Na+ 与Cl- 相互作用,形成了更稳定的NaCl。
教学过程
1. 定义:带相反电荷离子之间的相互作用叫做离子键。
2. 成键微粒:阴离子、阳离子。
3. 成键实质:阴、阳离子之间的静电作用(包括静电引力和静电斥力)。
二、离子键
Na+和Cl-间 相互吸引
Na+
Cl-
电子间、原子核间的相互排斥
平衡
静电引力
静电斥力
4. 成键条件
① 活泼金属(IA,IIA) + 活泼非金属(VIA,VIIA)
② 金属阳离子(含NH4+)+ 酸根阴离子
教学过程
三、离子化合物
1. 定义:由离子键构成的化合物叫做离子化合物。
2. 常见类型
① 强碱,如NaOH、KOH等;
② 活泼金属氧化物,如Na2O、K2O、CaO、MgO等;
③ 绝大多数盐类,如NaCl、NH4Cl、BaSO4等。
3. 特点
①熔、沸点较高,硬度较大;
②通常呈固态,固态不导电,熔融态或溶于水后导电。
AlCl3除外
教学过程
练习1:下列哪些物质中含有离子键?
(1) NaBr (2) HCl (3) MgO (4) CO2
(5) BaCl2 (6) H2O (7) AlCl3 (8) SO3
(9) NH4Cl (10) NaOH (11) Na2O2 (12) NaH
判断关键:含活泼金属元素 或 NH4+
(1)NaBr
(3)MgO
(5)BaCl2
(9)NH4Cl
(10)NaOH
(11)Na2O2 (12)NaH
教学过程
1. 定义
在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
原子 书写 规则 将原子的最外层电子写在元素符号的上、下、左、右四个位置上 示例
四、电子式
2.电子式的书写
教学过程
简单 离子 书写 规则 示例
①简单阳离子是原子失去最外层电子后形成的,其电子式就是阳离子;
②简单阴离子得到电子后最外层一般为8电子结构,在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数
Na+ Mg2+ Al3+
2.电子式的书写
教学过程
2.电子式的书写
离子 化合物 书写 规则 示例
离子化合物的电子式由阴、阳离子的电子式组成,相同的离子不合并,阴阳离子间隔排列
教学过程
(1)反应物是原子的电子式, 生成物是离子化合物的电子式
(2)用“ ”表示电子转移
(3)反应物和生成物之间用“ → ”连接。
3. 用电子式表示离子化合物的形成过程
教学过程
1、 用电子式表示氧化镁的形成过程
2、用电子式表示溴化镁的形成过程
练习2:
典例1.
下列关于离子键的说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠离子与氯离子可以形成离子键
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
课堂练习
【答案】C
典例2.
下列性质中,可以证明某化合物中一定存在离子键的是( )
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态下能导电
课堂练习
【答案】D
典例3.
下列各式为用电子式表示的物质的形成过程,其中正确的是( )
A.
B.
C.
D.
课堂练习
答案:D
课堂小结
感 谢 倾 听
