【核心素养目标】人教版(2019)高一化学必修第一册 4.3 化学键(第2课时 共价键)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高一化学必修第一册 4.3 化学键(第2课时 共价键) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:46:47 | ||
图片预览





文档简介
(共24张PPT)
第三节 化学键
第2课时 共价键
人教版必修第一册
榆次一中 李金虎
学习目标
1.理解共价键的含义。
2.了解常见的共价化合物。
3.能用电子式表示简单共价化合物的形成过程。
4.认识化学键的含义,能从化学键的角度理解化学反应的实质。
学习目标
1.通过共价键的学习,培养学生“宏观辨识与微观探析”学科核心素养。
2.通过电子式的学习,培养学生“证据推理和模型认知”的学科核心素养。
3.了解化学键的概念及化学反应的实质,培养学生“宏观辨识与微观探析”的学科核心素养。
素养目标
情境引入
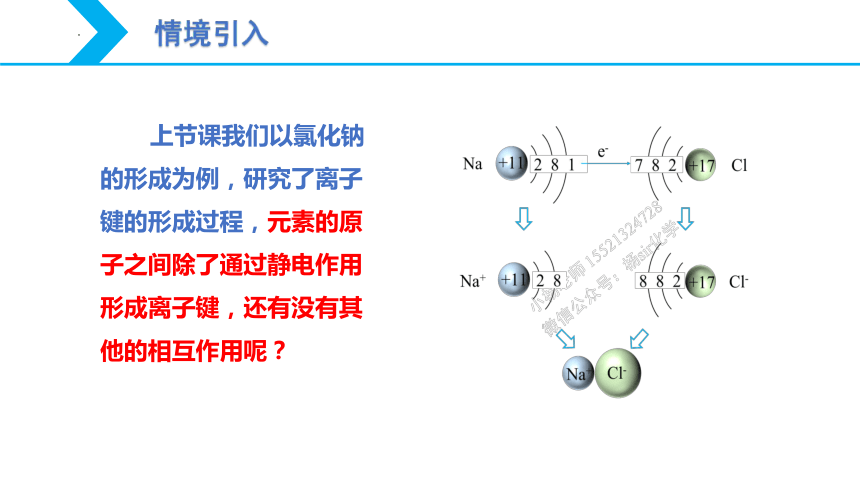
上节课我们以氯化钠的形成为例,研究了离子键的形成过程,元素的原子之间除了通过静电作用形成离子键,还有没有其他的相互作用呢?
教学过程
(1)为什么 2个H原子结合成氢分子,2个Cl原子结合成氯分子,而不是3个、4个呢?
(2)为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比相结合呢?
思考:
教学过程
+17
+17
+17
+17
Cl
Cl
共用电子对
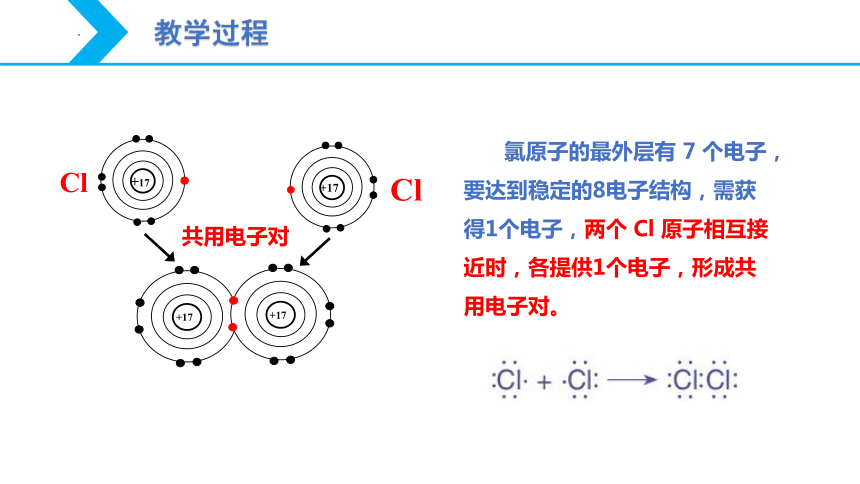
氯原子的最外层有 7 个电子,要达到稳定的8电子结构,需获得1个电子,两个 Cl 原子相互接近时,各提供1个电子,形成共用电子对。
教学过程
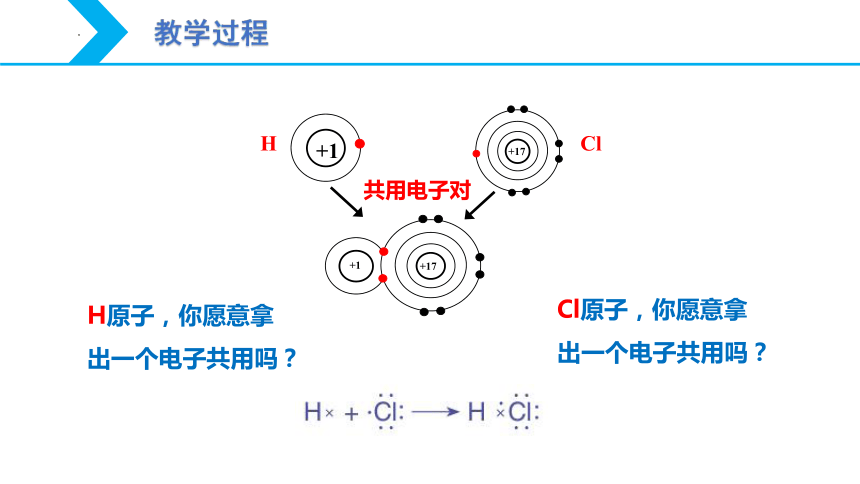
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
+1
H
+17
Cl
共用电子对
+17
+1
教学过程
一、共价键
1. 定义:原子间通过共用电子对所形成的相互作用叫做共价键。
2.成键粒子:非金属元素的原子(稀有气体除外)。
3.成键实质:共用电子对对两个原子的电性作用。
4.成键原因:
通过共用电子对,各原子最外层电子数一般达到“2”或“8”的稳定状态,两原子核都吸引共用电子对,使之处于平衡状态,体系总能量降低。
教学过程
5.存在:
① 非金属单质分子(稀有气体除外),如 H2、O2、Cl2、C60 等;
② 非金属形成的化合物中,如 H2O、CO2、H2SO4、CH4 等;
③ 原子团(根)中,如 OH 、SO42-、NH4+等。
一、共价键
教学过程
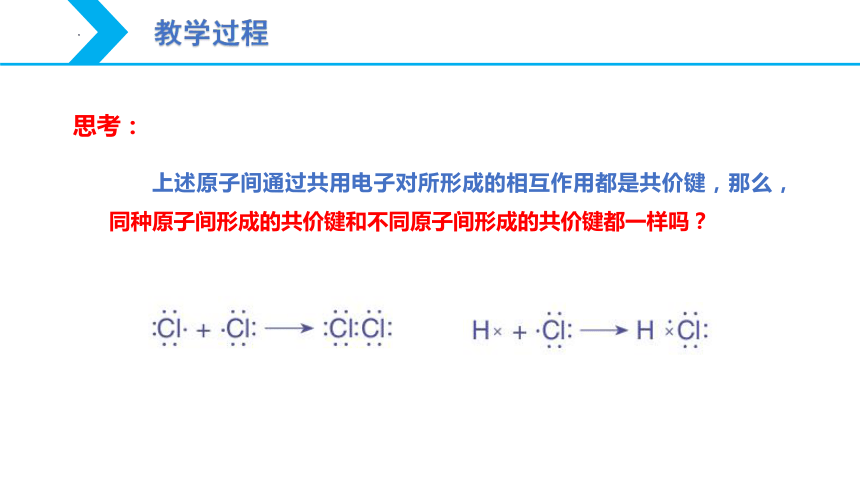
上述原子间通过共用电子对所形成的相互作用都是共价键,那么,同种原子间形成的共价键和不同原子间形成的共价键都一样吗?
思考:
教学过程
分类 非极性键 极性键
定义 共用电子对不发生偏移的共价键, 称为非极性共价键,简称非极性键。 共用电子对发生偏移的共价键,
称为极性共价键,简称极性键。
特征
判断
共用电子对不偏向任何一个原子
两个原子均不显电性
共用电子对偏向吸引电子能力强的原子
成键的原子呈正电性或负电性
由同种非金属元素组成
由不同种非金属元素组成
二、共价键的分类
教学过程
极性键和非极性键判断思维模型
教学过程
二、共价化合物
1.定义: 以共用电子对形成分子的化合物,叫共价化合物
2.常见类型
非金属氢化物:如 等
非金属氧化物:如________________等
酸:如________________等
大多数有机化合物:如___________________等
NH3、H2S、H2O
CO、CO2、SO2
H2SO4、HNO3
CH4、CH3CH2OH
教学过程
以共价键形成的分子及其结构
分子具有一定的空间结构,如CO2 是直线形,H2 O呈V形,CH4 呈正四面体形等。通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
教学过程
三、化学键
1.定义:相邻原子间强烈的相互作用。
2.形成与分类:
化学键
离子键
共价键
极性键
非极性键
(得失电子、阴阳离子、静电作用)
(不同原子、共用电子对偏移)
(相同原子、共用电子对不偏移)
教学过程
化学反应的本质是旧化学键的断裂和新化学键的形成过程。
3.化学反应的本质:
有化学键断裂或形成的变化不一定是化学变化。
如NaCl溶于水、结晶析出,均未发生化学变化。
思考:有化学键的断裂、或者有化学键的形成的过程,一定发生了化学变化吗?
教学过程
四、分子间作用力
(1) 定义:把分子聚集在一起的作用力,叫分子间作用力,又称范德华力。
(2) 特点:分子间作用力比化学键弱得多,主要影响物质的熔点、沸点等物理性质。
(3)影响:
一般来说,对于组成和结构相似的物质,相对分子质量越大,范德华力越大,克服范德华力所需消耗的能量越大,物质的熔、沸点就越高。
1.范德华力
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
第VIIA族单质的熔、沸点
与相对分子质量的关系
分子间的作用力强弱(范德华力)
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
×
×
×
×
×
×
CF4
CCl4
CBr4
CF4
CBr4
CI4
沸点
熔点
卤化物的熔沸点与
相对分子质量的关系
CCl4
×
教学过程
教学过程
2. 氢键
(1)概念:分子间存在的一种比范德华力强的分子间作用力。
(2)形成条件:通常是 N、O、F 与 H 形成。
(3)影响:
①氢键会使物质的熔点和沸点升高。
②水结成冰,体积增大,跟氢键有关。
③DNA的结构和生理活性都与氢键的作用有关。
一些氢化物的沸点
典例1.
下列说法正确的是( )
A.只含有共价键的物质属于共价化合物
B.所有物质中均含有化学键
C.含有离子键的物质肯定含金属元素
D.只要含离子键的化合物就属于离子化合物
课堂练习
【答案】D
典例2.
下列关于离子键、共价键的叙述中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
课堂练习
【答案】C
典例3.
反应8NH3+3Cl2=6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子:79N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
课堂练习
答案:C
典例4.
课堂练习
在下列物质中:
A.氩 B.NaOH C.甲烷 D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2
(1)只含离子键的物质是_____(填字母,下同);
(2)既有离子键又有共价键的物质是_____;
(3)只含极性键的物质是________;
(4)含非极性键的物质是_____。
D
B
CFG
EH
课堂小结
感 谢 倾 听
第三节 化学键
第2课时 共价键
人教版必修第一册
榆次一中 李金虎
学习目标
1.理解共价键的含义。
2.了解常见的共价化合物。
3.能用电子式表示简单共价化合物的形成过程。
4.认识化学键的含义,能从化学键的角度理解化学反应的实质。
学习目标
1.通过共价键的学习,培养学生“宏观辨识与微观探析”学科核心素养。
2.通过电子式的学习,培养学生“证据推理和模型认知”的学科核心素养。
3.了解化学键的概念及化学反应的实质,培养学生“宏观辨识与微观探析”的学科核心素养。
素养目标
情境引入
上节课我们以氯化钠的形成为例,研究了离子键的形成过程,元素的原子之间除了通过静电作用形成离子键,还有没有其他的相互作用呢?
教学过程
(1)为什么 2个H原子结合成氢分子,2个Cl原子结合成氯分子,而不是3个、4个呢?
(2)为什么1个H原子和1个Cl原子结合成HCl分子,而不是以其他的个数比相结合呢?
思考:
教学过程
+17
+17
+17
+17
Cl
Cl
共用电子对
氯原子的最外层有 7 个电子,要达到稳定的8电子结构,需获得1个电子,两个 Cl 原子相互接近时,各提供1个电子,形成共用电子对。
教学过程
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
+1
H
+17
Cl
共用电子对
+17
+1
教学过程
一、共价键
1. 定义:原子间通过共用电子对所形成的相互作用叫做共价键。
2.成键粒子:非金属元素的原子(稀有气体除外)。
3.成键实质:共用电子对对两个原子的电性作用。
4.成键原因:
通过共用电子对,各原子最外层电子数一般达到“2”或“8”的稳定状态,两原子核都吸引共用电子对,使之处于平衡状态,体系总能量降低。
教学过程
5.存在:
① 非金属单质分子(稀有气体除外),如 H2、O2、Cl2、C60 等;
② 非金属形成的化合物中,如 H2O、CO2、H2SO4、CH4 等;
③ 原子团(根)中,如 OH 、SO42-、NH4+等。
一、共价键
教学过程
上述原子间通过共用电子对所形成的相互作用都是共价键,那么,同种原子间形成的共价键和不同原子间形成的共价键都一样吗?
思考:
教学过程
分类 非极性键 极性键
定义 共用电子对不发生偏移的共价键, 称为非极性共价键,简称非极性键。 共用电子对发生偏移的共价键,
称为极性共价键,简称极性键。
特征
判断
共用电子对不偏向任何一个原子
两个原子均不显电性
共用电子对偏向吸引电子能力强的原子
成键的原子呈正电性或负电性
由同种非金属元素组成
由不同种非金属元素组成
二、共价键的分类
教学过程
极性键和非极性键判断思维模型
教学过程
二、共价化合物
1.定义: 以共用电子对形成分子的化合物,叫共价化合物
2.常见类型
非金属氢化物:如 等
非金属氧化物:如________________等
酸:如________________等
大多数有机化合物:如___________________等
NH3、H2S、H2O
CO、CO2、SO2
H2SO4、HNO3
CH4、CH3CH2OH
教学过程
以共价键形成的分子及其结构
分子具有一定的空间结构,如CO2 是直线形,H2 O呈V形,CH4 呈正四面体形等。通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
教学过程
三、化学键
1.定义:相邻原子间强烈的相互作用。
2.形成与分类:
化学键
离子键
共价键
极性键
非极性键
(得失电子、阴阳离子、静电作用)
(不同原子、共用电子对偏移)
(相同原子、共用电子对不偏移)
教学过程
化学反应的本质是旧化学键的断裂和新化学键的形成过程。
3.化学反应的本质:
有化学键断裂或形成的变化不一定是化学变化。
如NaCl溶于水、结晶析出,均未发生化学变化。
思考:有化学键的断裂、或者有化学键的形成的过程,一定发生了化学变化吗?
教学过程
四、分子间作用力
(1) 定义:把分子聚集在一起的作用力,叫分子间作用力,又称范德华力。
(2) 特点:分子间作用力比化学键弱得多,主要影响物质的熔点、沸点等物理性质。
(3)影响:
一般来说,对于组成和结构相似的物质,相对分子质量越大,范德华力越大,克服范德华力所需消耗的能量越大,物质的熔、沸点就越高。
1.范德华力
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
第VIIA族单质的熔、沸点
与相对分子质量的关系
分子间的作用力强弱(范德华力)
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
×
×
×
×
×
×
CF4
CCl4
CBr4
CF4
CBr4
CI4
沸点
熔点
卤化物的熔沸点与
相对分子质量的关系
CCl4
×
教学过程
教学过程
2. 氢键
(1)概念:分子间存在的一种比范德华力强的分子间作用力。
(2)形成条件:通常是 N、O、F 与 H 形成。
(3)影响:
①氢键会使物质的熔点和沸点升高。
②水结成冰,体积增大,跟氢键有关。
③DNA的结构和生理活性都与氢键的作用有关。
一些氢化物的沸点
典例1.
下列说法正确的是( )
A.只含有共价键的物质属于共价化合物
B.所有物质中均含有化学键
C.含有离子键的物质肯定含金属元素
D.只要含离子键的化合物就属于离子化合物
课堂练习
【答案】D
典例2.
下列关于离子键、共价键的叙述中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
课堂练习
【答案】C
典例3.
反应8NH3+3Cl2=6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子:79N
B.N2分子的电子式:N N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
课堂练习
答案:C
典例4.
课堂练习
在下列物质中:
A.氩 B.NaOH C.甲烷 D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2
(1)只含离子键的物质是_____(填字母,下同);
(2)既有离子键又有共价键的物质是_____;
(3)只含极性键的物质是________;
(4)含非极性键的物质是_____。
D
B
CFG
EH
课堂小结
感 谢 倾 听
