【核心素养目标】人教版(2019)高中化学 选择性必修1 3.3 盐类的水解(第2课时 影响盐类水解的因素)(共20张PPT)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.3 盐类的水解(第2课时 影响盐类水解的因素)(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 31.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 13:08:13 | ||
图片预览




文档简介
(共20张PPT)
第三节 盐类的水解
第2课时 影响盐类水解的因素
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,认识影响盐类水解的主要因素。
2.了解水解平衡常数,认识水解常数与电离常数的关系。
学习目标
1.运用化学平衡原理分析外界条件对盐类水解的影响,建立物质的变化需要一定条件,并遵循一定规律的观念。培养学生“变化观念与平衡思想”的学科素养。
2.根据影响盐类水解平衡的外界因素,设计简单的实验方案进行探究,完成实验操作,观察现象,对实验现象作出解释。培养学生“科学探究与创新意识” 的学科素养。
素养目标
情境引入
我们上节课知道了纯碱的水溶液显碱性的原因,纯碱可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
教学过程
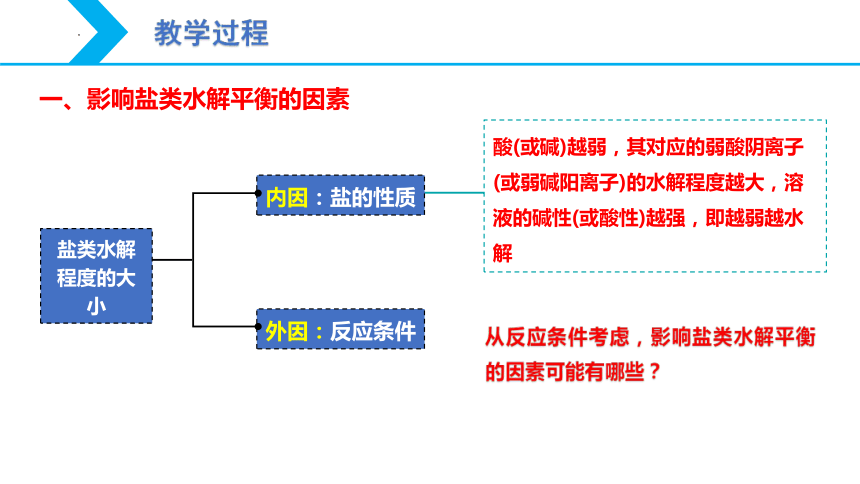
一、影响盐类水解平衡的因素
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
外因:反应条件
内因:盐的性质
盐类水解程度的大小
从反应条件考虑,影响盐类水解平衡的因素可能有哪些?
教学过程
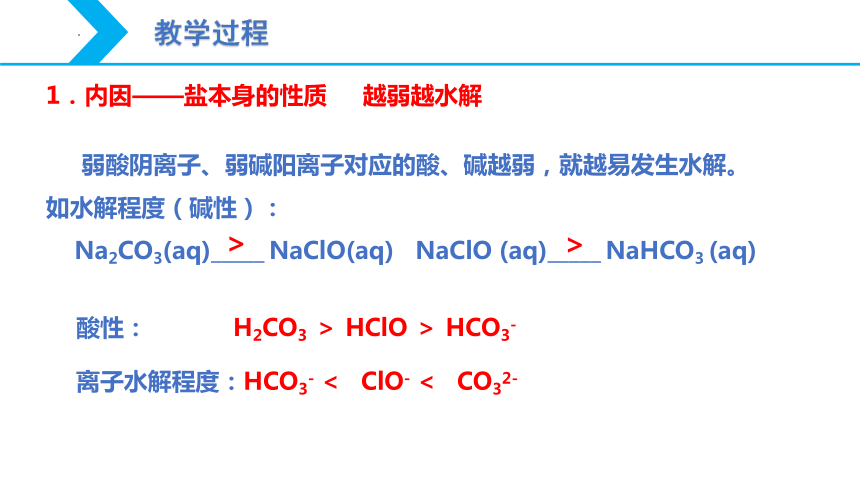
弱酸阴离子、弱碱阳离子对应的酸、碱越弱,就越易发生水解。
如水解程度(碱性):
Na2CO3(aq)_____ NaClO(aq) NaClO (aq)_____ NaHCO3 (aq)
酸性: H2CO3 > HClO > HCO3-
离子水解程度:HCO3- < ClO- < CO32-
>
>
1.内因——盐本身的性质 越弱越水解
教学过程
实验探究条件对水解平衡的影响
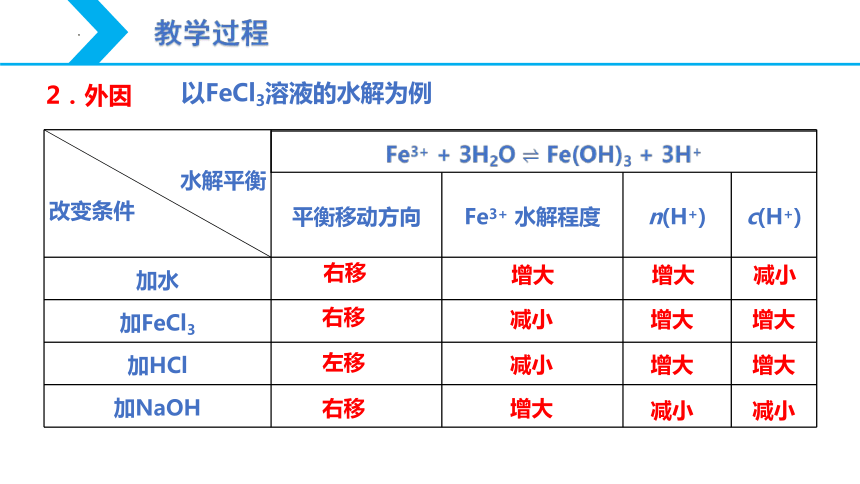
2.外因
以FeCl3溶液的水解为例
教学过程
2.外因
以FeCl3溶液的水解为例
水解平衡 改变条件 Fe3+ + 3H2O Fe(OH)3 + 3H+ 平衡移动方向 Fe3+ 水解程度 n(H+) c(H+)
加水
加FeCl3
加HCl
加NaOH
右移
增大
增大
减小
右移
减小
增大
增大
左移
减小
增大
增大
右移
增大
减小
减小
教学过程
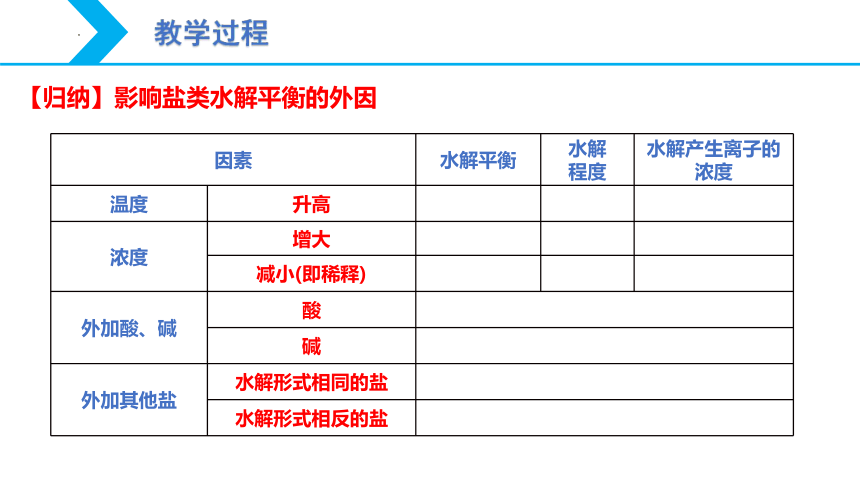
因素 水解平衡 水解 程度 水解产生离子的浓度
温度 升高
浓度 增大
减小(即稀释)
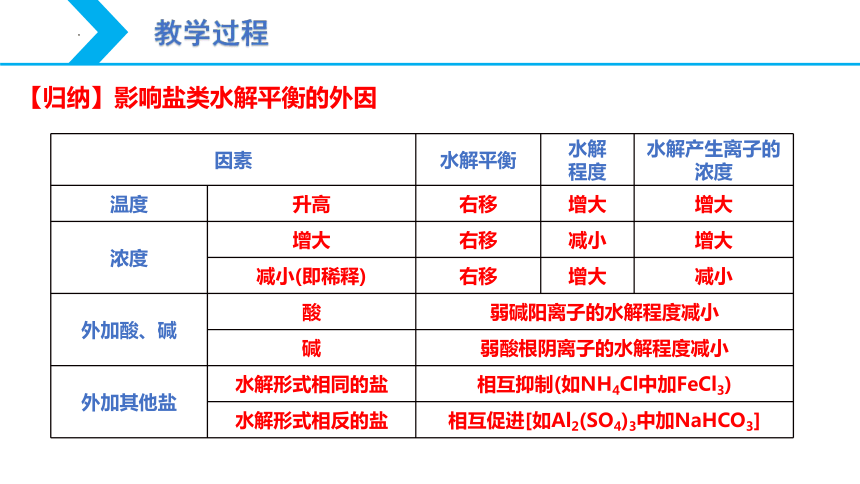
外加酸、碱 酸 碱 外加其他盐 水解形式相同的盐 水解形式相反的盐 【归纳】影响盐类水解平衡的外因
教学过程
因素 水解平衡 水解 程度 水解产生离子的浓度
温度 升高 右移 增大 增大
浓度 增大 右移 减小 增大
减小(即稀释) 右移 增大 减小
外加酸、碱 酸 弱碱阳离子的水解程度减小 碱 弱酸根阴离子的水解程度减小 外加其他盐 水解形式相同的盐 相互抑制(如NH4Cl中加FeCl3) 水解形式相反的盐 相互促进[如Al2(SO4)3中加NaHCO3] 【归纳】影响盐类水解平衡的外因
教学过程
平衡移动 c(H+) c(NH4+)
升高温度
加水稀释
通入少量HCl
加入少量NaOH固体
加入固体NH4Cl
以NH4++H2O NH3·H2O+H+为例
典例:
教学过程
平衡移动 c(H+) c(NH4+)
升高温度 右移 增大 减小
加水稀释 右移 减小 减小
通入少量HCl 左移 增大 增大
加入少量NaOH固体 右移 减小 减小
加入固体NH4Cl 右移 增大 增大
以NH4++H2O NH3·H2O+H+为例
典例:
教学过程
二、水解平衡常数
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度幂之积与溶液中未水解的弱酸根阴离子(或弱碱阳离子)浓度之比是一个常数,该常数叫作水解常数。
用Kh表示。
1.概念
教学过程
2. 表达式:对于水解反应:A- + H2O HA + OH-
Kh =
二、水解平衡常数
3. 意义:
Kh表示水解反应趋势的大小,Kh数值越大,水解趋势越大。
4. 影响因素:
对于确定的离子,其水解常数只受温度影响。温度越高,水解常数越大。
教学过程
5. 水解常数与电离常数的关系
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH)·c(OH-)
c(CH3COO-)
当水解达到平衡时,溶液中还存在以下关系:
Ka=
c(CH3COO-)·c(H+)
c(CH3COOH)
将以上关系代入Kh的表达式,得到如下关系:
c(H+)·c(OH-)
Ka
=
Kw
Ka
Kh=
Kw
Ka
Kh=
强碱
弱酸盐
Kw
Kb
Kh=
强酸
弱碱盐
弱酸或弱碱的电离常数越小,其生成的盐水解程度就越大
根据醋酸钠水解反应的离子方程式, 写出水解平衡的平衡常数表达式
教学过程
思考:25 ℃时,CH3COOH的电离常数 Ka=1.75×10-5,HClO的电离常数Ka=2.98×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
Kw
Ka
Kh=
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
ClO- + H2O HClO + OH-
Kw
Ka
Kh1=
=
10-14
1.75×10-5
Kw
Ka
Kh2=
=
10-14
2.98×10-8
≈
5.7×10-10
≈
3.4×10-7
Kh2> Kh1
同浓度的醋酸钠和次氯酸钠溶液中,次氯酸钠溶液的碱性更强。
典例1.
课堂练习
下图表示的是某离子X与水的反应过程,离子X可能是( )
A.CO32- B.HCO3- C.Na+ D.NH4+
答案 D
解析 离子X的水解反应生成H+,由图可知X只能是NH4+ 。
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
典例2.
课堂练习
答案 B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐的溶液的pH可推知,碱性越强则对应的酸越弱。
下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
典例3.
课堂练习
答案 C
解析 增大FeCl3的浓度,水解平衡向右移动,但Fe3+水解程度减小,加水稀释,水解平衡向右移动,Fe3+水解程度增大,A、B项均正确;盐类水解是吸热过程,温度升高,水解程度增大,C项错误;Fe3+水解后溶液呈酸性,增大H+的浓度可抑制Fe3+的水解,D项正确。
课堂小结
感 谢 倾 听
第三节 盐类的水解
第2课时 影响盐类水解的因素
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,认识影响盐类水解的主要因素。
2.了解水解平衡常数,认识水解常数与电离常数的关系。
学习目标
1.运用化学平衡原理分析外界条件对盐类水解的影响,建立物质的变化需要一定条件,并遵循一定规律的观念。培养学生“变化观念与平衡思想”的学科素养。
2.根据影响盐类水解平衡的外界因素,设计简单的实验方案进行探究,完成实验操作,观察现象,对实验现象作出解释。培养学生“科学探究与创新意识” 的学科素养。
素养目标
情境引入
我们上节课知道了纯碱的水溶液显碱性的原因,纯碱可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
教学过程
一、影响盐类水解平衡的因素
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
外因:反应条件
内因:盐的性质
盐类水解程度的大小
从反应条件考虑,影响盐类水解平衡的因素可能有哪些?
教学过程
弱酸阴离子、弱碱阳离子对应的酸、碱越弱,就越易发生水解。
如水解程度(碱性):
Na2CO3(aq)_____ NaClO(aq) NaClO (aq)_____ NaHCO3 (aq)
酸性: H2CO3 > HClO > HCO3-
离子水解程度:HCO3- < ClO- < CO32-
>
>
1.内因——盐本身的性质 越弱越水解
教学过程
实验探究条件对水解平衡的影响
2.外因
以FeCl3溶液的水解为例
教学过程
2.外因
以FeCl3溶液的水解为例
水解平衡 改变条件 Fe3+ + 3H2O Fe(OH)3 + 3H+ 平衡移动方向 Fe3+ 水解程度 n(H+) c(H+)
加水
加FeCl3
加HCl
加NaOH
右移
增大
增大
减小
右移
减小
增大
增大
左移
减小
增大
增大
右移
增大
减小
减小
教学过程
因素 水解平衡 水解 程度 水解产生离子的浓度
温度 升高
浓度 增大
减小(即稀释)
外加酸、碱 酸 碱 外加其他盐 水解形式相同的盐 水解形式相反的盐 【归纳】影响盐类水解平衡的外因
教学过程
因素 水解平衡 水解 程度 水解产生离子的浓度
温度 升高 右移 增大 增大
浓度 增大 右移 减小 增大
减小(即稀释) 右移 增大 减小
外加酸、碱 酸 弱碱阳离子的水解程度减小 碱 弱酸根阴离子的水解程度减小 外加其他盐 水解形式相同的盐 相互抑制(如NH4Cl中加FeCl3) 水解形式相反的盐 相互促进[如Al2(SO4)3中加NaHCO3] 【归纳】影响盐类水解平衡的外因
教学过程
平衡移动 c(H+) c(NH4+)
升高温度
加水稀释
通入少量HCl
加入少量NaOH固体
加入固体NH4Cl
以NH4++H2O NH3·H2O+H+为例
典例:
教学过程
平衡移动 c(H+) c(NH4+)
升高温度 右移 增大 减小
加水稀释 右移 减小 减小
通入少量HCl 左移 增大 增大
加入少量NaOH固体 右移 减小 减小
加入固体NH4Cl 右移 增大 增大
以NH4++H2O NH3·H2O+H+为例
典例:
教学过程
二、水解平衡常数
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度幂之积与溶液中未水解的弱酸根阴离子(或弱碱阳离子)浓度之比是一个常数,该常数叫作水解常数。
用Kh表示。
1.概念
教学过程
2. 表达式:对于水解反应:A- + H2O HA + OH-
Kh =
二、水解平衡常数
3. 意义:
Kh表示水解反应趋势的大小,Kh数值越大,水解趋势越大。
4. 影响因素:
对于确定的离子,其水解常数只受温度影响。温度越高,水解常数越大。
教学过程
5. 水解常数与电离常数的关系
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH)·c(OH-)
c(CH3COO-)
当水解达到平衡时,溶液中还存在以下关系:
Ka=
c(CH3COO-)·c(H+)
c(CH3COOH)
将以上关系代入Kh的表达式,得到如下关系:
c(H+)·c(OH-)
Ka
=
Kw
Ka
Kh=
Kw
Ka
Kh=
强碱
弱酸盐
Kw
Kb
Kh=
强酸
弱碱盐
弱酸或弱碱的电离常数越小,其生成的盐水解程度就越大
根据醋酸钠水解反应的离子方程式, 写出水解平衡的平衡常数表达式
教学过程
思考:25 ℃时,CH3COOH的电离常数 Ka=1.75×10-5,HClO的电离常数Ka=2.98×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
Kw
Ka
Kh=
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
ClO- + H2O HClO + OH-
Kw
Ka
Kh1=
=
10-14
1.75×10-5
Kw
Ka
Kh2=
=
10-14
2.98×10-8
≈
5.7×10-10
≈
3.4×10-7
Kh2> Kh1
同浓度的醋酸钠和次氯酸钠溶液中,次氯酸钠溶液的碱性更强。
典例1.
课堂练习
下图表示的是某离子X与水的反应过程,离子X可能是( )
A.CO32- B.HCO3- C.Na+ D.NH4+
答案 D
解析 离子X的水解反应生成H+,由图可知X只能是NH4+ 。
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
典例2.
课堂练习
答案 B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐的溶液的pH可推知,碱性越强则对应的酸越弱。
下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
典例3.
课堂练习
答案 C
解析 增大FeCl3的浓度,水解平衡向右移动,但Fe3+水解程度减小,加水稀释,水解平衡向右移动,Fe3+水解程度增大,A、B项均正确;盐类水解是吸热过程,温度升高,水解程度增大,C项错误;Fe3+水解后溶液呈酸性,增大H+的浓度可抑制Fe3+的水解,D项正确。
课堂小结
感 谢 倾 听
