【核心素养目标】人教版(2019)高中化学 选择性必修1 3.4 沉淀溶解平衡(第2课时 沉淀溶解平衡的应用(1)沉淀生成、溶解)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.4 沉淀溶解平衡(第2课时 沉淀溶解平衡的应用(1)沉淀生成、溶解) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:47:27 | ||
图片预览





文档简介
(共18张PPT)
第四节 沉淀溶解平衡
第2课时 沉淀溶解平衡的应用1(沉淀生成、溶解)
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,了解沉淀的生成、溶解。
2.能够根据化学平衡原理分析沉淀的生成、溶解。
3.能举例说明沉淀溶解平衡在生产、生活中的应用。能运用沉淀溶解平衡原理,分析和解决生产、生活中有关的实际问题。
学习目标
1.能设计简单的实验方案验证沉淀的生成、溶解,完成实验操作,观察现象,对实验现象作出解释,发现和提出需要进一步研究的问题。培养学生“科学探究与创新意识”的学科素养。
2.通过沉淀的生成、溶解在生产、生活和科学研究中的应用,认识化学对人类做出的重大贡献。培养学生“科学态度与社会责任”的学科素养。
素养目标
情境引入
锅炉内结垢浪费燃料,而且会使锅炉内管道局部过热,严重时还可能引起爆炸。我们用什么方法除水垢呢?
教学过程
难溶电解质的沉淀溶解平衡是动态平衡,我们可以通过改变条件,使平衡向着需要的方向移动——溶液中的离子转化为沉淀,或沉淀转化为溶液中的离子。因此,沉淀溶解平衡在生产、科研和环保等领域具有广泛的应用。
教学过程
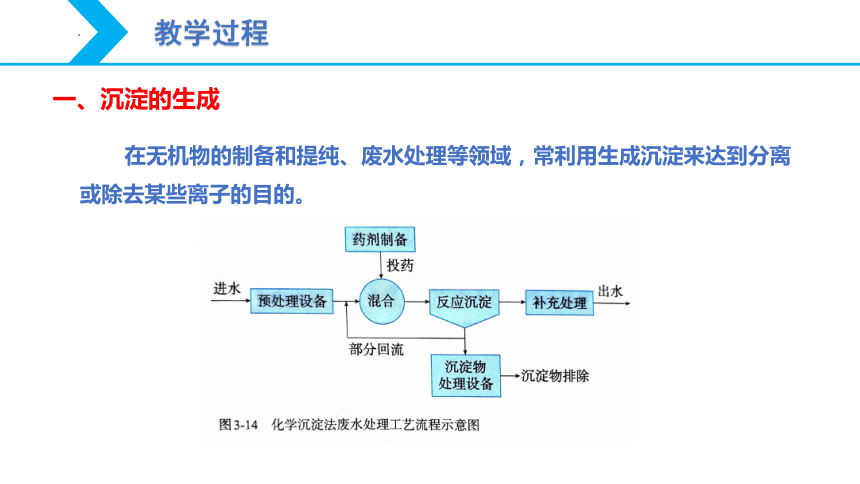
一、沉淀的生成
在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
教学过程
一、沉淀的生成
1.沉淀生成时沉淀剂的选择原则
(1)使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。
(2)不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。
2.常用的沉淀方法
(1)调节pH法
通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。如用CuO调节CuCl2溶液(含Fe3+)的酸碱性以除去Fe3+。
教学过程
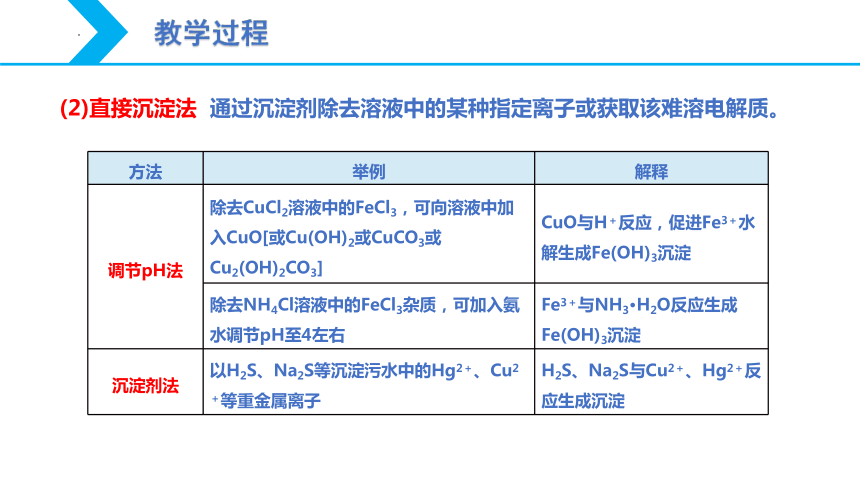
(2)直接沉淀法 通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。
方法 举例 解释
调节pH法 除去CuCl2溶液中的FeCl3,可向溶液中加入CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3] CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右 Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
沉淀剂法 以H2S、Na2S等沉淀污水中的Hg2+、Cu2+等重金属离子 H2S、Na2S与Cu2+、Hg2+反应生成沉淀
教学过程
二、沉淀的溶解
查阅资料可知:锅炉内水垢主要成分有Mg(OH)2、CaCO3、CaSO4 等。
请运用沉淀溶解平衡的原理解释去除水垢的原因
教学过程
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
CaCO3(s) Ca2+ (aq) + CO32-(aq)
沉淀
溶解
对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
教学过程
思考:运用沉淀溶解平衡解释稀盐酸除碳酸钙的原理
CaCO3(s) Ca2+ (aq) + CO32-(aq)
+ H+
HCO3- (aq)
解释:CO2气体的生成和逸出,使CO32-的浓度不断减小,使Q < Ksp,平衡向沉淀溶解的方向移动。只要盐酸足够,沉淀完全溶解。
+ H+
H2CO3
H2O + CO2↑
教学过程
实验探究
向两支盛有少量Mg(OH)2固体的试管中分别滴加适量的蒸馏水和盐酸,观察并记录现象
实验步骤
添加的试剂 蒸馏水 盐酸
现象
沉淀不溶解
沉淀溶解
实验结论:加水,对Mg(OH)2的沉淀溶解平衡影响不明显,加盐酸,沉淀溶解
教学过程
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
H2O
+ H+
解释:对于Mg(OH)2的沉淀溶解平衡,H+与OH-反应,使c(OH-)减小,使Q<Ksp,平衡向沉淀溶解的方向移动,只要盐酸足够,沉淀完全溶解。
分析:
教学过程
沉淀溶解方法总结:
① 酸溶法:如CaCO3溶于盐酸,Al(OH)3、Cu(OH)2溶于强酸等。
② 盐溶法:如Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ === Mg2+ + 2NH3·H2O
③ 氧化还原法:如CuS、HgS等可溶于HNO3中
3CuS + 8HNO3 === 3Cu(NO3)2 + 3S + 2NO↑+ 4H2O
④ 配合物法:如 AgCl可溶于NH3·H2O
AgCl+2NH3·H2O === [Ag(NH3)2]++Cl-+2H2O
已知常温下CaCO3的Ksp=3.4×10-9,CaSO4的Ksp=4.9×10-5,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,下列说法正确的是( )
A.只产生CaCO3沉淀
B.产生等量的CaCO3和CaSO4沉淀
C.产生的CaSO4沉淀更多
D.产生的CaCO3沉淀更多
典例1.
课堂练习
【答案】C
【解析】二者都是AB型钙盐,其溶度积常数越大溶解度越大,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,溶度积常数大的物质生成的沉淀越多,根据题干信息知,溶度积常数:CaCO3AgCl和Ag2CrO4的溶度积分别为1.8×10-10和2.0×10-12,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是( )
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D.都是难溶盐,溶解度无意义
典例2.
课堂练习
【答案】C
【解析】AgCl和Ag2CrO4的阴、阳离子配比类型不同,不能直接利用Ksp来比较二者溶解能力的大小,所以只有C项正确;其余三项叙述均错误。若用溶度积比较溶解度大小,必须是同类型的难溶电解质,否则不能直接比较。
课后小任务
思考:龋齿俗称蛀牙,是口腔的常见病之一。那么,龋齿是怎样发生的呢?
课堂小结
感 谢 倾 听
第四节 沉淀溶解平衡
第2课时 沉淀溶解平衡的应用1(沉淀生成、溶解)
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,了解沉淀的生成、溶解。
2.能够根据化学平衡原理分析沉淀的生成、溶解。
3.能举例说明沉淀溶解平衡在生产、生活中的应用。能运用沉淀溶解平衡原理,分析和解决生产、生活中有关的实际问题。
学习目标
1.能设计简单的实验方案验证沉淀的生成、溶解,完成实验操作,观察现象,对实验现象作出解释,发现和提出需要进一步研究的问题。培养学生“科学探究与创新意识”的学科素养。
2.通过沉淀的生成、溶解在生产、生活和科学研究中的应用,认识化学对人类做出的重大贡献。培养学生“科学态度与社会责任”的学科素养。
素养目标
情境引入
锅炉内结垢浪费燃料,而且会使锅炉内管道局部过热,严重时还可能引起爆炸。我们用什么方法除水垢呢?
教学过程
难溶电解质的沉淀溶解平衡是动态平衡,我们可以通过改变条件,使平衡向着需要的方向移动——溶液中的离子转化为沉淀,或沉淀转化为溶液中的离子。因此,沉淀溶解平衡在生产、科研和环保等领域具有广泛的应用。
教学过程
一、沉淀的生成
在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
教学过程
一、沉淀的生成
1.沉淀生成时沉淀剂的选择原则
(1)使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。
(2)不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。
2.常用的沉淀方法
(1)调节pH法
通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。如用CuO调节CuCl2溶液(含Fe3+)的酸碱性以除去Fe3+。
教学过程
(2)直接沉淀法 通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。
方法 举例 解释
调节pH法 除去CuCl2溶液中的FeCl3,可向溶液中加入CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3] CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右 Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
沉淀剂法 以H2S、Na2S等沉淀污水中的Hg2+、Cu2+等重金属离子 H2S、Na2S与Cu2+、Hg2+反应生成沉淀
教学过程
二、沉淀的溶解
查阅资料可知:锅炉内水垢主要成分有Mg(OH)2、CaCO3、CaSO4 等。
请运用沉淀溶解平衡的原理解释去除水垢的原因
教学过程
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
CaCO3(s) Ca2+ (aq) + CO32-(aq)
沉淀
溶解
对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
教学过程
思考:运用沉淀溶解平衡解释稀盐酸除碳酸钙的原理
CaCO3(s) Ca2+ (aq) + CO32-(aq)
+ H+
HCO3- (aq)
解释:CO2气体的生成和逸出,使CO32-的浓度不断减小,使Q < Ksp,平衡向沉淀溶解的方向移动。只要盐酸足够,沉淀完全溶解。
+ H+
H2CO3
H2O + CO2↑
教学过程
实验探究
向两支盛有少量Mg(OH)2固体的试管中分别滴加适量的蒸馏水和盐酸,观察并记录现象
实验步骤
添加的试剂 蒸馏水 盐酸
现象
沉淀不溶解
沉淀溶解
实验结论:加水,对Mg(OH)2的沉淀溶解平衡影响不明显,加盐酸,沉淀溶解
教学过程
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
H2O
+ H+
解释:对于Mg(OH)2的沉淀溶解平衡,H+与OH-反应,使c(OH-)减小,使Q<Ksp,平衡向沉淀溶解的方向移动,只要盐酸足够,沉淀完全溶解。
分析:
教学过程
沉淀溶解方法总结:
① 酸溶法:如CaCO3溶于盐酸,Al(OH)3、Cu(OH)2溶于强酸等。
② 盐溶法:如Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ === Mg2+ + 2NH3·H2O
③ 氧化还原法:如CuS、HgS等可溶于HNO3中
3CuS + 8HNO3 === 3Cu(NO3)2 + 3S + 2NO↑+ 4H2O
④ 配合物法:如 AgCl可溶于NH3·H2O
AgCl+2NH3·H2O === [Ag(NH3)2]++Cl-+2H2O
已知常温下CaCO3的Ksp=3.4×10-9,CaSO4的Ksp=4.9×10-5,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,下列说法正确的是( )
A.只产生CaCO3沉淀
B.产生等量的CaCO3和CaSO4沉淀
C.产生的CaSO4沉淀更多
D.产生的CaCO3沉淀更多
典例1.
课堂练习
【答案】C
【解析】二者都是AB型钙盐,其溶度积常数越大溶解度越大,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,溶度积常数大的物质生成的沉淀越多,根据题干信息知,溶度积常数:CaCO3
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D.都是难溶盐,溶解度无意义
典例2.
课堂练习
【答案】C
【解析】AgCl和Ag2CrO4的阴、阳离子配比类型不同,不能直接利用Ksp来比较二者溶解能力的大小,所以只有C项正确;其余三项叙述均错误。若用溶度积比较溶解度大小,必须是同类型的难溶电解质,否则不能直接比较。
课后小任务
思考:龋齿俗称蛀牙,是口腔的常见病之一。那么,龋齿是怎样发生的呢?
课堂小结
感 谢 倾 听
