【核心素养目标】人教版(2019)高中化学 选择性必修1 3.4 沉淀溶解平衡(第1课时 难溶电解质的沉淀溶解平衡)(有视频)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 3.4 沉淀溶解平衡(第1课时 难溶电解质的沉淀溶解平衡)(有视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 80.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 10:47:27 | ||
图片预览







文档简介
(共24张PPT)
第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,认识难溶电解质在水溶液中存在沉淀溶解平衡。
2.能够根据化学平衡原理分析沉淀溶解平衡的影响因素。
3.能够利用离子积与溶度积常数的关系判断溶液中难溶电解质的沉淀和溶解情况。
学习目标
1.从宏观角度(溶解度)认识沉淀溶解平衡的存在,培养学生“宏观辨识与微观探析”的学科素养。
2.运用化学平衡原理分析,理解沉淀溶解平衡的建立过程,理解沉淀的生成、溶解与转化,学会运用控制变量的方法研究化学反应。培养学生“变化观念与平衡思想”的学科素养。
3.理解掌握溶度积常数的概念,建立认知模型(离子积与溶度积常数的关系与沉淀溶解和沉淀生成的关联),并能利用该模型判断溶液中难溶电解质的沉淀和溶解情况。培养学生的“证据推理与模型认知”的学科素养。
素养目标
情境引入
Mg(OH)2是一种难溶性的碱,但却可以用它来除去工业废水中的一些重金属离子,如:Mn2+、Cu2+。同理,FeS也是一种难溶物质,工业上也可以用它除去污水中的一些重金属离子,如:Cu2+、Hg2+、Pb2+,这是什么原因呢?
教学过程
我们知道,溶液中有沉淀生成是离子反应发生的条件之一。例如,将 AgNO3 溶液与 NaCl 溶液混合,会生成白色的AgCl沉淀,反应的离子方程式为:
Ag+ + Cl-=AgCl↓
思考:
如果上述两种溶液中的AgNO3 和 NaCl 的物质的量相等且充分反应,此时溶液中还有Ag+ 和Cl-吗?
教学过程
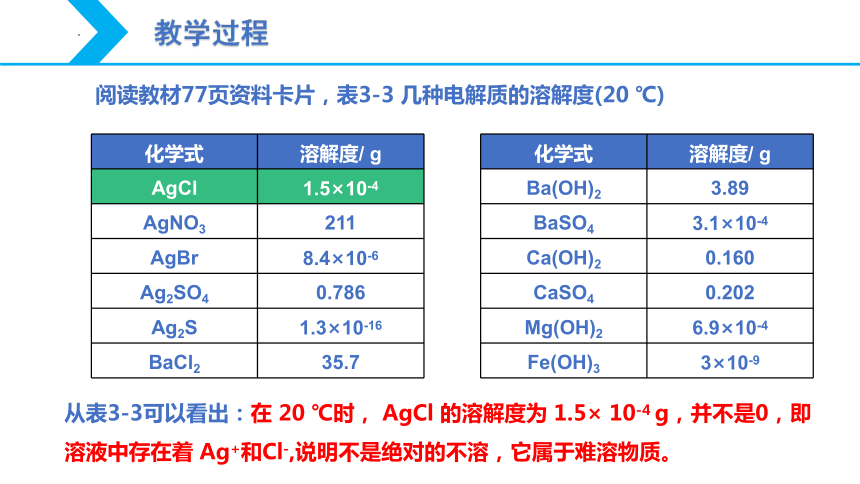
化学式 溶解度/ g
AgCl 1.5×10-4
AgNO3 211
AgBr 8.4×10-6
Ag2SO4 0.786
Ag2S 1.3×10-16
BaCl2 35.7
阅读教材77页资料卡片,表3-3 几种电解质的溶解度(20 ℃)
化学式 溶解度/ g
Ba(OH)2 3.89
BaSO4 3.1×10-4
Ca(OH)2 0.160
CaSO4 0.202
Mg(OH)2 6.9×10-4
Fe(OH)3 3×10-9
从表3-3可以看出:在 20 ℃时, AgCl 的溶解度为 1.5× 10-4 g,并不是0,即溶液中存在着 Ag+和Cl-,说明不是绝对的不溶,它属于难溶物质。
教学过程
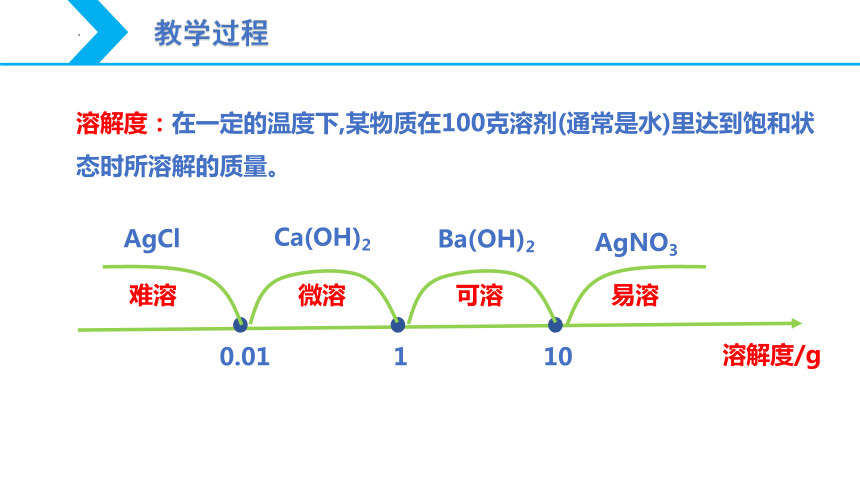
溶解度:在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量。
溶解度/g
难溶
微溶
可溶
易溶
0.01
1
10
AgCl
Ca(OH)2
Ba(OH)2
AgNO3
教学过程
生成AgCl沉淀后,有三种粒子在反应体系中共存:
教学过程
一、难溶电解质的沉淀溶解平衡
在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中,这一过程就是溶解;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,这一过程是沉淀。
教学过程
(1)概念: 在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
(2)建立过程
一、难溶电解质的沉淀溶解平衡
υ(溶解)<υ(沉淀)
固体溶解
υ(溶解)=υ(沉淀)
溶解平衡
υ(溶解)>υ(沉淀)
析出晶体
教学过程
(3)特征
教学过程
二、影响沉淀溶解平衡的因素
(1)内因:难溶电解质本身的结构和性质(决定因素)
(2)外因:——符合“勒夏特列原理“
温度:升高温度,多数平衡向沉淀溶解方向移动。Ca(OH)2除外。
浓度:向平衡体系中加水稀释,平衡向着沉淀溶解方向移到,增大离子浓度,平衡向生成沉淀方向移动。
教学过程
平衡条件 平衡移动方向 c(Ag+) c(Cl-) 溶解度(S)
升高温度
加少量水(有固体剩余)
加NaCl(s)
加AgNO3(s)
ΔH>0
思考讨论:
对于平衡,
改变下列条件,对其有何影响
教学过程
平衡条件 平衡移动方向 c(Ag+) c(Cl-) 溶解度(S)
升高温度 向右 增大 增大 增大
加少量水(有固体剩余) 向右 不变 不变 不变
加NaCl(s) 向左 减小 增大 减小
加AgNO3(s) 向左 增大 减小 减小
ΔH>0
思考讨论:
对于平衡,
改变下列条件,对其有何影响
教学过程
教学过程
二、溶度积常数
一定温度下,沉淀溶解平衡的平衡常数称为溶度积常数,简称溶度积,符号为Ksp
以AmBn(s) mAn+(aq)+nBm-(aq)为例
Ksp(AmBn)=cm(An+)·cn(Bm-)
AgCl:AgCl(s) Ag+(aq) + Cl-(aq)
Ksp(AgCl)=c(Ag+)·c(Cl-)
Ksp (Ag2S)= c2(Ag+)·c(S2- )
Ag2S:Ag2S(s) 2Ag+(aq) + S2-(aq)
1.定义:
2.表达式:
教学过程
① 溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关。
② 溶解平衡一般是吸热的,温度升高,平衡正移,Ksp增大,但Ca(OH)2相反。
3. 影响因素:
对于相同类型的难溶电解质,Ksp越大,说明难溶电解质在水中的溶解能力越大。
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
则溶解度:S (AgCl) > S (AgBr) > S (AgI)
Ksp与难溶电解质的性质和温度有关,与浓度无关,与沉淀量无关。
4. 意义:
对于类型不同的难溶物,不能直接根据 Ksp 的大小来确定,其溶解度的大小,需通过计算转化
教学过程
① MmAn(s) mMn+(aq) + nAm-(aq),任意时刻的离子积:
Q = cm(Mn+)·cn(Am-)
5. 应用:
② 根据Ksp和Q 的相对大小,可判断给定条件下难溶电解质的沉淀或溶解情况:
Q > Ksp,溶液中有沉淀析出
Q = Ksp,沉淀与溶解处于平衡状态
Q < Ksp,溶液中无沉淀析出
教学过程
③有关Ksp计算
【例】25 ℃,Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,求:溶液中Mg2+的浓度?
Ksp=c(Mg2+)·c2(OH-)
c(Mg2+)=2.0 mol/L
=
c(Mg2+)
Ksp
c2(OH-)
=
c(Mg2+)
1.8×10-11
(3.0×10-6)2
Mg(OH)2(s) Mg 2+(aq) + 2OH-(aq)
【解】
答:此时溶液中Mg2+的浓度为2.0 mol/L。
下列对沉淀溶解平衡的描述正确的是( )
A.沉淀开始溶解时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
典例1.
课堂练习
【答案】B
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
典例2.
课堂练习
【答案】C
某温度下向含AgCl固体的AgCl饱和溶液中加入少量稀盐酸,下列说法正确的是( )
A.AgCl的溶解度、Ksp均减小
B.AgCl的溶解度、Ksp均不变
C.AgCl的溶解度减小,Ksp不变
D.AgCl的溶解度不变,Ksp减小
典例3.
课堂练习
【答案】C
课堂小结
课后小任务
1889年德国物理化学家瓦尔特·能斯特他提出溶解压理论,从热力学理论导出了电极电位公式,即“能斯特公式”,同年还提出溶度积理论以解释沉淀反应。
1906年创立了热力学第三定律,即“能斯特热定理”,他在物理化学上作出了重要的贡献,此外,曾研究过氮与氧直接化合成氮的氧化物的工业生产问题。
获诺贝尔化学奖提名76次,于1920年获诺贝尔化学奖。
溶度积的提出者
感 谢 倾 听
第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
人教版选择性必修1
榆次一中 李金虎
学习目标
1.通过实验探究,认识难溶电解质在水溶液中存在沉淀溶解平衡。
2.能够根据化学平衡原理分析沉淀溶解平衡的影响因素。
3.能够利用离子积与溶度积常数的关系判断溶液中难溶电解质的沉淀和溶解情况。
学习目标
1.从宏观角度(溶解度)认识沉淀溶解平衡的存在,培养学生“宏观辨识与微观探析”的学科素养。
2.运用化学平衡原理分析,理解沉淀溶解平衡的建立过程,理解沉淀的生成、溶解与转化,学会运用控制变量的方法研究化学反应。培养学生“变化观念与平衡思想”的学科素养。
3.理解掌握溶度积常数的概念,建立认知模型(离子积与溶度积常数的关系与沉淀溶解和沉淀生成的关联),并能利用该模型判断溶液中难溶电解质的沉淀和溶解情况。培养学生的“证据推理与模型认知”的学科素养。
素养目标
情境引入
Mg(OH)2是一种难溶性的碱,但却可以用它来除去工业废水中的一些重金属离子,如:Mn2+、Cu2+。同理,FeS也是一种难溶物质,工业上也可以用它除去污水中的一些重金属离子,如:Cu2+、Hg2+、Pb2+,这是什么原因呢?
教学过程
我们知道,溶液中有沉淀生成是离子反应发生的条件之一。例如,将 AgNO3 溶液与 NaCl 溶液混合,会生成白色的AgCl沉淀,反应的离子方程式为:
Ag+ + Cl-=AgCl↓
思考:
如果上述两种溶液中的AgNO3 和 NaCl 的物质的量相等且充分反应,此时溶液中还有Ag+ 和Cl-吗?
教学过程
化学式 溶解度/ g
AgCl 1.5×10-4
AgNO3 211
AgBr 8.4×10-6
Ag2SO4 0.786
Ag2S 1.3×10-16
BaCl2 35.7
阅读教材77页资料卡片,表3-3 几种电解质的溶解度(20 ℃)
化学式 溶解度/ g
Ba(OH)2 3.89
BaSO4 3.1×10-4
Ca(OH)2 0.160
CaSO4 0.202
Mg(OH)2 6.9×10-4
Fe(OH)3 3×10-9
从表3-3可以看出:在 20 ℃时, AgCl 的溶解度为 1.5× 10-4 g,并不是0,即溶液中存在着 Ag+和Cl-,说明不是绝对的不溶,它属于难溶物质。
教学过程
溶解度:在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量。
溶解度/g
难溶
微溶
可溶
易溶
0.01
1
10
AgCl
Ca(OH)2
Ba(OH)2
AgNO3
教学过程
生成AgCl沉淀后,有三种粒子在反应体系中共存:
教学过程
一、难溶电解质的沉淀溶解平衡
在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中,这一过程就是溶解;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,这一过程是沉淀。
教学过程
(1)概念: 在一定温度下,当沉淀和溶解的速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。
(2)建立过程
一、难溶电解质的沉淀溶解平衡
υ(溶解)<υ(沉淀)
固体溶解
υ(溶解)=υ(沉淀)
溶解平衡
υ(溶解)>υ(沉淀)
析出晶体
教学过程
(3)特征
教学过程
二、影响沉淀溶解平衡的因素
(1)内因:难溶电解质本身的结构和性质(决定因素)
(2)外因:——符合“勒夏特列原理“
温度:升高温度,多数平衡向沉淀溶解方向移动。Ca(OH)2除外。
浓度:向平衡体系中加水稀释,平衡向着沉淀溶解方向移到,增大离子浓度,平衡向生成沉淀方向移动。
教学过程
平衡条件 平衡移动方向 c(Ag+) c(Cl-) 溶解度(S)
升高温度
加少量水(有固体剩余)
加NaCl(s)
加AgNO3(s)
ΔH>0
思考讨论:
对于平衡,
改变下列条件,对其有何影响
教学过程
平衡条件 平衡移动方向 c(Ag+) c(Cl-) 溶解度(S)
升高温度 向右 增大 增大 增大
加少量水(有固体剩余) 向右 不变 不变 不变
加NaCl(s) 向左 减小 增大 减小
加AgNO3(s) 向左 增大 减小 减小
ΔH>0
思考讨论:
对于平衡,
改变下列条件,对其有何影响
教学过程
教学过程
二、溶度积常数
一定温度下,沉淀溶解平衡的平衡常数称为溶度积常数,简称溶度积,符号为Ksp
以AmBn(s) mAn+(aq)+nBm-(aq)为例
Ksp(AmBn)=cm(An+)·cn(Bm-)
AgCl:AgCl(s) Ag+(aq) + Cl-(aq)
Ksp(AgCl)=c(Ag+)·c(Cl-)
Ksp (Ag2S)= c2(Ag+)·c(S2- )
Ag2S:Ag2S(s) 2Ag+(aq) + S2-(aq)
1.定义:
2.表达式:
教学过程
① 溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关。
② 溶解平衡一般是吸热的,温度升高,平衡正移,Ksp增大,但Ca(OH)2相反。
3. 影响因素:
对于相同类型的难溶电解质,Ksp越大,说明难溶电解质在水中的溶解能力越大。
如:Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
则溶解度:S (AgCl) > S (AgBr) > S (AgI)
Ksp与难溶电解质的性质和温度有关,与浓度无关,与沉淀量无关。
4. 意义:
对于类型不同的难溶物,不能直接根据 Ksp 的大小来确定,其溶解度的大小,需通过计算转化
教学过程
① MmAn(s) mMn+(aq) + nAm-(aq),任意时刻的离子积:
Q = cm(Mn+)·cn(Am-)
5. 应用:
② 根据Ksp和Q 的相对大小,可判断给定条件下难溶电解质的沉淀或溶解情况:
Q > Ksp,溶液中有沉淀析出
Q = Ksp,沉淀与溶解处于平衡状态
Q < Ksp,溶液中无沉淀析出
教学过程
③有关Ksp计算
【例】25 ℃,Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol/L,求:溶液中Mg2+的浓度?
Ksp=c(Mg2+)·c2(OH-)
c(Mg2+)=2.0 mol/L
=
c(Mg2+)
Ksp
c2(OH-)
=
c(Mg2+)
1.8×10-11
(3.0×10-6)2
Mg(OH)2(s) Mg 2+(aq) + 2OH-(aq)
【解】
答:此时溶液中Mg2+的浓度为2.0 mol/L。
下列对沉淀溶解平衡的描述正确的是( )
A.沉淀开始溶解时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
典例1.
课堂练习
【答案】B
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
典例2.
课堂练习
【答案】C
某温度下向含AgCl固体的AgCl饱和溶液中加入少量稀盐酸,下列说法正确的是( )
A.AgCl的溶解度、Ksp均减小
B.AgCl的溶解度、Ksp均不变
C.AgCl的溶解度减小,Ksp不变
D.AgCl的溶解度不变,Ksp减小
典例3.
课堂练习
【答案】C
课堂小结
课后小任务
1889年德国物理化学家瓦尔特·能斯特他提出溶解压理论,从热力学理论导出了电极电位公式,即“能斯特公式”,同年还提出溶度积理论以解释沉淀反应。
1906年创立了热力学第三定律,即“能斯特热定理”,他在物理化学上作出了重要的贡献,此外,曾研究过氮与氧直接化合成氮的氧化物的工业生产问题。
获诺贝尔化学奖提名76次,于1920年获诺贝尔化学奖。
溶度积的提出者
感 谢 倾 听
