【核心素养目标】人教版(2019)高中化学 选择性必修1 4.2 电解池(第2课时 电解规律)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 4.2 电解池(第2课时 电解规律) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第二节 电解池
第2课时 电解规律
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解电解池中阴、阳两极的放电顺序。
2.了解惰性电极电解一些酸、碱、盐溶液的规律,会书写电解电极反应方程式。
学习目标
1.通过从对电极反应的认识和电极方程式的书写,培养学生“宏观辨识与微观探析”的学科素养。
2.通过认识惰性电极电解一些电解质溶液的规律,建立对电解过程的系统分析认识的思维模型,培养学生“证据推理与模型认知”的学科素养。
素养目标
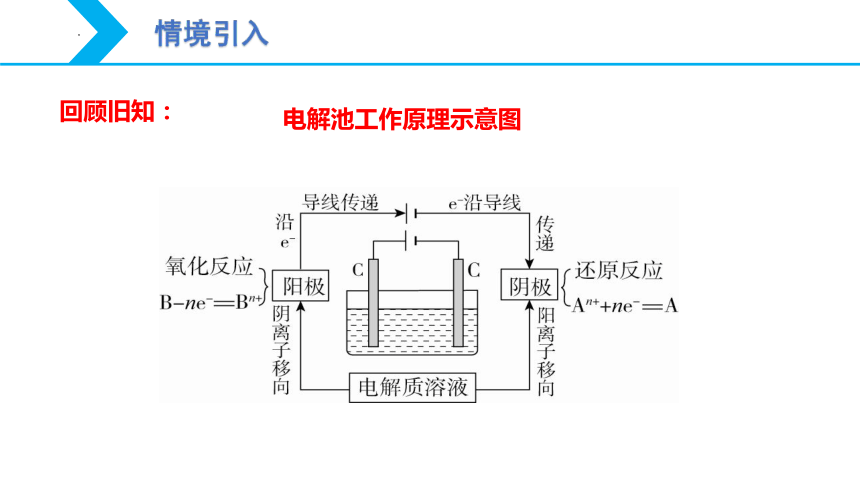
电解池工作原理示意图
情境引入
回顾旧知:
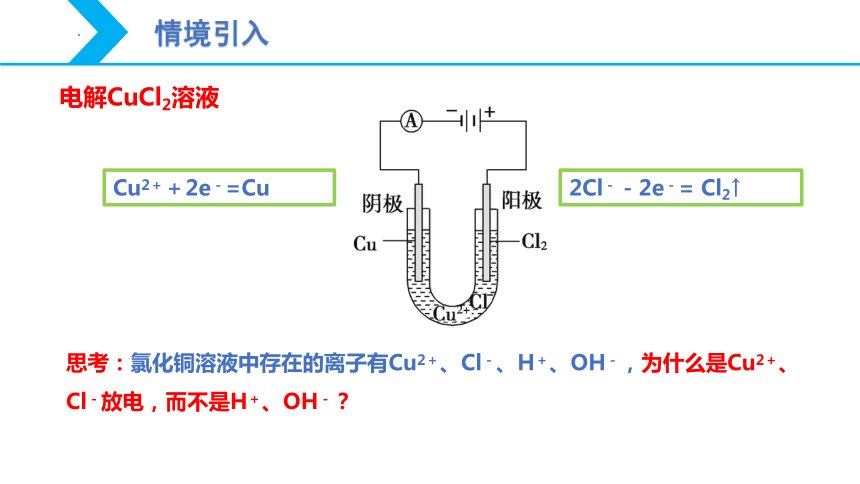
电解CuCl2溶液
Cu2++2e-=Cu
2Cl--2e-= Cl2↑
思考:氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,为什么是Cu2+、Cl-放电,而不是H+、OH-?
情境引入
教学过程
1.阳极
活性电极:金属做阳极(Pt、Au除外),首先金属本身被电解M-ne-=Mn+
惰性电极(Pt、Au、石墨等):还原性强的离子先放电,
放电顺序为S2->I->Br->Cl->OH->含氧酸根>F - 。
一、阳极、阴极的放电顺序
阳极常见放电顺序:活性电极>Cl- >OH-
2Cl--2e-=Cl2
4OH-- 4e- =2H2O + O2↑ 或 2H2O- 4e-=4H++O2↑
碱性溶液
中性或酸性溶液
注意:若H+、OH-由水电离,则反应中需写H2O
教学过程
2.阴极
阴极上放电的总是溶液中的阳离子,与电极材料无关;得电子能力(氧化性)强的离子先放电。
这5种金属离子在水中不放电,只有在熔融状态下放电,制备单质时只有电解熔融氯化物或熔融氧化物。
这4种金属离子浓度较大时,先于H+放电。
Fe3+得电子能力比Cu2+强,Fe3++e-= Fe2+
Ag++e-=Ag
Cu2++2e-=Cu
2H++2e-=H2 ↑或 2H2O+2e-=H2↑+2OH-
酸性溶液
中性或碱性溶液
Ag+>Fe3+>Cu2+>H+酸>Pb2+>Sn2+ >Fe2+>Zn2+>H+水>Al3+>Mg2+>Na+ >Ca2+>K+
教学过程
二、电解规律
1.活泼金属的无氧酸盐(如NaCl溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:2H2O+2e-=H2↑+2OH-
总反应式:2Cl-+2H2O == Cl2↑+H2↑+2OH-
电解
总化学反应式:2NaCl+2H2O == Cl2↑+H2↑+2NaOH
电解
H+水>Na+
Cl- >OH-
放电顺序:
教学过程
二、电解规律
2.不活泼金属的含氧酸盐(如CuSO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:2Cu2++4e-= 2Cu
总反应式:2Cu2++2H2O == 2Cu+O2↑+4H+
电解
总化学反应式:2CuSO4+2H2O == 2Cu+O2↑+2H2SO4
电解
Cu2+>H+水
放电顺序:
OH->SO42-
教学过程
二、电解规律
3.不活泼金属的无氧酸盐(如CuCl2溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:Cu2++2e-= Cu
总反应式:Cu2++2Cl- == Cu+Cl2↑
电解
总化学反应式:CuCl2 == 2Cu+Cl2↑
电解
Cu2+>H+水
放电顺序:
Cl- >OH-
教学过程
二、电解规律
4.无氧酸盐(如HCl溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:2H++2e-=H2 ↑
总反应式:2H++2Cl- == H2 ↑+Cl2↑
电解
总化学反应式:2HCl == H2 ↑+Cl2↑
电解
放电顺序:
Cl- >OH-
教学过程
二、电解规律
5.氧酸盐(如H2SO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:4H++4e-=2H2 ↑
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
OH->SO42-
教学过程
二、电解规律
6.强碱(如NaOH溶液)
惰性电极电解
阳极:4OH-- 4e- =2H2O + O2↑
阴极:4H2O+4e-=2H2↑+4OH-
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
H+水>Na+
教学过程
二、电解规律
7.活泼金属含氧酸盐(如Na2SO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:4H2O+4e-=2H2↑+4OH-
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
H+水>Na+
OH->SO42-
教学过程
规律总结:
1.电解质和水都发生电解型
电解质 NaCl(活泼金属无氧酸盐) CuSO4(不活泼金属含氧酸盐)
阳极反应式 2Cl--2e-= Cl2↑ 2H2O- 4e-=4H++O2↑
阴极反应式 2H2O+2e-=H2↑+2OH- 2Cu2++4e-= 2Cu
pH变化 增大 阴极放氢生碱 减小 阳极放氧生酸
复原加入物质 HCl CuO或CuCO3
教学过程
2.电解电解质型
电解质 HCl(无氧酸) CuCl2(不活泼金属无氧酸盐)
阳极反应式 2Cl--2e-= Cl2↑ 阴极反应式 2H++2e-= H2↑ Cu2++2e-= Cu
pH变化 增大
复原加入物质 HCl CuCl2
教学过程
3.电解水型
电解质 H2SO4(含氧酸) NaOH (可溶性强碱) Na2SO4
(活泼金属含氧盐)
总反应式 2H2O == 2H2 ↑+O2↑ pH变化 减小 增大 不变
复原加入物质 H2O 电解
电解规律(惰性电极)小结(1):
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如 HCl、CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如H2SO4 、NaOH、Na2SO4
阴极:Ag+>Fe3+>Cu2+>H酸+>Fe2+>Zn2+>(H水+)>Al3+>Mg2+>Na+
教学过程
教学过程
1.若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴、阳极同时有H+、OH- 放电,相当于电解水,电解质溶液浓度增大。
2.当电解过程中电解的是水和电解质时,电极反应式中出现的是H+或OH-放电,但在书写总反应式时要将反应物中的H+或OH-均换成水,在生成物中出现的是碱或酸。
3.用惰性电极电解时,若要使电解后的溶液恢复到原状态,应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子,一般加入阴极产物与阳极产物的化合物。
电解规律(惰性电极)小结(2):
教学过程
思考:若用活性电极电解,和惰性电极电解有什么不同呢?
活性电极做阳极要参与反应,做阴极不参与反应
(1) 若A为Cu,B为碳棒,,电解质溶液为NaCl溶液。
阳极:___________________;
阴极: ;
总反应式: 。
(2) 若A为碳棒,B为铁,电解质为Na2SO4溶液。
阳极: ;
阴极: ;
总反应式:_____________________________。
Cu - 2e– = Cu2+
2H2O +2e- = H2↑+2OH-
2H2O -4e- = 4H++O2↑
2H2O +2e- = H2↑+2OH-
Cu+2H2O === Cu(OH)2+H2↑
电解
2H2O===2H2+O2↑
电解
用惰性电极实现下列电解实验,其说法正确的是( )
A.电解稀硫酸,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
典例1.
【答案】D
课堂练习
用惰性电极进行电解,下列说法正确的是( )
A.电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
B.电解CuSO4溶液一段时间后,加入一定质量的Cu(OH)2,溶液能与原溶液完全相同
C.电解硫酸钠溶液时,Na+向阳极移动
D.电解KOH溶液,实质是电解水,故溶液pH不变
典例2.
【答案】A
课堂练习
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
A.0.1 mol CuO
B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2
D.0.05 mol Cu2(OH)2CO3
典例3.
课堂练习
【答案】D
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)。下列说法正确的是( )
A.甲中a的电极反应式为4OH--4e-=O2↑+2H2O
B.电解时向乙滴入酚酞溶液,c电极附近变红
C.向乙中加入适量盐酸,溶液组成可以恢复
D.当b极有64 g Cu析出时,c电极产生2 g气体
典例4.
【答案】A
课堂练习
课堂小结
惰性电极电解电解质溶液规律(四种类型)
感 谢 倾 听
第二节 电解池
第2课时 电解规律
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解电解池中阴、阳两极的放电顺序。
2.了解惰性电极电解一些酸、碱、盐溶液的规律,会书写电解电极反应方程式。
学习目标
1.通过从对电极反应的认识和电极方程式的书写,培养学生“宏观辨识与微观探析”的学科素养。
2.通过认识惰性电极电解一些电解质溶液的规律,建立对电解过程的系统分析认识的思维模型,培养学生“证据推理与模型认知”的学科素养。
素养目标
电解池工作原理示意图
情境引入
回顾旧知:
电解CuCl2溶液
Cu2++2e-=Cu
2Cl--2e-= Cl2↑
思考:氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,为什么是Cu2+、Cl-放电,而不是H+、OH-?
情境引入
教学过程
1.阳极
活性电极:金属做阳极(Pt、Au除外),首先金属本身被电解M-ne-=Mn+
惰性电极(Pt、Au、石墨等):还原性强的离子先放电,
放电顺序为S2->I->Br->Cl->OH->含氧酸根>F - 。
一、阳极、阴极的放电顺序
阳极常见放电顺序:活性电极>Cl- >OH-
2Cl--2e-=Cl2
4OH-- 4e- =2H2O + O2↑ 或 2H2O- 4e-=4H++O2↑
碱性溶液
中性或酸性溶液
注意:若H+、OH-由水电离,则反应中需写H2O
教学过程
2.阴极
阴极上放电的总是溶液中的阳离子,与电极材料无关;得电子能力(氧化性)强的离子先放电。
这5种金属离子在水中不放电,只有在熔融状态下放电,制备单质时只有电解熔融氯化物或熔融氧化物。
这4种金属离子浓度较大时,先于H+放电。
Fe3+得电子能力比Cu2+强,Fe3++e-= Fe2+
Ag++e-=Ag
Cu2++2e-=Cu
2H++2e-=H2 ↑或 2H2O+2e-=H2↑+2OH-
酸性溶液
中性或碱性溶液
Ag+>Fe3+>Cu2+>H+酸>Pb2+>Sn2+ >Fe2+>Zn2+>H+水>Al3+>Mg2+>Na+ >Ca2+>K+
教学过程
二、电解规律
1.活泼金属的无氧酸盐(如NaCl溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:2H2O+2e-=H2↑+2OH-
总反应式:2Cl-+2H2O == Cl2↑+H2↑+2OH-
电解
总化学反应式:2NaCl+2H2O == Cl2↑+H2↑+2NaOH
电解
H+水>Na+
Cl- >OH-
放电顺序:
教学过程
二、电解规律
2.不活泼金属的含氧酸盐(如CuSO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:2Cu2++4e-= 2Cu
总反应式:2Cu2++2H2O == 2Cu+O2↑+4H+
电解
总化学反应式:2CuSO4+2H2O == 2Cu+O2↑+2H2SO4
电解
Cu2+>H+水
放电顺序:
OH->SO42-
教学过程
二、电解规律
3.不活泼金属的无氧酸盐(如CuCl2溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:Cu2++2e-= Cu
总反应式:Cu2++2Cl- == Cu+Cl2↑
电解
总化学反应式:CuCl2 == 2Cu+Cl2↑
电解
Cu2+>H+水
放电顺序:
Cl- >OH-
教学过程
二、电解规律
4.无氧酸盐(如HCl溶液)
惰性电极电解
阳极:2Cl--2e- = Cl2↑
阴极:2H++2e-=H2 ↑
总反应式:2H++2Cl- == H2 ↑+Cl2↑
电解
总化学反应式:2HCl == H2 ↑+Cl2↑
电解
放电顺序:
Cl- >OH-
教学过程
二、电解规律
5.氧酸盐(如H2SO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:4H++4e-=2H2 ↑
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
OH->SO42-
教学过程
二、电解规律
6.强碱(如NaOH溶液)
惰性电极电解
阳极:4OH-- 4e- =2H2O + O2↑
阴极:4H2O+4e-=2H2↑+4OH-
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
H+水>Na+
教学过程
二、电解规律
7.活泼金属含氧酸盐(如Na2SO4溶液)
惰性电极电解
阳极:2H2O- 4e-=4H++O2↑
阴极:4H2O+4e-=2H2↑+4OH-
总化学反应式:2H2O == 2H2 ↑+O2↑
电解
放电顺序:
H+水>Na+
OH->SO42-
教学过程
规律总结:
1.电解质和水都发生电解型
电解质 NaCl(活泼金属无氧酸盐) CuSO4(不活泼金属含氧酸盐)
阳极反应式 2Cl--2e-= Cl2↑ 2H2O- 4e-=4H++O2↑
阴极反应式 2H2O+2e-=H2↑+2OH- 2Cu2++4e-= 2Cu
pH变化 增大 阴极放氢生碱 减小 阳极放氧生酸
复原加入物质 HCl CuO或CuCO3
教学过程
2.电解电解质型
电解质 HCl(无氧酸) CuCl2(不活泼金属无氧酸盐)
阳极反应式 2Cl--2e-= Cl2↑ 阴极反应式 2H++2e-= H2↑ Cu2++2e-= Cu
pH变化 增大
复原加入物质 HCl CuCl2
教学过程
3.电解水型
电解质 H2SO4(含氧酸) NaOH (可溶性强碱) Na2SO4
(活泼金属含氧盐)
总反应式 2H2O == 2H2 ↑+O2↑ pH变化 减小 增大 不变
复原加入物质 H2O 电解
电解规律(惰性电极)小结(1):
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如 HCl、CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如H2SO4 、NaOH、Na2SO4
阴极:Ag+>Fe3+>Cu2+>H酸+>Fe2+>Zn2+>(H水+)>Al3+>Mg2+>Na+
教学过程
教学过程
1.若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴、阳极同时有H+、OH- 放电,相当于电解水,电解质溶液浓度增大。
2.当电解过程中电解的是水和电解质时,电极反应式中出现的是H+或OH-放电,但在书写总反应式时要将反应物中的H+或OH-均换成水,在生成物中出现的是碱或酸。
3.用惰性电极电解时,若要使电解后的溶液恢复到原状态,应遵循“从溶液中析出什么补什么”的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子,一般加入阴极产物与阳极产物的化合物。
电解规律(惰性电极)小结(2):
教学过程
思考:若用活性电极电解,和惰性电极电解有什么不同呢?
活性电极做阳极要参与反应,做阴极不参与反应
(1) 若A为Cu,B为碳棒,,电解质溶液为NaCl溶液。
阳极:___________________;
阴极: ;
总反应式: 。
(2) 若A为碳棒,B为铁,电解质为Na2SO4溶液。
阳极: ;
阴极: ;
总反应式:_____________________________。
Cu - 2e– = Cu2+
2H2O +2e- = H2↑+2OH-
2H2O -4e- = 4H++O2↑
2H2O +2e- = H2↑+2OH-
Cu+2H2O === Cu(OH)2+H2↑
电解
2H2O===2H2+O2↑
电解
用惰性电极实现下列电解实验,其说法正确的是( )
A.电解稀硫酸,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
典例1.
【答案】D
课堂练习
用惰性电极进行电解,下列说法正确的是( )
A.电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
B.电解CuSO4溶液一段时间后,加入一定质量的Cu(OH)2,溶液能与原溶液完全相同
C.电解硫酸钠溶液时,Na+向阳极移动
D.电解KOH溶液,实质是电解水,故溶液pH不变
典例2.
【答案】A
课堂练习
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
A.0.1 mol CuO
B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2
D.0.05 mol Cu2(OH)2CO3
典例3.
课堂练习
【答案】D
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)。下列说法正确的是( )
A.甲中a的电极反应式为4OH--4e-=O2↑+2H2O
B.电解时向乙滴入酚酞溶液,c电极附近变红
C.向乙中加入适量盐酸,溶液组成可以恢复
D.当b极有64 g Cu析出时,c电极产生2 g气体
典例4.
【答案】A
课堂练习
课堂小结
惰性电极电解电解质溶液规律(四种类型)
感 谢 倾 听
