【核心素养目标】人教版(2019)高中化学 选择性必修1 4.2 电解池(第3课时 电解原理的应用)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 4.2 电解池(第3课时 电解原理的应用) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-22 13:11:29 | ||
图片预览







文档简介
(共25张PPT)
第二节 电解池
第3课时 电解原理的应用
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解电解原理在工业生产中的应用。
2.认识电解在实现物质转化和能量储存中的具体应用。
学习目标
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,认识电能与化学能之间的能量转化。培养学生“变化观念与平衡思想”的学科素养。
2.建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
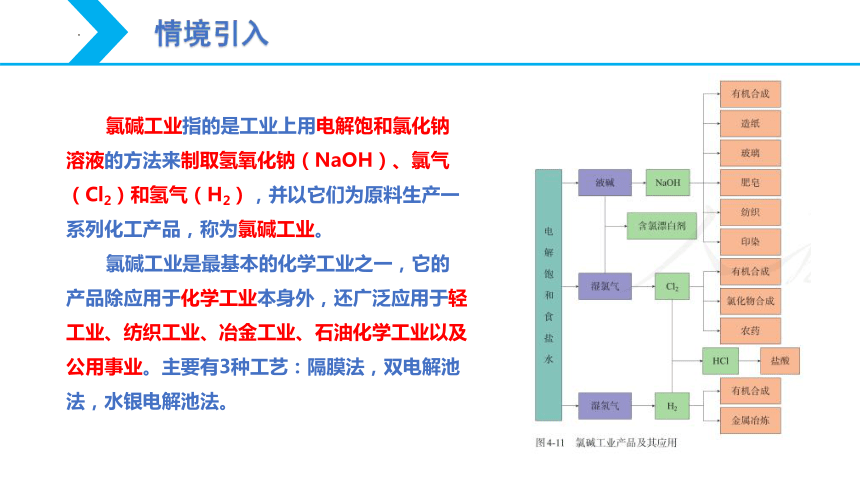
氯碱工业指的是工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2),并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。主要有3种工艺:隔膜法,双电解池法,水银电解池法。
教学过程
一、氯碱工业
1.原理
阳极区 阴极区
教学过程
原因一:Cl2 与 NaOH 反应
原因二:H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
一定条件
Cl2 + 2OH- ClO- + Cl- + H2O
不能,原因如下:
思考:能否用下图电解池制备Cl2、H2 和NaOH?
2.电解装置
思考:如何改进上述装置?
若能控制溶液中离子的移动,即可解决上述问题
教学过程
(1)离子交换膜
含义:离子交换膜又叫隔膜,由高分子特殊材料制成的
作用:能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应
能选择性地通过离子,起到平衡电荷,形成闭合回路的作用
阳离子交换膜:只允许阳离子和水分子通过,阻止阴离子和气体通过
阴离子交换膜:只允许阴离子和水分子通过,阻止阳离子和气体通过
质子交换膜:只允许质子(H+)和水分子通过
分类与应用:
教学过程
装置改进
教学过程
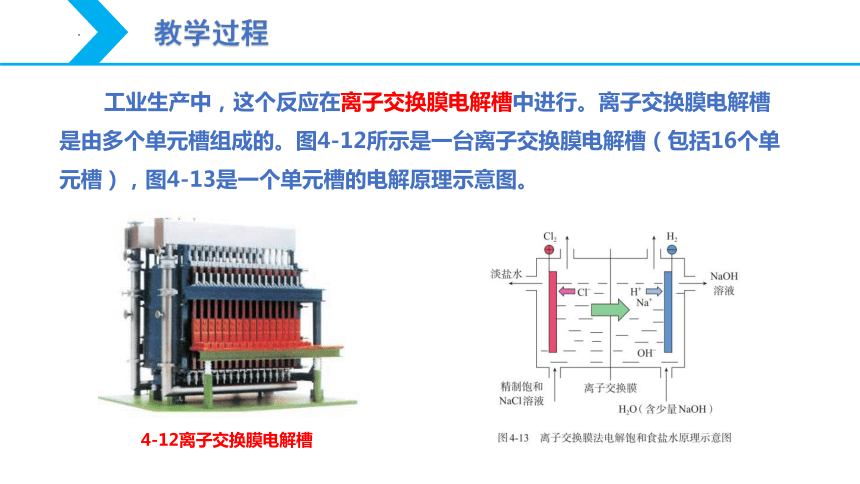
4-12离子交换膜电解槽
工业生产中,这个反应在离子交换膜电解槽中进行。离子交换膜电解槽是由多个单元槽组成的。图4-12所示是一台离子交换膜电解槽(包括16个单元槽),图4-13是一个单元槽的电解原理示意图。
教学过程
思考:若将饱和氯化钠溶液换成熔融状态下的氯化钠,电极反应如何?
阴极:2Na+ + 2e-= 2Na
阳极:2Cl- -2e-= Cl2
总反应:2NaCl(熔融) 2Na + Cl2↑
电解
教学过程
二、电冶金
金属冶炼就是使矿石中的金属离子获得电子变成金属单质的过程:
M n+ + ne - = M
由于电解法可将通常极难被还原的活泼金属从它们的化合物中还原出来,所以是冶炼钠、钙、镁、铝等活泼金属的一种重要方法。
教学过程
二、电冶金
总方程式 阳极、阴极反应式
冶炼钠 2NaCl(熔融) 2Na+Cl2↑ 2Cl--2e-= Cl2↑
2Na++2e-= 2Na
冶炼镁 MgCl2(熔融) Mg+Cl2↑ 2Cl--2e-= Cl2↑
Mg2++2e-= Mg
冶炼铝 2Al2O3(熔融) 4Al+3O2↑ 6O2--12e-= 3O2↑
4Al3++12e-= 4Al
教学过程
【思考】
工业制取镁,用的氯化镁而不用氧化镁?制取铝时,用的是氧化铝而不用氯化铝?
原因:
因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;氯化铝是共价化合物,熔融状态下不导电。
教学过程
工业上制备的铜,其含Cu约98.5%,还含有Fe、Ag、Au等杂质,为粗铜,需要通过再次精炼处理才能得到纯度为99.99%精铜,如何用电解的方法得到纯铜?
思考:
粗铜
精铜
教学过程
电解精炼时,以待精炼的铜作阳极,以纯铜作阴极,用硫酸铜溶液作电解质溶液。这时,阳极上Cu 变成Cu2+ 而溶解,其中含有的一些杂质则沉积在电解槽底部形成阳极泥,阳极泥可作为提炼金、银等的重要原料。
阴极上Cu2+ 变成Cu析出,得到含铜量为99.95% ~ 99.98%的电解铜。
三、电解精炼铜
教学过程
阳极:(粗铜)
阴极:(纯铜)
Cu-2e- = Cu2+
Cu2+ + 2e- = Cu
Fe-2e- = Fe2+
Zn-2e- = Zn2+
金、银进入电解槽底部形成阳极泥,阳极泥可作为提炼金、银等的重要原料。
教学过程
教学过程
生活中为了使金属增强抗腐蚀能力以及增加表面硬度和美观,通常在这些金属表面镀上一薄层在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)
教学过程
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。主要目的是增强金属抗腐蚀能力,增加美观或表面硬度。镀层金属通常是铬、镍、银、黄铜等。
四、电镀
电镀时,通常把待镀的金属制品一端作阴极,把镀层金属一端作阳极,用含有镀层金属离子的溶液作电镀液。
教学过程
铁上镀铜
电解质溶液浓度保持不变
教学过程
电镀(铁制品上镀Cu) 电解精炼铜
阳极 电极材料 镀层金属铜 粗铜(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 Cu-2e-= Cu2+ Cu-2e-= Cu2+、Zn-2e-= Zn2+、Fe-2e-= Fe2+、Ni-2e-= Ni2+
阴极 电极材料 待镀铁制品 精铜
电极反应 Cu2++2e-=Cu 电解质溶液 含Cu2+的盐溶液 电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 电镀和精炼对比
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
典例1.
【答案】A
课堂练习
用电解法可提纯含有某种含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是( )
A.阳极反应式为4OH--4e-=2H2O+O2↑
B.通电后阴极区溶液pH会增大
C.K+通过阳离子交换膜从阴极区移向阳极区
D.纯净的KOH溶液从b口导出
典例2.
【答案】C
课堂练习
采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-=4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
典例3.
课堂练习
【答案】D
课堂小结
感 谢 倾 听
第二节 电解池
第3课时 电解原理的应用
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解电解原理在工业生产中的应用。
2.认识电解在实现物质转化和能量储存中的具体应用。
学习目标
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,认识电能与化学能之间的能量转化。培养学生“变化观念与平衡思想”的学科素养。
2.建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用。培养学生“证据推理与模型认知”的学科素养。
素养目标
情境引入
氯碱工业指的是工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2),并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。主要有3种工艺:隔膜法,双电解池法,水银电解池法。
教学过程
一、氯碱工业
1.原理
阳极区 阴极区
教学过程
原因一:Cl2 与 NaOH 反应
原因二:H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
一定条件
Cl2 + 2OH- ClO- + Cl- + H2O
不能,原因如下:
思考:能否用下图电解池制备Cl2、H2 和NaOH?
2.电解装置
思考:如何改进上述装置?
若能控制溶液中离子的移动,即可解决上述问题
教学过程
(1)离子交换膜
含义:离子交换膜又叫隔膜,由高分子特殊材料制成的
作用:能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应
能选择性地通过离子,起到平衡电荷,形成闭合回路的作用
阳离子交换膜:只允许阳离子和水分子通过,阻止阴离子和气体通过
阴离子交换膜:只允许阴离子和水分子通过,阻止阳离子和气体通过
质子交换膜:只允许质子(H+)和水分子通过
分类与应用:
教学过程
装置改进
教学过程
4-12离子交换膜电解槽
工业生产中,这个反应在离子交换膜电解槽中进行。离子交换膜电解槽是由多个单元槽组成的。图4-12所示是一台离子交换膜电解槽(包括16个单元槽),图4-13是一个单元槽的电解原理示意图。
教学过程
思考:若将饱和氯化钠溶液换成熔融状态下的氯化钠,电极反应如何?
阴极:2Na+ + 2e-= 2Na
阳极:2Cl- -2e-= Cl2
总反应:2NaCl(熔融) 2Na + Cl2↑
电解
教学过程
二、电冶金
金属冶炼就是使矿石中的金属离子获得电子变成金属单质的过程:
M n+ + ne - = M
由于电解法可将通常极难被还原的活泼金属从它们的化合物中还原出来,所以是冶炼钠、钙、镁、铝等活泼金属的一种重要方法。
教学过程
二、电冶金
总方程式 阳极、阴极反应式
冶炼钠 2NaCl(熔融) 2Na+Cl2↑ 2Cl--2e-= Cl2↑
2Na++2e-= 2Na
冶炼镁 MgCl2(熔融) Mg+Cl2↑ 2Cl--2e-= Cl2↑
Mg2++2e-= Mg
冶炼铝 2Al2O3(熔融) 4Al+3O2↑ 6O2--12e-= 3O2↑
4Al3++12e-= 4Al
教学过程
【思考】
工业制取镁,用的氯化镁而不用氧化镁?制取铝时,用的是氧化铝而不用氯化铝?
原因:
因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;氯化铝是共价化合物,熔融状态下不导电。
教学过程
工业上制备的铜,其含Cu约98.5%,还含有Fe、Ag、Au等杂质,为粗铜,需要通过再次精炼处理才能得到纯度为99.99%精铜,如何用电解的方法得到纯铜?
思考:
粗铜
精铜
教学过程
电解精炼时,以待精炼的铜作阳极,以纯铜作阴极,用硫酸铜溶液作电解质溶液。这时,阳极上Cu 变成Cu2+ 而溶解,其中含有的一些杂质则沉积在电解槽底部形成阳极泥,阳极泥可作为提炼金、银等的重要原料。
阴极上Cu2+ 变成Cu析出,得到含铜量为99.95% ~ 99.98%的电解铜。
三、电解精炼铜
教学过程
阳极:(粗铜)
阴极:(纯铜)
Cu-2e- = Cu2+
Cu2+ + 2e- = Cu
Fe-2e- = Fe2+
Zn-2e- = Zn2+
金、银进入电解槽底部形成阳极泥,阳极泥可作为提炼金、银等的重要原料。
教学过程
教学过程
生活中为了使金属增强抗腐蚀能力以及增加表面硬度和美观,通常在这些金属表面镀上一薄层在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)
教学过程
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。主要目的是增强金属抗腐蚀能力,增加美观或表面硬度。镀层金属通常是铬、镍、银、黄铜等。
四、电镀
电镀时,通常把待镀的金属制品一端作阴极,把镀层金属一端作阳极,用含有镀层金属离子的溶液作电镀液。
教学过程
铁上镀铜
电解质溶液浓度保持不变
教学过程
电镀(铁制品上镀Cu) 电解精炼铜
阳极 电极材料 镀层金属铜 粗铜(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 Cu-2e-= Cu2+ Cu-2e-= Cu2+、Zn-2e-= Zn2+、Fe-2e-= Fe2+、Ni-2e-= Ni2+
阴极 电极材料 待镀铁制品 精铜
电极反应 Cu2++2e-=Cu 电解质溶液 含Cu2+的盐溶液 电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 电镀和精炼对比
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
典例1.
【答案】A
课堂练习
用电解法可提纯含有某种含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是( )
A.阳极反应式为4OH--4e-=2H2O+O2↑
B.通电后阴极区溶液pH会增大
C.K+通过阳离子交换膜从阴极区移向阳极区
D.纯净的KOH溶液从b口导出
典例2.
【答案】C
课堂练习
采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-=4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
典例3.
课堂练习
【答案】D
课堂小结
感 谢 倾 听
