【核心素养目标】人教版(2019)高中化学 选择性必修1 4.3 金属的腐蚀与防护(第1课时 金属的腐蚀)
文档属性
| 名称 | 【核心素养目标】人教版(2019)高中化学 选择性必修1 4.3 金属的腐蚀与防护(第1课时 金属的腐蚀) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-09-18 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第三节 金属的腐蚀与防护
第1课时 金属的腐蚀
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。
2. 了解析氢腐蚀与吸氧腐蚀,会书写电极反应方程式。
学习目标
通过探究金属腐蚀的本质及其原因,培养学生“宏观辨识与微观探析”的学科素养。
素养目标
情境引入
在日常生活中,我们经常见到钢铁制品生锈,铜制品长出铜绿,这就是金属腐蚀的现象。金属腐蚀的现象普遍存在,常常是自发进行的。
金属腐蚀会使桥梁、建筑物的金属构架强度降低而造成坍塌,会使地下金属管道发生泄漏、轮船船体损坏等。因此,了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要意义。
教学过程
1.金属腐蚀
金属或合金与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.实质
金属失电子变成阳离子,被氧化,其反应为:M - ne- = Mn+
如:Fe - 2e- = Fe2+
铁发生腐蚀时,产物是Fe2+
一、金属的腐蚀
教学过程
一、金属的腐蚀
3.分类
金属与其表面接触的一些物质(如O2 、Cl2 、SO2 等)直接反应而引起的腐蚀叫做化学腐蚀。例如,铁与氯气直接反应而腐蚀,输油、输气的钢管被原油、天然气中的含硫化合物腐蚀等。温度对化学腐蚀的影响很大。例如,钢材在高温下容易被氧化,表面生成由FeO、Fe2O 3 、Fe3O4组成的一层氧化物。
(1)化学腐蚀
教学过程
铁与氯气直接反应而腐蚀
输油、输气的钢管被原油、天然气中的含硫化合物腐蚀
高温条件被腐蚀的燃气灶
(1)化学腐蚀
教学过程
当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀,这种腐蚀叫做电化学腐蚀。钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀的典型例子。
(2)电化学腐蚀
教学过程
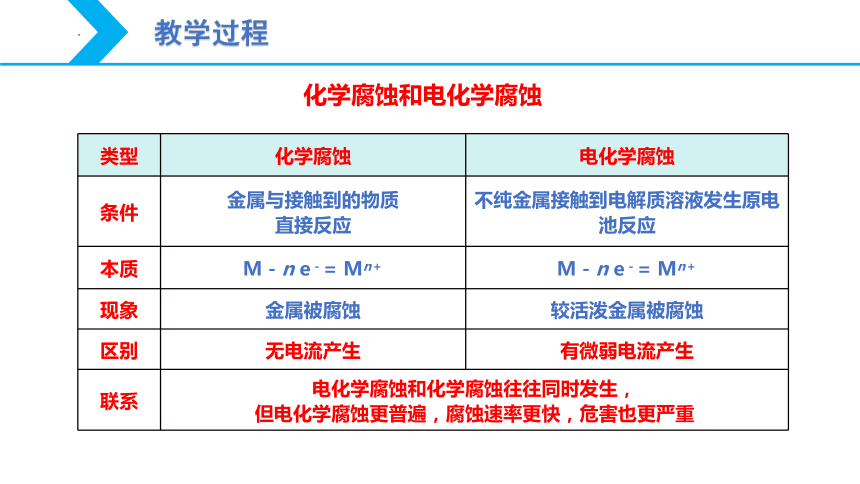
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的物质 直接反应 不纯金属接触到电解质溶液发生原电池反应
本质 M-n e-= Mn+ M-n e-= Mn+
现象 金属被腐蚀 较活泼金属被腐蚀
区别 无电流产生 有微弱电流产生
联系 电化学腐蚀和化学腐蚀往往同时发生, 但电化学腐蚀更普遍,腐蚀速率更快,危害也更严重 化学腐蚀和电化学腐蚀
教学过程
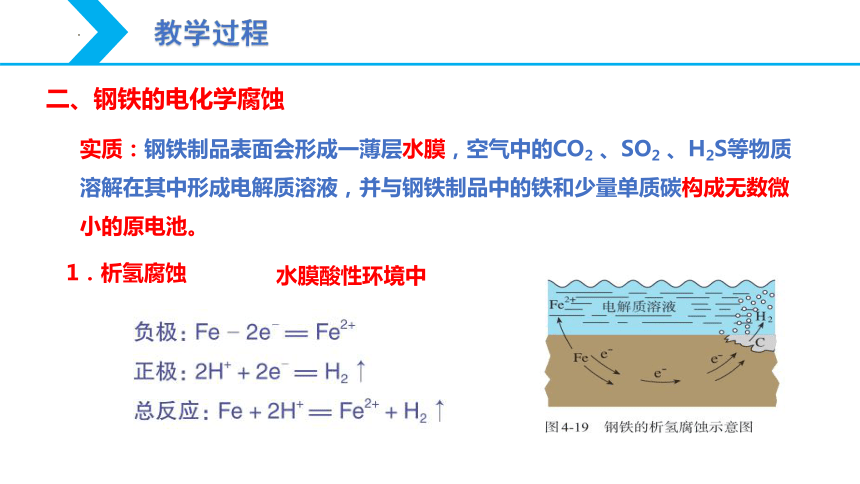
二、钢铁的电化学腐蚀
实质:钢铁制品表面会形成一薄层水膜,空气中的CO2 、SO2 、H2S等物质溶解在其中形成电解质溶液,并与钢铁制品中的铁和少量单质碳构成无数微小的原电池。
1.析氢腐蚀
水膜酸性环境中
教学过程
2.吸氧腐蚀
水膜酸性很弱或呈中性
Fe2+ + 2OH- = Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
2Fe(OH)3 = Fe2O3·xH2O + (3﹣x)H2O
铁锈生成
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
教学过程
教学过程
思考:金属腐蚀快慢与哪些因素有关呢?如何比较呢?
我们知道:相对干燥的地区,水分少,金属不易腐蚀,而潮湿多雨的地区,温度高,易发生电化学腐蚀。
教学过程
判断金属腐蚀快慢的规律
(两极材料的活动性差别越大,氧化还原反应的速率越快,活泼金属被腐蚀的速度越快)
1. 与构成原电池两极的材料有关
(电解池的阳极 > 原电池的负极 > 化学腐蚀 > 原电池的正极 > 电解池的阴极)
2. 同一电解质溶液中
(强电解质中>弱电解质中>非电解质中)
3. 同一种金属在相同浓度不同介质中
教学过程
(无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀)
4. 有无保护措施的腐蚀快慢顺序
5. 同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快
判断金属腐蚀快慢的规律
教学过程
探究一:将经过酸洗除锈的铁钉用饱和食盐水浸泡一下,放入图中所示的具支试管中。几分钟后,观察导管中水柱的变化,解释引起这种变化的原因。
实验探究 铁钉的吸氧腐蚀实验
实验现象:
导管中液面上升
实验解释 :
装置中铁、碳、饱和食盐水构成原电池,铁钉发生吸氧腐蚀,压强变小
教学过程
探究二:取两支试管,分别放入两颗锌粒和等体积、等浓度的稀盐酸,观察现象。然后,向其中一支试管中滴加1 ~ 2滴硫酸铜溶液,再观察现象。解释产生不同现象的原因。
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,Zn、Cu、稀盐酸构成原电池,形成电化学腐蚀,能加快反应速率
实验现象:
实验解释 :
下列关于金属腐蚀的说法正确的是( )
A.金属在潮湿空气中腐蚀的实质是M+nH2O=M(OH)n+(n/2)H2↑
B.金属化学腐蚀的实质是M-ne-=Mnn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
典例1.
【答案】B
课堂练习
下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③
B.②>①>③>④
C.④>②>③>①
D.③>②>④>①
典例2.
【答案】A
课堂练习
下列与金属腐蚀有关的说法,正确的是( )
A.图1,铁钉易被腐蚀
B.图2,加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
典例3.
课堂练习
【答案】C
课堂小结
金属的腐蚀
金属腐蚀的本质及其原因
金属腐蚀的主要类型
现象
本质
吸氧腐蚀
析氢腐蚀
危害
金属腐蚀的速率快慢
影响因素
规律
课后小任务
感 谢 倾 听
第三节 金属的腐蚀与防护
第1课时 金属的腐蚀
人教版选择性必修1
榆次一中 李金虎
学习目标
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。
2. 了解析氢腐蚀与吸氧腐蚀,会书写电极反应方程式。
学习目标
通过探究金属腐蚀的本质及其原因,培养学生“宏观辨识与微观探析”的学科素养。
素养目标
情境引入
在日常生活中,我们经常见到钢铁制品生锈,铜制品长出铜绿,这就是金属腐蚀的现象。金属腐蚀的现象普遍存在,常常是自发进行的。
金属腐蚀会使桥梁、建筑物的金属构架强度降低而造成坍塌,会使地下金属管道发生泄漏、轮船船体损坏等。因此,了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要意义。
教学过程
1.金属腐蚀
金属或合金与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.实质
金属失电子变成阳离子,被氧化,其反应为:M - ne- = Mn+
如:Fe - 2e- = Fe2+
铁发生腐蚀时,产物是Fe2+
一、金属的腐蚀
教学过程
一、金属的腐蚀
3.分类
金属与其表面接触的一些物质(如O2 、Cl2 、SO2 等)直接反应而引起的腐蚀叫做化学腐蚀。例如,铁与氯气直接反应而腐蚀,输油、输气的钢管被原油、天然气中的含硫化合物腐蚀等。温度对化学腐蚀的影响很大。例如,钢材在高温下容易被氧化,表面生成由FeO、Fe2O 3 、Fe3O4组成的一层氧化物。
(1)化学腐蚀
教学过程
铁与氯气直接反应而腐蚀
输油、输气的钢管被原油、天然气中的含硫化合物腐蚀
高温条件被腐蚀的燃气灶
(1)化学腐蚀
教学过程
当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀,这种腐蚀叫做电化学腐蚀。钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀的典型例子。
(2)电化学腐蚀
教学过程
类型 化学腐蚀 电化学腐蚀
条件 金属与接触到的物质 直接反应 不纯金属接触到电解质溶液发生原电池反应
本质 M-n e-= Mn+ M-n e-= Mn+
现象 金属被腐蚀 较活泼金属被腐蚀
区别 无电流产生 有微弱电流产生
联系 电化学腐蚀和化学腐蚀往往同时发生, 但电化学腐蚀更普遍,腐蚀速率更快,危害也更严重 化学腐蚀和电化学腐蚀
教学过程
二、钢铁的电化学腐蚀
实质:钢铁制品表面会形成一薄层水膜,空气中的CO2 、SO2 、H2S等物质溶解在其中形成电解质溶液,并与钢铁制品中的铁和少量单质碳构成无数微小的原电池。
1.析氢腐蚀
水膜酸性环境中
教学过程
2.吸氧腐蚀
水膜酸性很弱或呈中性
Fe2+ + 2OH- = Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
2Fe(OH)3 = Fe2O3·xH2O + (3﹣x)H2O
铁锈生成
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
教学过程
教学过程
思考:金属腐蚀快慢与哪些因素有关呢?如何比较呢?
我们知道:相对干燥的地区,水分少,金属不易腐蚀,而潮湿多雨的地区,温度高,易发生电化学腐蚀。
教学过程
判断金属腐蚀快慢的规律
(两极材料的活动性差别越大,氧化还原反应的速率越快,活泼金属被腐蚀的速度越快)
1. 与构成原电池两极的材料有关
(电解池的阳极 > 原电池的负极 > 化学腐蚀 > 原电池的正极 > 电解池的阴极)
2. 同一电解质溶液中
(强电解质中>弱电解质中>非电解质中)
3. 同一种金属在相同浓度不同介质中
教学过程
(无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀)
4. 有无保护措施的腐蚀快慢顺序
5. 同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快
判断金属腐蚀快慢的规律
教学过程
探究一:将经过酸洗除锈的铁钉用饱和食盐水浸泡一下,放入图中所示的具支试管中。几分钟后,观察导管中水柱的变化,解释引起这种变化的原因。
实验探究 铁钉的吸氧腐蚀实验
实验现象:
导管中液面上升
实验解释 :
装置中铁、碳、饱和食盐水构成原电池,铁钉发生吸氧腐蚀,压强变小
教学过程
探究二:取两支试管,分别放入两颗锌粒和等体积、等浓度的稀盐酸,观察现象。然后,向其中一支试管中滴加1 ~ 2滴硫酸铜溶液,再观察现象。解释产生不同现象的原因。
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,Zn、Cu、稀盐酸构成原电池,形成电化学腐蚀,能加快反应速率
实验现象:
实验解释 :
下列关于金属腐蚀的说法正确的是( )
A.金属在潮湿空气中腐蚀的实质是M+nH2O=M(OH)n+(n/2)H2↑
B.金属化学腐蚀的实质是M-ne-=Mnn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
典例1.
【答案】B
课堂练习
下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③
B.②>①>③>④
C.④>②>③>①
D.③>②>④>①
典例2.
【答案】A
课堂练习
下列与金属腐蚀有关的说法,正确的是( )
A.图1,铁钉易被腐蚀
B.图2,加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
典例3.
课堂练习
【答案】C
课堂小结
金属的腐蚀
金属腐蚀的本质及其原因
金属腐蚀的主要类型
现象
本质
吸氧腐蚀
析氢腐蚀
危害
金属腐蚀的速率快慢
影响因素
规律
课后小任务
感 谢 倾 听
